磷脂促进婴儿大脑发育研究进展
2018-03-26解庆刚李雪许英伟蒋士龙
解庆刚,李雪,许英伟,蒋士龙
(黑龙江飞鹤乳业有限公司技术研发中心,北京100015)
0 引言
婴儿出生的第一年内,大约60%的能量用于婴儿大脑发育生长,其中大部分能量用于合成神经元膜和髓鞘发育。母乳提供的脂类,不仅仅提供能量,还为婴儿大脑及神经的发育提供必要的营养物质[1],乳磷脂约占母乳脂类的0.5%~1%,按其组成结构分为两类:磷酸甘油酯和神经鞘磷脂,前者以甘油为基础,后者以神经鞘氨醇为基础,虽然母乳磷脂占总脂类比例小,但对婴儿生长发育有着非常重要的作用[2,3]。由于乳磷脂大部分存在脂肪球膜上,目前婴儿配方粉使用大量植物油替代乳脂肪,特别是使用脱脂乳(粉)的配方,脂肪完全由植物替代,导致婴儿配方粉中多种乳磷脂含量远远低于母乳水平。因此本文就磷脂对婴儿大脑发育的作用等方面进行了阐述,旨在呼吁国内婴儿食品开发领域对乳磷脂的重视,为婴幼儿食品开发和提高配方粉喂养效果提供理论依据。
1 大脑发育的关键期与磷脂组分分布
人类大脑神经发育有两个重要阶段,第一个阶段在胎儿时期,如图1[4],胎龄4周时大脑神经胚基本形成,胎龄4~12周是神经元增值阶段,从胎龄12周神经元开始迁移,到足月(满37周)基本完成。第二阶段是出生至2岁,这个阶段是髓鞘发育的关键期,Faria等研究显示婴儿2岁内是脑髓鞘发育最快的时期,2岁以后发育将变得缓慢[5],脑髓鞘的形成被认为是脑发育走向成熟的一个重要标志,髓鞘的发育对神经功能发育有着重大的影响[6]。在髓鞘的发育过程,髓鞘中胆固醇与糖脂的含量在出生后6~8个月内迅速增加,随着髓鞘的成熟,髓鞘中胆固醇质量比降低,磷脂质量比增加,最终成熟的髓鞘中的脂质由25%的胆固醇、29%的半乳糖脂和46%的磷脂构成[7];成熟的髓鞘中磷脂种类分布的质量百分比为磷脂酰胆碱(PC)27.1%±2.97%;磷脂酰乙醇胺(PE)23.3%±3.98%;丝氨酸磷脂(PS)19.2%±2.17%;磷脂酰肌醇(PI)<1%;鞘磷脂(SM)22.3%±1.68%;乙醇胺醛缩磷脂7.6%±4.16%[8]。

图1 不同阶段脑神经发育过程[4]
人脑的生长主要在2岁以前,如图2[9],新生的足月儿脑鲜重约为370~400 g,宫内完成成人脑的25%生长,出生6个月时约达到成人脑重的50%,婴儿1岁时脑鲜重达900 g左右,相当于成人脑鲜重的60%~70%。幼儿2岁以后,脑鲜重的增长速度开始减缓,在3岁时大脑鲜重量完成大约80%的生长,大脑的生长会持续到成年,脑鲜重达到1 250~1 500 g。
磷脂在婴儿大脑生长发育过程具有非常重要作用,是构成生物膜重要的物质,约占婴儿大脑总干物的四分之一[10-11],其中PC约占总磷脂的50%,PE约总磷脂的占30%,其他三种磷脂PS、PI和SM约占20%[11],如表1所示。可见婴儿出生后,特别是3岁内是婴儿大脑生长及髓鞘等神经发育的关键期,膳食营养应满足婴儿大脑发育各种营养需要,特别是脂类中的多种磷脂。

图2 大脑相对生长发育曲线[9]
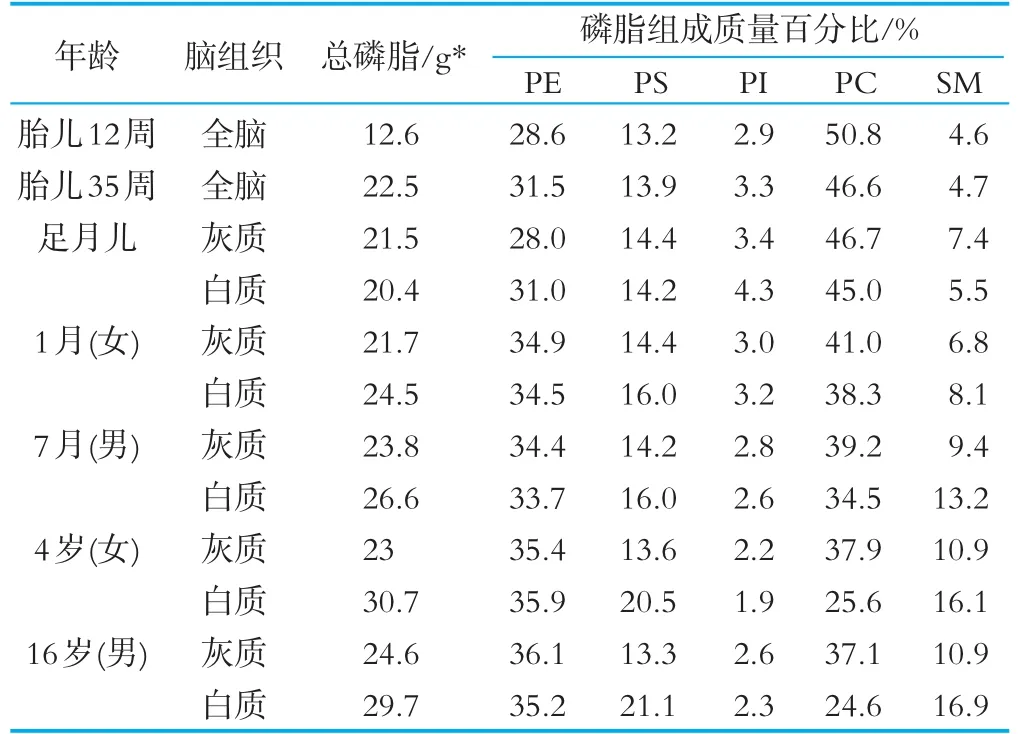
表1 是正常人大脑各磷脂组分的分布[11]
2 乳磷脂的最佳来源
脂类是母乳重要营养成分,质量浓度为(3.5~4.5)g/100 mL,其中98%为甘油三酯,母乳中的脂肪以脂肪球的形式存在,包裹脂肪球的膜性结构,被称之为乳脂球膜(milk fat globule membrane,MFGM),母乳中M FGM脂质的含量仅为乳汁中总脂的0.5%~1%,但主要是磷脂,包括甘油磷脂和鞘磷脂等极性脂类,占乳脂总磷脂的60%~70%[12],虽然母乳磷脂约占0.5%左右,但对婴幼儿生长发育有着非常重要的作用[2-3]。除了母乳磷脂,牛乳、蛋黄和大豆都含有相当数量的磷脂,如表2不同来源磷脂构成比较,蛋黄磷脂主要是磷脂酰胆碱,占到总磷脂72.9%,神经鞘磷脂、磷脂酰肌醇和丝氨酸磷脂含量很少[13],大豆磷脂主要是磷脂酰乙醇胺和磷脂酰胆碱,分别占到37%和46.3%,神经鞘磷脂、磷脂酰肌醇和丝氨酸磷脂含量较少[13],在组成方面与母乳的差异均较大;因此,除母乳之外,牛乳是磷脂的最佳来源,母乳与牛乳中磷脂含量虽然有一定差异,但整体组成很类似,如表3所示。

表2 不同来源磷脂组成比较 %
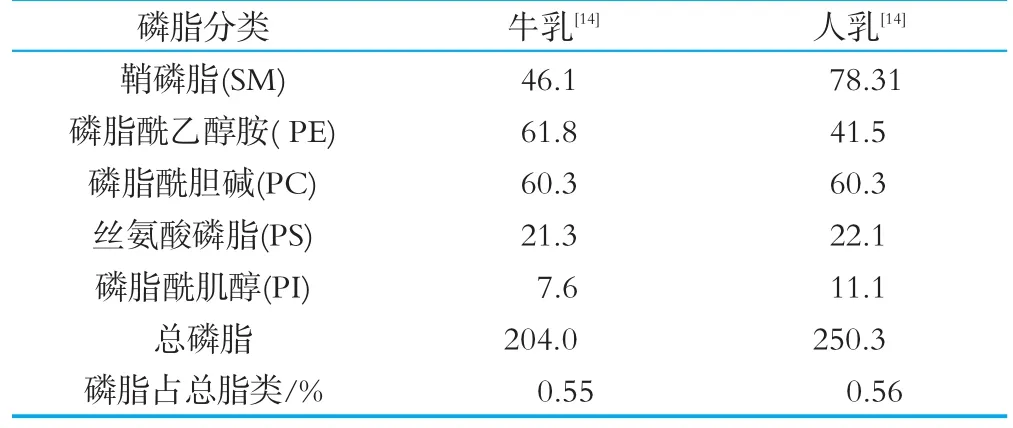
表3 牛乳与母乳磷脂在乳汁中的质量浓度 μg/mL
虽然母乳是婴幼儿最理想的食物,但由于女性工作、健康等原因,婴儿的母乳喂养率较低,因此,以牛乳为基础的配方乳粉成为婴幼儿主要母乳替代品,但绝大多数婴幼儿配方食品没有使用带有乳脂球膜的牛乳脂肪,而使用了多种植物油配方来模拟母乳脂肪含量及脂肪酸构成[15],因此目前婴幼儿配方食品磷脂含量与母乳差距较大,有待进一步提升。
3 磷脂对婴儿大脑发育的重要作用
Lagarde[18]等借助体外重组血脑屏障,发现酯化为溶血磷脂酰胆碱(LysoPC)的DHA比非酯化的DHA更容
3.1 磷脂有助于脂肪酸乳化、消化、吸收、运转和利用
磷脂不仅是生物膜的重要组成成分,而且对脂肪的吸收和运转及储存脂肪酸,特别是不饱和脂肪酸起着重要的作用[16]。在脂肪乳化过程,从食物摄取的磷脂以及内源性胆汁磷脂有助于将脂肪乳化成微小的脂滴;在脂肪的消化过程,脂肪酶通过脂滴表面磷脂层与脂滴结合[16-17];在运转利用过程,溶血磷脂可以通过体内的酶将部分DHA、AA等不饱和脂肪酸酯化到溶血磷脂甘油骨架的2位上,运送到机体所需部位[18]。
3.2 对DHA和AA等长链多不饱和脂肪生物利用具协同作用
DHA和AA等不饱和脂肪酸对婴幼儿大脑和视力的发育有着重要的生理作用已被广泛证实[19-22];DHA、AA存在的形式影响其在体内的吸收利用率。许多研究表明DHA、ARA等不饱和脂肪酸与PL(磷脂)结合比与TG(甘油三酯)结合的吸收率更高。Carnielli等[23]对于早产儿的研究发现,配方奶或母乳中的磷脂型长链多不饱和脂肪酸(PL-LCPFA)比甘油三酯型长链多不饱和脂肪酸(TG-LCPFA)更易被吸收。易穿越血脑屏障,表明LysoPC是DHA运往大脑较好的工具。Thies[24]以老鼠大脑为研究对象,比较DHA不同酯化形式的吸收率,研究表明,当DHA连接到溶血磷脂甘油骨架的2位时,其吸收效率是非酯化DHA的12倍。
Thies[25]等为了证明结合在血浆白蛋白上的不饱和2-酰基-溶血磷脂酰胆碱(2-acyl-lysoPC)是多不饱和脂肪酸运送到大脑的有效工具,给20 d龄的小鼠喂食标记过的棕榈酸、油酸、亚油酸、花生四烯酸,以未酯化和酯化在2-酰基-溶血磷脂酰胆碱两种形式。30 s后观察发现:棕榈酸溶血磷脂酰胆碱与未酯化的棕榈酸在小鼠脑中的吸收率和峰值类似,而油酸、亚油酸和花生四烯酸(AA)这几种不饱和脂肪酸酯化到溶血磷脂酰胆碱后的吸收速率和吸收峰值是未酯化时的6~10倍。2-酰基-溶血磷脂酰胆碱被吸收后没有优先被水解而是酰化成双标记的磷脂酰胆碱,在大脑组织中,2-酰基-溶血磷脂酰胆碱部分水解,两个脂肪酰基重新分配形成其他磷脂种类,其中花生四烯酸比例最高。可见磷脂对对DHA、AA等长链多不饱和脂肪生物利用具协同作用。
3.3 磷脂对大脑发育和认知的影响
人脑具有200亿个神经细胞,各种神经细胞之间,依靠乙酰胆碱来传递信息,磷脂酰胆碱是乙酰胆碱的前体,其在体内水解成胆碱、甘油磷脂、脂肪酸,胆碱随着血液循环系统进入大脑,与乙酸结合转化为乙酰胆碱。由于乙酰胆碱的存在,脑神经细胞之间特别是脑神经元之间才能相互沟通,建立起稳定的联系,形成良好的记忆和思维活动其含量增加时,大脑神经细胞之间的信息传递速度会加快,记忆功能得到增强,大脑的活力也随之明显提高因此,补充外源性磷脂酰胆碱可使大脑和神经系统健康完善,提高记忆力[26],许多研究都已证实这一点。
母乳含有丰富的磷脂和神经节苷脂,母乳喂养比配方粉喂养的婴儿学习能力强,Liu等人[27]研究膳食摄入磷脂和神经节苷脂对大脑与认知发展的影响,采用出生2 d的猪仔喂食含有不同剂量的磷脂和神经节苷脂食物补充剂至28 d,补充剂为牛乳磷脂Lacprodan PL-20,添加量分别为0%(对照),0.8%,2.5%,自出生14 d起采用空间T迷宫法进行智力评估,出生28 d后给猪仔进行脑M R I检查和海马组织分析。结果显示两个补充组空间T迷宫实验出错率比对照组的低(补充组平均正确率80%,对照组平均正确率75%;P<0.01),选择时间更短(补充组每次实验选择耗时3s,对照组每次实验选择耗时5 s,P<0.01);两个补充组大脑平均质量比对照组高5%,多个脑区域的灰质和白质也比对照组多,而两个剂量组之间差异不大。海马组织的代谢分析显示,饮食改变了磷脂酰胆碱相关的代谢产物,该研究证明:摄入磷脂和神经节苷脂改善了猪仔的空间学习能力,影响了猪仔的大脑生长和组成。
Tanaka[28]等在日本开展一项随机双盲对照研究,将24名出生体重低于1.5 kg的早产儿随机分为两组,强化组为喂鞘磷脂(SM)强化奶(SM占乳磷脂20%),对照组为普通奶(SM占乳磷脂13%),跟踪18个月后,强化组在BSID-Ⅱ行为评分,Fagan评分和视觉诱发电位(VEP)潜伏期等指标均优于对照组,实验表明:摄入强化SM的配方奶的婴儿与神经行为发育呈正相关。
Tim by[29]等在瑞典开展的前瞻性随机双盲对照试验,160名小于2月龄婴儿被随机分为添加牛乳脂肪球膜成份(MFGM)的实验配方奶和普通配方奶喂养至6月龄,另80名母乳喂养儿为对照,每100 mL实验配方奶含能量、蛋白、奶磷脂和胆固醇分别为251 kJ,1.2 g,70 m g和8 m g,每100 mL普通配方奶含能量、蛋白、奶磷脂和胆固醇分别为276 kJ,1.27 g,30m g和4 m g。12月龄时用Bayley婴幼儿发展评估量表(第3版)评分结果显示。实验(MFGM)组认知评分为105.8±9.2,显著高于普通配方组的101.8±8.0(P=0.008),而与母乳喂养组无显著差异(106.4±9.5;P=0.73)。因此认为在2~6月龄配方奶粉中添加富含乳磷脂的乳脂肪球膜成分可以减少配方奶粉喂养和母乳喂养儿在12月龄时认知发展上的差异。
4 结果
目前我国未将磷脂作为婴幼儿食品营养强化剂,但是磷脂对于大脑生长、神经发育、不饱和脂肪酸生物利用具有重要的积极意义,因此,婴儿直接从母乳和配方奶粉中补充乳磷脂对大脑发育意义重大,但是,绝大多数婴幼儿配方食品没有使用带有乳脂球膜的牛乳脂肪,而使用了多种植物油配方来模拟母乳脂肪含量及脂肪酸构成,因此我国婴儿配方粉中的磷脂含量有待进一步提高。国内婴儿营养研究人员和婴儿粉企业应对乳磷脂对婴儿大脑发育方面的影响加以重视,提高婴儿配方奶粉多种乳磷脂含量以改善婴儿粉喂养效果。
参考文献:
[1]FARQUHARSON J,JAMIESON E C,ABBASIK A,et al.Effect of diet on the fatty acid composition of the major phospholipids of infant cerebral cortex[J].Archives of Disease in Childhood,1995,72(3):198-203.
[2]JENSEN R G.Lipids in human milk[J].Lipids,1999,34(34):1243-1271.
[3]CILLA A,DIEGOQUINTAES K,BARBER Á R,et al.Phospholipids in Human Milk and Infant Formulas:Benefits and Needs for Correct Infant Nutrition[J].Critical Reviews in Food Science&Nutrition,2015,56(11):1880-1892.DOI:10.1080/10408398.2013.803951.
[4]TAU G Z,PETERSON B S.Normal Development of Brain Circuits.Neuropsychopharmacology[J].2010,35,147-168,DO I:10.1038/npp.2009.115.
[5]FARIA A V,ZHANG J,O ISH IK,et al.Atlas-based analysis of neurodevelopment from infancy to adulthood using diffusion tensor imaging and applications for automated abnormality detection[J].Neuroimage,2010,52(2):415-428.DO I:10.1016/j.neuroimage.2010.04.238.
[6]左克扬,罗学毛,龙晚生,等.FA值在监测评价HIE患儿脑髓鞘发育中的作用[J].实用临床医药杂志,2006,3(7):22-23.DO I:10.3969/j.issn.1672-2353.2006.07.022.
[7]GIRARD N,RAYBAUD C,DU L P.MRIstudy of brain myelina-tion[J].Journal of Neuroradiology Journal De Neuroradiologie,1991,18(4):291-307.
[8]KWEE IL,NAKADA T.Phospholipid profile of the human brain:31 PNMR spectroscopic study[J].Magnetic Resonance in Medicine Official Journal of the Society of Magnetic Resonance in Medicine,1988,6(3):296-299.
[9]DOBBING J,SANDSJ.Quantitative grow th and development of human brain[J].Archives of Disease in Childhood,1973,48:757-767.
[10]O’BR IEN JS,SAMPSON EL,Lipid composition of the normal human brain:gray matter,white matter,and myelin[J].Journal of Lipid Research,1965,6(4):537-544
[11]SVENNERHOLmL.Distribution and fatty acid composition of phosphoglycerides in normal human brain[J].Journal of Lipid Research,1968,9:570-578.
[12]GALLIER S,GRAGSON D,JIMÉNEZFLORES R,et al.Using confocal laser scanning microscopy to probe the milk fat globule membrane and associated proteins[J].Journal of Agricultural&Food Chemistry,2010,58(7):4250-4257.DO I:10.1021/jf9032409.
[13]林洪,江洁等.贻贝磷脂与大豆磷脂卵黄磷脂组成的比较研究[J].营养学报,2002,24(1):87-89.DO I:10.3321/j.issn:0512-7955.2002.01.022.
[14]GARCIA C,LUTZ N W,CONFORT-GOUNY S,et al.Phospholipid fingerprints of milk from different mammalians determined by 31P NMR:Towards specific interest in human health[J].Food Chemistry,2012,135(3):1777–1783.DOI:10.1016/j.food chem.2012.05.111.
[15]张波.乳脂球膜与婴幼儿脑发育及健康的研究进展[J].中国儿童保健杂志,2016,24(1):43-47.DO I:10.11852/zgetbjzz2016-24-01-13.
[16]FAVÉG,COSTE T C,ARMAND M.Physicochemical properties of lipids:new strategies to manage fatty acid bioavailability[J].Cellular&Molecular Biology,2004,50(7):815-831.
[17]YIH-FUS In:Leonard RJ(ed)Physiology of the gastrointestinal tract[M].Raven Press,New York,1987:p1527.
[18]LAGARDEM,BERNOUD N,BROSSARD N,et al.Lysophosphatidylcholine asa preferred carrier form of docosahexaenoic acid to the brain[J].Journal of Molecular Neuroscience,2001,16:201-204.DOI:10.1385/JMN:16:2-3:201.
[19]BIRCH E E,HOFFMAN D R,UAUY R,et al.Visual Acuity and the Essentiality of Docosahexaenoic Acid and Arachidonic Acid in the Diet of Terminfants[J].Pediatric Research,1998,44(2):201-209.DOI:10.1203/00006450-199808000-00011
[20]BIRCH E E,SHARON GARFIELD M S,Hoffman D R,et al.A random ized controlled trial of early dietary supply of long-chain polyunsaturated fatty acidsandmentaldevelopment in terminfants[J].DevelopmentalM edicine&Child Neurology,2000,42(3):174–181.
[21]FARQUHARSON J,JAM IESON E C,Abbasi K A,et al.Effect of diet on the fatty acid composition of themajor phospholipids of infant cerebral cortex.[J].Archives of Disease in Childhood,1995,72(3):198-203.DOI:10.1136/adc.72.3.198.
[22]MITCHELLD C,GAWRISCH K,Litman B J,et al.Why is docosahexaenoic acid essential for nervous system function[J].Biochemical Society Transactions,1998,26(3):365-370.
[23]CARNIELLIV P,VERLATO G,PEDERZINIF,et al.Intestinal absorption of long-chain polyunsaturated fatty acids in preterminfants fed breast milk or formula.[J].American Journal of Clinical Nutrition,1998,67(1):97-103.
[24]TH IES F,PILLON C,MOLIERE P,et al.Preferential incorporation of sn-2 lysoPC DHA over unesterified DHA in the young rat brain.[J].American Journal of Physiology,1994,267(5Pt2):1273-1279.
[25]THIESF,DELACHAMBREMC,BENTEJAC M,et al.Unsaturated fatty acids esterified in 2-acyl-1-lysophosphatidylcholine[J].Journal of Neurochem is try,1992,59(3):1110-1115.
[26]胡小中.磷脂酰胆碱的生理功能和作用机理[J].粮油食品科技,2011,19(4):42-44.DO I:10.3969/j.issn.1007-7561.2011.04.016.
[27]LIU H,RADLOWSKIE C,CONRAD M S,et al.Early supplementation of phospholipids and gangliosides affects brain and cognitive development in neonatal piglets.[J].Journal of Nutrition,2014,144(12):1903-1909.DO I:10.3945/jn.114.199828.
[28]TANAKA K,HOSOZAWA M,KUDO N,et al.The pilot study:Sphingomyelin-fortified milk hasa positive association with the neurobehavioural development of very low birth weight infants during infancy,randomized control trial[J].Brain and Development.2013,35(1):45–52.DO I:10.1016/j.braindev.2012.03.004.
[29]TIMBY N,DOMELLÖF E,HERNELL O,et al.Neurodevelopment,nutrition,and grow th until 12 mo of age in infants fed a low-energy,low-protein formula supplemented with bovine milk fat globule membranes:a randomized controlled trial.[J].American Journal of Clinical Nutrition,2014,99(4):860-868.DO I:10.3945/ajcn.113.064295.
