基于柱前衍生化高效液相色谱法评价骨骼肌细胞胰岛素抵抗模型
2018-03-26,,,
,,,
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江大学 医学院附属第二医院,浙江 杭州 310009)
随着人类现代生活水平的提高以及人口的老龄化,肥胖、糖尿病、高血压以及血脂紊乱已成为这个时代的标志性疾病,这些统称代谢综合征.据国际糖尿病联盟统计,2013年世界上共有3.5亿糖尿病患者,预计在2035年糖尿病患者将达到6亿[1],其中有90%~95%是2型糖尿病或由胰岛素抵抗引起的[2].糖尿病还能引起糖尿病肾病、糖尿病神经病变、糖尿病足、糖尿病眼部并发症和糖尿病心肌病等并发症[1,3-4].胰岛素作用的器官和组织主要有肌肉、肝脏和脂肪组织.骨骼肌在维持机体葡萄糖水平过程中发挥着重要的作用,负责胰岛素刺激下80%的葡萄糖处置[5],是胰岛素的重要靶器官,也是发生胰岛素抵抗的主要部位.因此,研究骨骼肌胰岛素抵抗的机制、建立药物筛选的模型对于阐明上述疾病的发病机制以及积极的预防和治疗具有重要的意义.
建立葡萄糖转运模型,主要在于检测细胞中的葡萄糖.葡萄糖检测方法有很多,常用方法有旋光法、生物传感器、分光光度法[6]、葡萄糖氧化酶-过氧化物酶法[7](GOD-POD)、氚标记葡萄糖(H-2-脱氧葡萄糖)检测法和14C标记葡糖糖等,用于标记葡萄糖的同位素还有11C,13C,14C,D,3H以及18O等[8].最近也有用葡萄糖类似物2-NBDG作用荧光探针来检测细胞对葡萄糖的摄取能力[9].高效液相色谱法也能通过示差折光检测器检测葡萄糖,但细胞培养液中干扰物质太多,误差较大.用1-苯基-3-甲基-5-吡唑啉酮(PMP)对葡萄糖进行柱前衍生[10-12],生成单一的、具有强紫外吸收的化合物,用液相色谱分析仪分离、检测衍生产物.目前,柱前衍生化高效液相色谱法已用于检测水溶性多糖中单糖组分、血清中葡萄糖浓度,但未发现用于检测细胞培养液中葡萄糖浓度[13].通过C2C12成肌细胞,建立基于柱前衍生化高效液相色谱法的骨骼肌细胞胰岛素转运模型,应用于药物筛选和作用机制的研究,为进一步体外筛选治疗胰岛素抵抗的药物提供合理有效的细胞模型.
1 仪器与材料
HITACHI高效液相色谱,HITACHI L-2455二极管阵列紫外检测器,HITACHI L-2200自动进样器,METTLER TOLEDO FE20K pH计,METTLER TOLEDO AL104电子天平,PURELAB classic超纯水系统,Heraeus离心机,Nikon荧光显微镜及照相机;乙腈(TEDIA),葡萄糖(广东光华科技),PMP(阿拉丁),甲醇(杭州化学试剂),DMEM培养基(吉诺),胎牛血清(四季青),马血清(Gibco);C2C12细胞株(美国ATCC公司).
2 方法与结果
2.1 HPLC柱前衍生化检测葡萄糖质量浓度
2.1.1 对照品溶液的制备与衍生化
1) 对照品溶液制备.精确称取葡萄糖10 mg于1.5 mL EP管,用移液枪加入1 mL无糖无酚红DMEM,质量浓度为10 000 mg/L,配置成葡萄糖母液;将母液用无糖无酚红DMEM稀释成质量浓度为1 000,2 000,3 000,4 000,5 000 mg/L标准液.各取50 μL标准液加450 μL浓度为0.3 mol/L 的NaOH溶液稀释.
2) 对照品溶液的衍生化.各取50 μL标准液加450 μL浓度为0.3 mol/L的NaOH溶液稀释,并与500 μL浓度为0.3 mol/L的PMP甲醇溶液混合,振荡混匀,在70 ℃下水浴45 min;水浴结束后冷却至室温,加500 μL浓度为0.3 mol/L的HCl溶液,然后加入2 mL氯仿,涡旋1 min,3 000 g离心5 min,取上层清液于1.5 mL EP管,用0.45 μm微孔滤膜过滤.
2.1.2 色谱条件选择
Unisphere Aqua C18色谱柱(2.0 mm×150 mm,粒径3.5 μm);考察不同的溶液系统,最终选择流动相V(浓度为10 mmol/L乙酸铵,pH=5.30)∶V(乙腈溶液)=78∶22,流速1.0 mL/min.经光电二极管阵列紫外检测器检测,PMP、葡萄糖与PMP络合物的最大吸收波长为245 nm,进样量20 μL,柱温30 ℃.高效液相色谱分析无糖无酚红DMEM(空白溶剂)见图1(a)和含葡萄糖的培养基(实验组)图1(b).

1—PMP吸收峰;2—葡萄糖与PMP络合物吸收峰,简称葡萄糖吸收峰图1 PMP和PMP-葡萄糖络合物高效液相色谱图Fig.1 HPLC Chromatogram of PMP and PMP-Glucoseclathrate
2.1.3 线性范围
按上述方法配置标准品,经0.45 μm滤膜过滤进样,记录色谱图,以对照品溶液浓度与相应得组分峰面积计算回归方程和相关系数,计算得回归方程为
y=19 128x+99 339,r2=0.998 5
即葡萄糖溶液在质量浓度为100~500 mg/L范围内具有良好的线性.
2.1.4 精密度
取一份葡萄糖母液,按一定比例稀释,制备1份供试品,按上述条件衍生化,供试品进样8次,计算得到保留时间RSD值为0.46%,峰面积RSD值为0.55%,均小于2%,表示精密度良好.
2.1.5 重复性
取同一葡萄糖母液,同比例稀释,制备6份供试品溶液,按上述条件衍生化,计算得到保留时间RSD值为0.56%,峰面积RSD值为3.21%,均小于5%,表示重复性良好.
2.1.6 回收率
精密称取葡萄糖0.010 7 g,配制成标准品,并衍生化;分别精密称取葡萄糖0.015 7,0.034 3,0.043 1 g于1.5 mL EP管,加入1 mL无糖无酚红DMEM溶解,各取5 μL与45 μL无糖无酚红DMEM混合,衍生化步骤同标准品衍生化.每一份供试品进样3次求平均值,计算平均回收率,结果如表1所示.

表1 供试品回收率试验结果Table 1 The result of tested sample recovery
2.2基于柱前衍生高效液相色谱法建立骨骼肌细胞胰岛素抵抗模型
2.2.1 C2C12细胞增殖与分化
C2C12细胞在37 ℃,5% CO2饱和湿度条件下用含10% FBS的DMEM培养,待细胞贴壁约85%传代,将待分化的细胞种于96孔板,当细胞贴壁率达到80%,状态良好时给予含2% HS的DMEM诱导细胞分化,隔天换液,并拍照记录分化效果.C2C12成肌细胞呈梭型,用2% HS DMEM培养基诱导细胞分化细胞逐渐融合,至第6 d,形成排列规律、较为粗壮的肌管如图2所示.

图2 C2C12形态观察(100×)Fig.2 C2C12 cells morphologic observation(100×)
2.2.2 Hoechst染色
当C2C12细胞分化6 d后,进行Hoechst染色,吸弃培养液,用PBS液洗2次,吸尽液体;加入适量PBS,再加入Hoechst 33342染色液,轻轻晃动使其混匀,37 ℃避光染色约25 min,立即在荧光显微镜下观察.如图3所示,细胞核被染成蓝色,肌管细胞为多核细胞,沿细胞膜排列成线.

图3 已分化的C2C12细胞Hoechst染色(400×)Fig.3 Hoechst nuclei staining of differentiated C2C12 cells(400×)
2.2.3 地塞米松诱导细胞胰岛素抵抗
分化诱导第6 d后,弃培养基,加入等量无糖无酚红DMEM饥饿处理2 h,空白组和对照组,用高糖无酚红DMEM孵育24 h,模型组用等量10-6mol/L地塞米松孵育24 h;最后30 min加入10-6mol/L胰岛素或等量生理盐水,孵育30 min.空白组不加地塞米松和胰岛素,对照组只加入10-6mol/L胰岛素,模型组只加入10-6mol/L地塞米松.
2.2.4 高效液相色谱法考察骨骼肌细胞对葡萄糖的摄取
供试品配制:分别取2.2.3中的细胞培养液和高糖无酚红DMEM 50 μL,衍生化,进样,用高糖无酚红DMEM组对应葡萄糖吸收峰面积减去其余各组葡萄糖吸收峰面积,即各组细胞的葡萄糖摄取量,结果如图4所示(***为P<0.001,对照组与空白组比较;###为P<0.001,模型组与对照组比较).与空白组相比,在胰岛素刺激下,对照组细胞摄取葡萄糖的量显著增加;与对照组相比,地塞米松处理后的细胞在胰岛素刺激下葡萄糖摄取量显著减少,提示骨骼肌细胞发生了胰岛素抵抗.
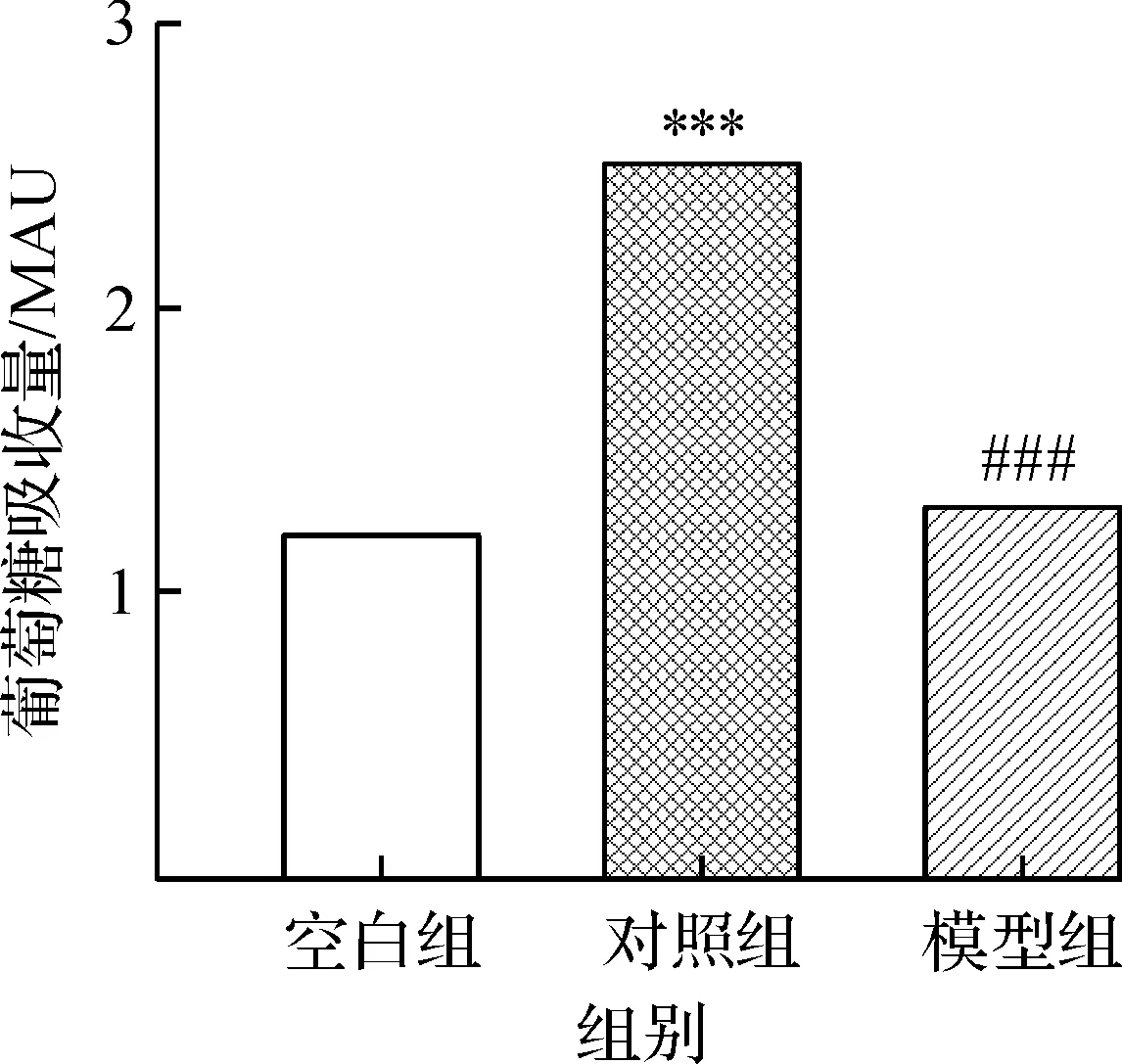
图4 C2C12细胞对葡萄糖的摄取量Fig.4 Glucose uptake of C2C12 cells
3 结 论
使用含2% HS的DMEM诱导分化C2C12细胞,在分化第6 d形成骨骼肌细胞,相比于胎牛血清,使用马血清分化的肌管更加粗壮.利用浓度为10-6mol/L胰岛素地塞米松孵育骨骼肌细胞24 h后,与对照组比较,骨骼肌细胞在胰岛素刺激下对葡萄糖的摄取显著减少,提示发生胰岛素抵抗.方法学的考察显示使用的检测葡萄糖的高效液相色谱法准确可靠、重现性好,在质量浓度为100~500 mg/L范围内具有良好的线性,适用于考察细胞对葡萄糖的摄取.胰岛素抵抗是指机体组织对正常胰岛素的敏感性降低,对葡萄糖的摄取和处理减少,是糖尿病等代谢综合征的共同特征,利用柱前衍生化高效液相色谱法检测培养基中的葡萄糖浓度,考察骨骼肌细胞对葡萄糖的摄取量,建立了胰岛素抵抗模型,从而为后续的药物筛选和胰岛素抵抗机制的探究打下基础.
[1] COUGHLAN K A, VALENTINE R J, RUDERMAN N B, et
al. AMPK activation: a therapeutic target for type 2 diabetes?[J]. Diabetes metabolic syndrome and obesity targets and therapy,2014,24(7):241-253.
[2] WHALEN K, MILLER S, ONGE E S. The role of sodium-glucose co-transporter 2 inhibitors in the treatment of type 2 diabetes[J]. Clinical therapeutics,2015,37(6):1150-1166.
[3] 林子桐,张超,沈雪梅.糖尿病肾病发病机制研究进展[J].中国药理学与毒理学杂志,2014,28(5):765-773.
[4] GAO H,FENG XJ, LI Z M, et al. Downregulation of adipose triglyceride lipase promotes cardiomyocyte hypertrophy by triggering the accumulation of ceramides[J]. Archives of biochemistry and biophysics,2015,565:76-88.
[5] MAZIBUKO S E, MULLER C J F, JOUBERT E, et al. Amelioration of palmitate-induced insulin resistance in C2C12 muscle cells by rooibos (Aspalathuslinearis)[J]. Phytomedicine,2013(10):813-819.
[6] 王亮,尚会建,王丽梅,等.葡萄糖检测方法研究进展[J].河北工业科技,2010,27(2):132-135.
[7] 李雪梅,王慧萱,唐建国,等.血清葡萄糖氧化酶法自主研发生化诊断试剂的临床研究[J].国际检验医学杂志,2011,32(2):297-298.
[8] 刘占峰,李良君,任征,等.同位素标记葡萄糖的研究进展[J].核技术,2013,36(1):53-59
[9] ZHANG W Y, LEE J J, KIM I S, et al. 7-O-methylaromadendrin stimulates glucose uptake and improves insulin resistanceinvitro[J]. Biological & pharmaceutical bulletin,2010,33(9):1494-1499.
[10] 凌云,王玉峰,王莹,等.虫草多糖中单糖组成的柱前衍生化HPLC分析[J].中国医药工业杂志,2008,39(12):924-929.
[11] 陈亭亭,黄金,陈蔚青,等.柱前衍生化RP-HPLC法测定L-叔亮氨酸含量[J].浙江工业大学学报,2016,44(4):431-434.
[12] 陈忠余,张天娇,张传宝,等.高效液相色谱法测定血清葡萄糖[J].临床检验技术研究,2011,29(9):660-662.
[13] 贾鹏禹,孙蕊,李良玉,等.柱前衍生化高效液相色谱检测木糖液中葡萄糖含量[J].黑龙江八一农垦大学学报,2012,24(3):41-44.
