亚微米BiFeO3绣球的制备及其光催化性能研究
2018-03-26,,,
, , ,
(浙江工业大学 特种装备制造与先进加工技术教育部重点实验室, 浙江 杭州 310014)
近年来,环境污染问题严重威胁到了人们的身体健康和生产生活环境,光催化技术的出现使得这一亟待解决的问题出现曙光.光催化技术是指受光激发的催化剂材料内部产生电子—空穴对再与外界产生氧化还原反应的技术.1972年Fujishima和Honda首次提出TiO2能够在紫外光的照射下将水分解为氢气和氧气[1],从而开拓了利用TiO2的光催化性质解决环境污染问题的新思路.然而,研究者发现TiO2的禁带宽度较宽(约为3.2 eV)[2],光响应范围仅在紫外光区域,而紫外光仅占太阳光能量的5%,很难高效利用太阳能.目前虽有一些研究者对TiO2进行掺杂改性并提高了光催化活性[3-5],但光响应范围仍旧在紫外光区.将光催化剂的吸收波长扩大至可见光范围能更大程度上利用太阳能.因此,探索新型半导体光催化剂材料尤为必要.
Grosso[6]在2004年首次提出铁电材料在光催化方面的应用潜力.作为铁电材料的铁酸铋(BiFeO3)因具有较窄的带隙备受关注.光催化剂形貌对于光催化活性的影响主要是因为光催化剂的粒径、表面状态和结晶度不同.经过十几年的发展研究,研究者已制备出多种形貌的BiFeO3晶体并研究其光催化性能,主要有药片状[7]、网状[8]、棒状[9]、纤维状[10]、球状[11]、立方状[12]、纺锤状[13]、不规则状[14]和管状[15]等.除上述形貌之外,目前尚未有其他催化活性良好的新颖形貌.笔者用水热法制备了新颖形貌的BiFeO3亚微米绣球,经过一系列表征分析,通过对亚甲基蓝(MB)染料的降解效果来评价其光催化活性,并拟合一级动力学曲线.
1 实验部分
1.1 试 剂
九水硝酸铁(Fe(NO3)3·9H2O),五水硝酸铋(Bi(NO3)3·5H2O),聚乙二醇(Polyethylene glycol,Mw为4 000),氢氧化钾(KOH),亚甲基蓝(MB)染料,以上均为分析纯,实验用水为去离子水.
1.2 仪 器
恒温磁力搅拌机(JBZ-14B,上海志威电气有限公司),精密电子天平(AUW220,上海方瑞仪器厂),高速离心机(H-1850,湖南湘仪实验仪器有限公司),鼓风干燥箱(DHG-9426A,上海精宏实验设备有限公司),石英反应器(上海庆开实验设备有限公司),水热反应釜(50 mL,上海庆开实验设备有限公司),电化学工作站(CHI660E,上海辰华仪器有限公司),X射线衍射分析(D8 discover型),扫描电子显微镜(S-4800型,Hitachi公司),紫外/可见吸收分光光度计(U3900型,日本Hitachi).
1.3 催化剂的制备
称量0.808 g的Bi(NO3)3·5H2O和0.97 g的Fe(NO3)3·9H2O,与0.8 g的Polyethylene glycol一并溶于40 mL的去离子水中,在恒温磁力搅拌机上中速搅拌直到晶体全部溶解;制备一定浓度的过量的KOH溶液(1 mol/L),滴加进含有Bi3+,Fe3+的混合溶液中,直至pH约为10,快速搅拌直至溶液均匀混合;将所制得的前驱体溶液放入50 mL的水热反应釜中,设置鼓风干燥箱温度180 ℃,时间72 h;水热结束后,将所得溶液离心清洗至中性,鼓风干燥箱中60 ℃干燥即可得到BiFeO3亚微米绣球.
1.4 光催化活性评价
光降解反应在石英反应器中进行,为排除温度影响,采用循环流动水通入反应器外壁中以保持恒温.采用500 W氙灯与紫外滤光片(波长大于400 nm)组装作为可见光源.取20 mL配制好的100 mg/L的MB溶液,加入50 mL去离子水和0.05 g催化剂,一并放入石英反应器中,暗光下搅拌40 min,使得催化剂材料达到吸附—解吸附平衡,取样.打开光源待稳定之后开始进行光降解.每隔20 min取一次样.取样结束后对所有样进行离心以分离催化剂,取上清液测吸收光谱,计算MB的降解率.
2 实验结果与讨论
2.1 XRD分析
图1为BiFeO3亚微米绣球的XRD图,可以看到结晶良好的纯相铁酸铋,对应于PDF卡片(JCPDS No. 86-1518)的所有特征峰.
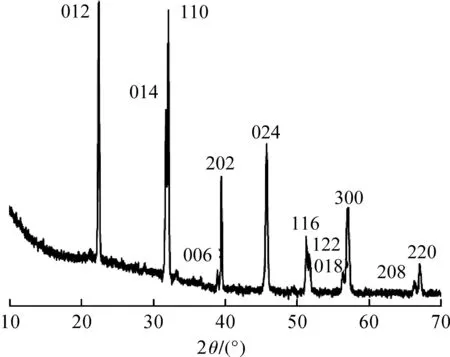
图1 BiFeO3亚微米绣球的XRD图谱Fig.1 XRD pattern of pure BiFeO3 sub micro hydrangea
2.2 SEM分析
图2是BiFeO3的微观形貌,其为表面不光滑的呈现分散花瓣状的绣球,直径约在500 nm左右.

图2 BiFeO3亚微米绣球SEMFig.2 SEM of BiFeO3 sub micro hydrangea
2.3 电流—时间曲线
图3为BiFeO3亚微米绣球的光电流(I—T)曲线图.利用三电极体系进行测量,通过调节光照开关来设计有无光照的条件,时间间隔为20 s.当加光照时,工作电极吸收光后产生电子-空穴对,电子通过ITO导电玻璃基底导出,空穴被电解液捕获,导出外电路,产生电流.在无光照时,光电流为零.循环多次,重复性良好,说明实验制备的BiFeO3亚微米绣球可由可见光激发产生参与催化反应的光生载流子且物理化学性质稳定.
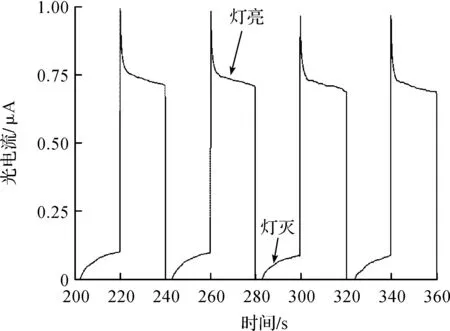
图3 电流—时间曲线图Fig.3 The diagram of currenttime curve
2.4 UV-vis吸收光谱
图4(a)为BiFeO3的UV-vis吸收光谱图,靠近紫外区(380 nm)有一个很强的吸收峰,是由带隙吸收引起.BiFeO3被认为是直接带隙半导体,因此可作出如图4(b)所示的(Ahv)2—Eg曲线,这里的A是吸收系数,Eg是禁带宽度.通过线性外推估算BiFeO3的禁带宽度值约为2.87 eV(432 nm),其光响应范围在可见光区域.因而BiFeO3亚微米绣球是一个很有潜力的可见光区域催化剂.
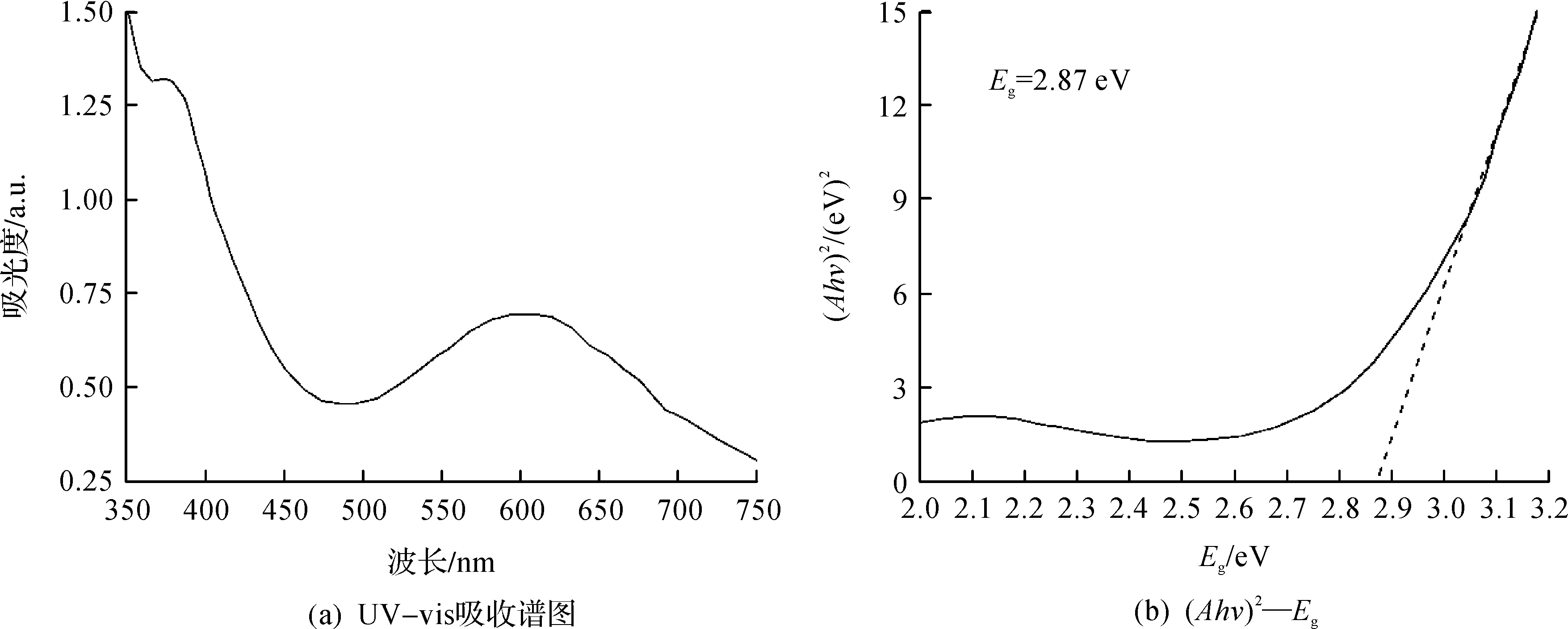
图4 BiFeO3亚微米绣球的UV-vis吸收谱图和对应的(Ahv)2—Eg曲线Fig.4 UV-visible absorption spectrum of BiFeO3 sub micro hydrangea and the corresponding (Ahv)2-Egcurve
2.5 光催化活性评价
为了研究BiFeO3亚微米绣球的光催化性能,用500 W氙灯与紫外滤光片(波长大于400 nm)组装作为可见光源,BiFeO3亚微米绣球作催化剂,对MB染料溶液进行降解.图5(a)为140 min的时间里,加入少量H2O2时BiFeO3亚微米绣球降解MB的吸收谱,可以看出MB染料逐渐降解.
光催化反应的过程是:用特定波长的光照射催化剂材料,使其内部产生光生载流子,然后光生的电子和空穴再与离子或分子反应生成活性自由基.这些活性自由基具有氧化性或还原性,可降解有机物,最终得到二氧化碳(CO2)、水(H2O)等其他小分子.
在可见光照射下,BiFeO3亚微米绣球内部产生光生载流子,电子(e-)从价带跃迁至导带,电子与空穴(h+)在向BiFeO3表面转移的过程中,一部分会发生复合,另一部分会发生分离,分离后的电子与BiFeO3表面吸附的水以及水中的游离氧反应生成羟基自由基(·OH),·OH再将MB氧化分解.空穴则跟吸附在BiFeO3上的有机污染物直接反应并将其氧化为CO2和H2O.具体反应过程[16]为
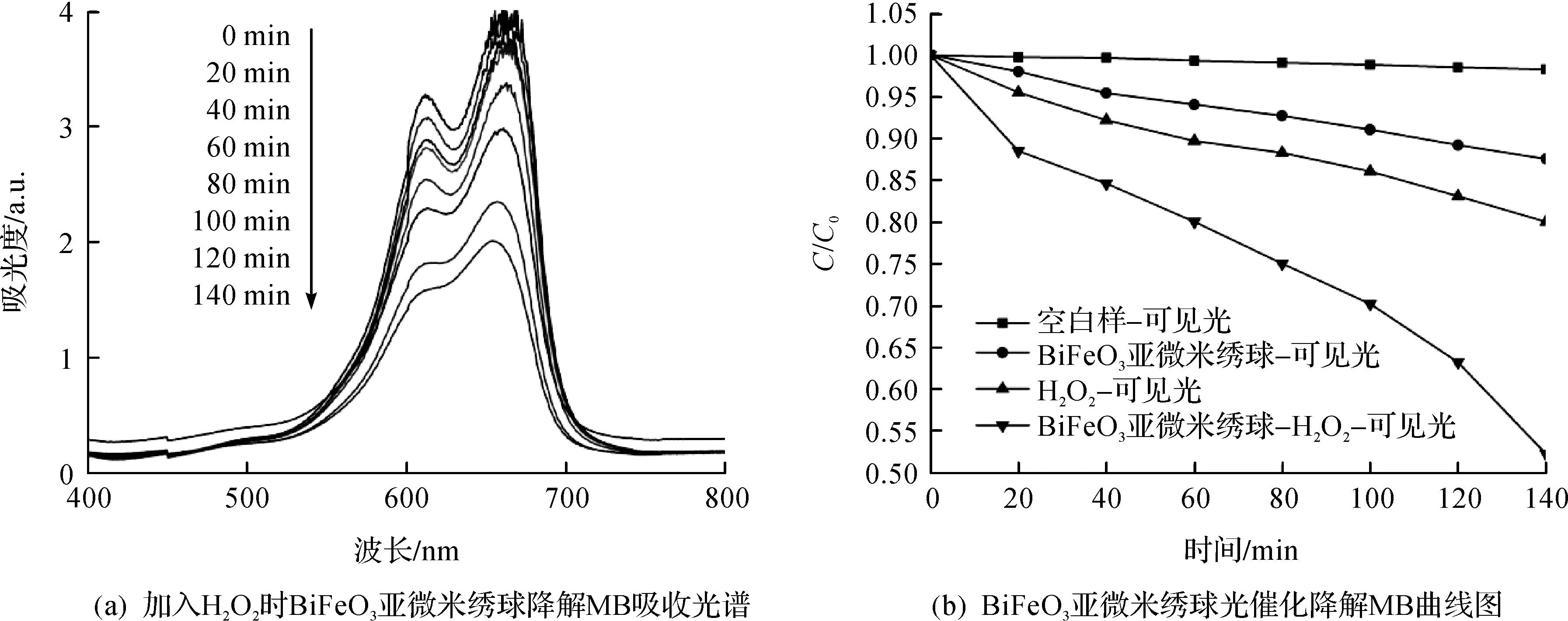
图5 BiFeO3亚微米绣球降解MB吸收光谱和光催化降解MB曲线图Fig.5 UV-vis spectrum and photocatalytic degradation curve of MB aqueous solution in the presence of BiFeO3sub micro hydrangea
(1)
此外,对MB的光催化降解过程进行一级动力学分析.光催化过程中的基本动力学方程[17]为
(2)
式中:r为反应速率;C为溶液浓度;k为Langmuir速率常数;K为吸附平衡常数.
当溶液浓度很小时,KC远小于1,式(2)可简写为
(3)
对式(3)积分可得到
(4)
式中K′为一级反应速率常数.可以看出:ln(C0/C)随时间t线性变化,表现为一级反应.
图6为ln(C0/C)—t图.可以看出:降解率的自然对数ln(C0/C)与反应时间t线性关系良好,也就是BiFeO3亚微米绣球对MB溶液的降解反应为一级动力学反应.在可见光照射下,BiFeO3亚微米绣球单独存在作催化剂时,反应常数为0.001 0 min-1;在加入H2O2时,反应常数为0.003 7 min-1.说明在可见光照射下,H2O2的加入与BiFeO3亚微米绣球构成类芬顿试剂可提高光催化活性.
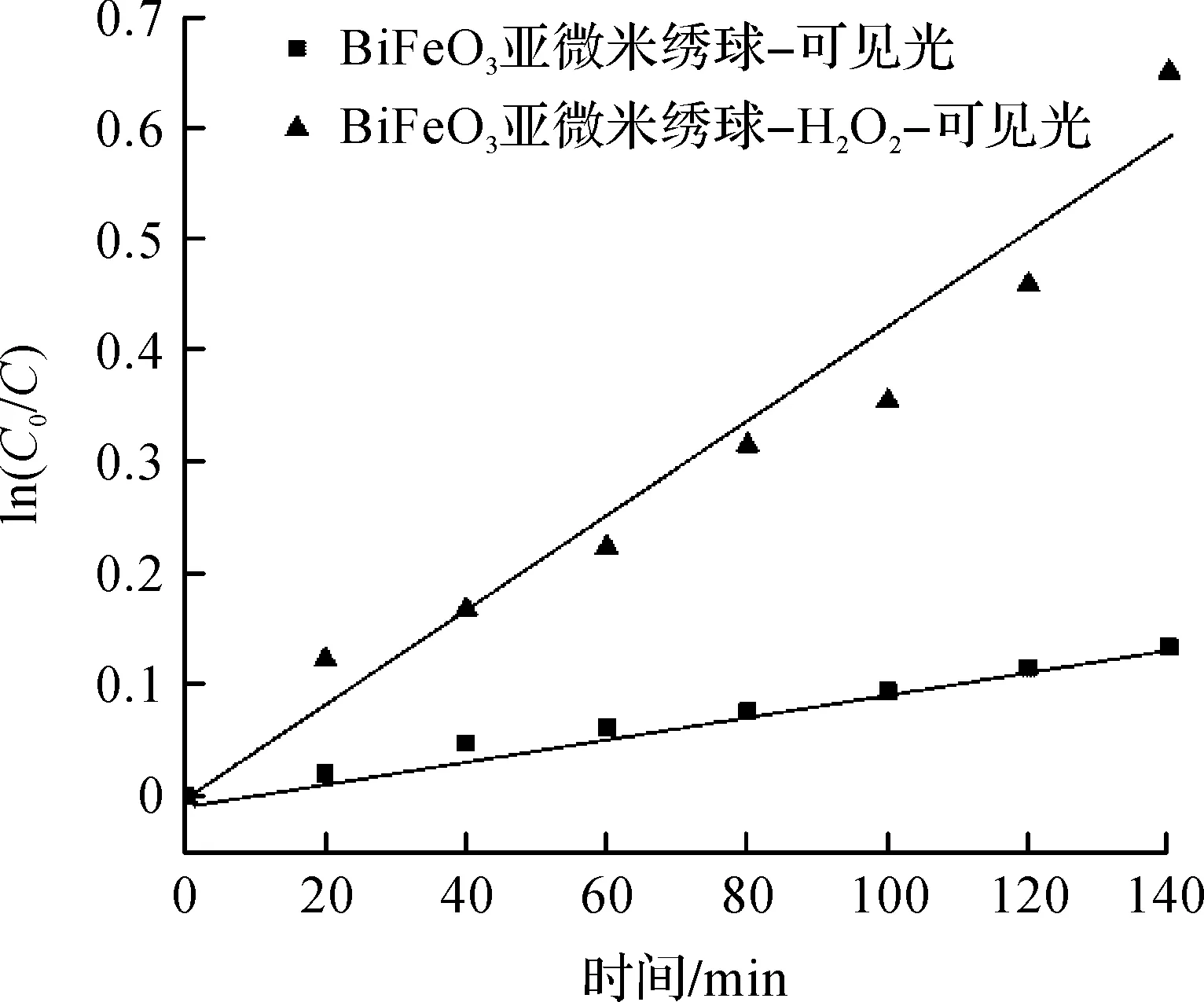
图6 BiFeO3亚微米绣球降解MB一级动力学反应拟合曲线Fig.6 The first order kinetic reaction fitting curve of MB with the presence of BiFeO3sub micro hydrangea
3 结 论
用水热合成法成功制备出新颖形貌的BiFeO3亚微米绣球,通过XRD表征得到其为结晶良好的纯相铁酸铋(R3c).通过光电流测试得到其可受可见光激发产生光生载流子,参与催化反应.利用紫外可见吸收光谱计算出其禁带宽度为2.87 eV(432 nm),证明其光响应范围在可见光区域.通过对亚甲基蓝MB的降解评价其催化活性,结果表明:在140 min的时间里,单一BiFeO3亚微米绣球作催化剂降解率为13%,催化效果较好;当加入H2O2,降解率为48%,可大大提高BiFeO3亚微米绣球的催化活性.
[1] FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37-38.
[2] GAO Y M, LEE W, TREHAN R, et al. Improvement of photocatalytic activity of titanium(IV) oxide by dispersion of Au on TiO2[J]. Materials research bulletin, 1991, 26(12):
1247-1254.
[3] 黄赵洁,张宏华,邸文瑞,等.铁氮共掺纳米TiO2粉末催化剂的制备及其光催化性能研究[J].浙江工业大学学报,2014,42(2):167-171.
[4] 何志桥,韩晶,宋爽.Ag修饰TiO2催化剂紫外光催化还原CO2的研究[J].浙江工业大学学报,2014,42(1):20-26.
[5] 陈金媛,高鹏飞.磁性纳米TiO2/Fe3O4复合材料的制备及光催化降解性能[J].浙江工业大学学报,2005,33(1):78-82.
[6] GROSSO D, BOISSIERE C, SMARSLY B, et al. Periodically ordered nanoscale islands and mesoporous films composed of nanocrystalline multimetallic oxides[J]. Nature materials, 2004, 3(11): 787-792.
[7] PENG J, HOJAMBERDIEV M, CAO B, et al. Surfactant-free hydrothermal synthesis of submicron BiFeO3powders[J]. Applied physics A, 2011, 103(2): 511-516.
[8] REITZ C, SUCHOMSKI C, WEIDMANN C, et al. Block copolymer-templated BiFeO3nanoarchitectures composed of phase-pure crystallites intermingled with a continuous mesoporosity: effective visible-light photocatalysts[J]. Nano research, 2011, 4(4): 414-424.
[9] FEI L, YUAN J, HU Y, et al. Visible light responsive perovskite BiFeO3pills and rods with dominant {111}c facets[J]. Crystal growth & design, 2011, 11(4): 1049-1053.
[10] LIU B, HU B B, DU Z L. Hydrothermal synthesis and magnetic properties of single-crystalline BiFeO3nanowires[J]. Chemical communications, 2011, 47(28): 8166-8168.
[11] WANG X, LIN Y, ZHANG Z C, et al. Photocatalytic activities of multiferroic bismuth ferrite nanoparticles prepared by glycol-based sol-gel process[J]. Journal of sol-gel science and technology, 2011, 60(1): 1-5.
[12] LIU Y, ZUO R. Tunable morphology and optical absorption of bismuth ferrite synthesized by sol-gel-hydrothermal method[J]. Journal of materials science: materials in electronics, 2012, 23(12): 2276-2281.
[13] HAN J T, HUANG Y H, WU X J, et al. Tunable synthesis of bismuth ferrites with various morphologies[J]. Advanced materials, 2010, 18(16): 2145-2148.
[14] SAKAR M, BALAKUMAR S, SARAVANAN P, et al. Annealing temperature mediated physical properties of bismuth ferrite (BiFeO3) nanostructures synthesized by a novel wet chemical method[J]. Materials research bulletin, 2013, 48(8): 2878-2885.
[15] SAKAR M, BALAKUMAR S, SARAVANAN P, et al. Electric field induced formation of one-dimensional bismuth ferrite (BiFeO3) nanostructures in electrospinning process[J]. Materials & design, 2016, 94: 487-495.
[16] IKEDA K, SAKAI H, BABA R, et al. Photocatalytic reactions involving radical chain reactions using microelectrodes[J]. The Journal of physical chemistry B, 1997, 101(14): 2617-2620.
[17] OLLIS D F. Contaminant degradation in water[J]. Environmental science & technology, 1985, 19(6): 480-484.
