依布硒啉通过Akt/eNOS通路对心肌缺血再灌注损伤的保护作用
2018-03-24翟昌林胡惠林唐关敏
翟昌林,钱 钢,胡惠林,唐关敏
(嘉兴市第一医院 心内科,浙江 嘉兴 314000)
心肌缺血后血流恢复对缺血区的供应称为缺血再灌注,但在再灌注过程中同样会造成心肌细胞的凋亡,这一过程称为I/R,即缺血再灌注损伤(I/R)[1]。缺血再灌注损伤通常发生在一些临床上对急性冠脉综合征的一些干预过程中,例如溶栓,支架介入或者心脏移植手术。相关研究显示AKT通路调节了哺乳动物细胞的大部分应答,在I/R过程中AKT通路的激活可抑制细胞的凋亡并激活存活路径[2]。依布硒啉是一种具有很好的过氧化物酶作用的有机硒化合物,研究报道依布硒啉可通过抗氧化作用,抑制氧自由基的生成积累,减少脂质过氧化作用来抑制心肌细胞凋亡[3]。然而在I/R过程中依布硒啉是否通过AKT/eNOS通路发挥再灌注缺血损伤保护作用及其具体机制仍未知,本文以此为出发点进行相关研究。
1 材料与方法
1.1 实验材料 鼠龄8周雄性SD大鼠30只,体质量240~260g,充足食水,在21±2℃的环境中饲养,由浙江大学实验动物中心提供;TUNEL检测试剂盒、NO检测试剂盒购自Roche,TNF-α、Caspase-3、磷酸化AKT/eNOS的兔多克隆抗体均购自Abcam,辣根过氧化物酶标记的羊抗兔IgG抗体均购自Roche,依布硒啉购自美国cayman生物公司。
1.2 大鼠心肌再灌注模型建立 参照Zeng XC等[4]文献中方法:3%的戊巴比妥钠以30mg/kg进行腹腔注射,麻醉后固定于手术台面,行气管切开,接呼吸机维持呼吸,右颈动脉插管进入左心室采集心功能相关参数,于胸骨左缘心尖搏动最强处行纵形切口,钝性分离皮下组织,剪开心包暴露心脏,以左冠状静脉为参照,于肺动脉圆锥右侧,镊子提拨起左心耳,左心耳下缘1.5mm处用线穿过,连同硅胶管一起结扎,结扎冠状动脉至无血流通过1h,松开冠状动脉结扎,再持续灌注2h,即完成心肌缺血再灌注损伤模型的建立。结扎后心电图II导联ST段呈弓背向上抬高大于0.1mv,QRS波变宽振幅扩大,心肌颜色变灰白为阻断成功标志,造模成功后即刻采集心功能各项参数后再通过颈动脉采血提取血液样本1mL,术后即刻颈椎脱臼法处死各组大鼠并摘除心脏,术中死亡大鼠不记入实验。
1.3 动物分组 30只SD大鼠随机分为3组,每组10只。假手术组:手术过程中穿线但不予结扎,术前1 min腹腔推注生理盐水2mL;缺血再灌注组:结扎1 h,再灌注2 h,术前10 min腹腔注射生理盐水2 mL;依布硒碄组:结扎1 min,再灌注2 h,术前10 min以5mg/kg的剂量腹腔推注依布硒啉。
1.4 心功能的测定 造模成功后即刻通过压力-体积导管(1.9 F;Scisense仪器,安大略,加拿大)记录并计算左室收缩末期压力(LVESP)、左室舒张末期压力(LVEDP),和每搏功(SW),收缩末期压力-容积关系(ESPVR)和舒张末期压力-容积关系(EDPVR)。
1.5 TUNEL监测心肌细胞凋亡情况 再灌注结束后,摘除各组大鼠心脏,石蜡包埋切片,将标本用二甲苯透明,乙醇脱水后PBS漂洗2次,Proteinase K工作液去除组织蛋白;各组组织分别加对应的50μL TUNEL检测液,待玻片干后,加50μL TUNEL反应混合液,37℃暗湿盒中孵育60 min,PBS漂洗3次;于荧光显微镜下计数凋亡细胞;待干后加50μL converter-POD,暗湿盒中37℃反应30min。PBS漂洗3次;在组织处加50~100μL DAB底物,反应15~25℃×10min;PBS漂洗3次;拍照后再用苏木素复染,几秒后立即用自来水冲洗。梯度酒精脱水、二甲苯透明、中性树胶封片。加一滴PBS或甘油在视野下,用光学显微镜进行计数(100~200个细胞)并拍照。
1.6 各组心肌Akt/eNOS磷酸化情况及TNF-α、Caspase-3蛋白表达 再灌注后摘除每组大鼠心脏,于冰上对心肌组织裂解取总蛋白,BCA法测定蛋白浓度,提取100 μg的心肌组织蛋白于12% SDS-PAGE凝胶上,电泳分离蛋白转移至聚偏氟乙烯膜,5%脱脂奶封闭后在膜中加入目标蛋白(Akt、p-Akt、NOS、eNOS、TNF-α、Caspase-3)相对应的稀释后的一抗,常温孵育2 h,TBST洗脱3次后加1∶5000稀释的HRP标记的二抗封闭,孵育60min,ECL化学显色发光。通过Quantity one图像分析软件对各组条带亮度值进行分析计算。
1.7 NO测定 再灌注后,立刻通过颈动脉采取各组每只大鼠血液样本1mL,4℃离心机中离心后取上清液,按照试剂盒方法检测各组样本中NO的含量。
1.8 统计学分析 采用SPSS 18.0统计学软件进行数据处理,计量资料进行正态性及方差齐性检验,多组均数比较采用F分析,两两比较采用Dunnett-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 心功能情况 与假手术组和依布硒啉组相比,心肌缺血再灌注组LVEDP升高,LVESP、SW、ESPVR和EDPVR均降低,差异均有统计学意义(P<0.05)。详见表1。

表1 各组大鼠心脏功能参数比较
LVESP:左室收缩末期压力,LVEDP:左室舒张末期压力,DP:上升的压力,SW:每搏功;ESPVR:收缩末期压力-容积关系,EDPVR:舒张末期压力-容积关系;
注:*与假手术组比较,P<0.05;#与缺血再灌注组比较,P<0.05。下同。
2.2 心肌细胞凋亡情况 通过TUNEL染色,正常大鼠心肌细胞的TUNEL染色呈蓝色,而坏死或凋亡的阳性心肌细胞细胞核染色呈棕色,见图1。利用图像分析软件对图1等各组图像进行分析并计算AI,结果显示:缺血再灌注组的心肌细胞凋亡指数为29.8%±6.8%,依布硒啉组的凋亡指数为19.8%±1.9%,两者相比差异有统计学意义(P<0.05)。


图1 TUNEL法检测各组心肌细胞凋亡图(400×)
2.3 各组心肌TNF-α、Caspase-3蛋白表达的情况 通过Quantity one检测软件对蛋白条带进行分析,根据图2条带,缺血再灌注组与假手术组相比,心肌组织caspase3和TNF-α的表达分别升高了4.6倍和4.9倍;依布硒啉组比缺血再灌注组则减少了caspase-3 和 TNF-α的表达,差异均有统计学意义(P<0.05)。

图2 western bolt检测各组心肌Caspase-3、TNFα的表达情况
2.4 Akt/eNOS信号通路磷酸化及NO表达的情况 与假手术组相比,缺血再灌注组大鼠心肌细胞AKT和eNOS的磷酸化水平及NO的水平均出现了下降,差异有统计学意义 (P<0.01);而依布硒啉组大鼠心肌组织Akt和eNOS的磷酸化水平、NO水平均回升,依布硒啉与假手术组相比,血NO的含量也显著上升,差异均有统计学意义(P<0.01),而p-Akt与p-eNOS的相对表达量比较则均无统计学意义(P>0.05)。
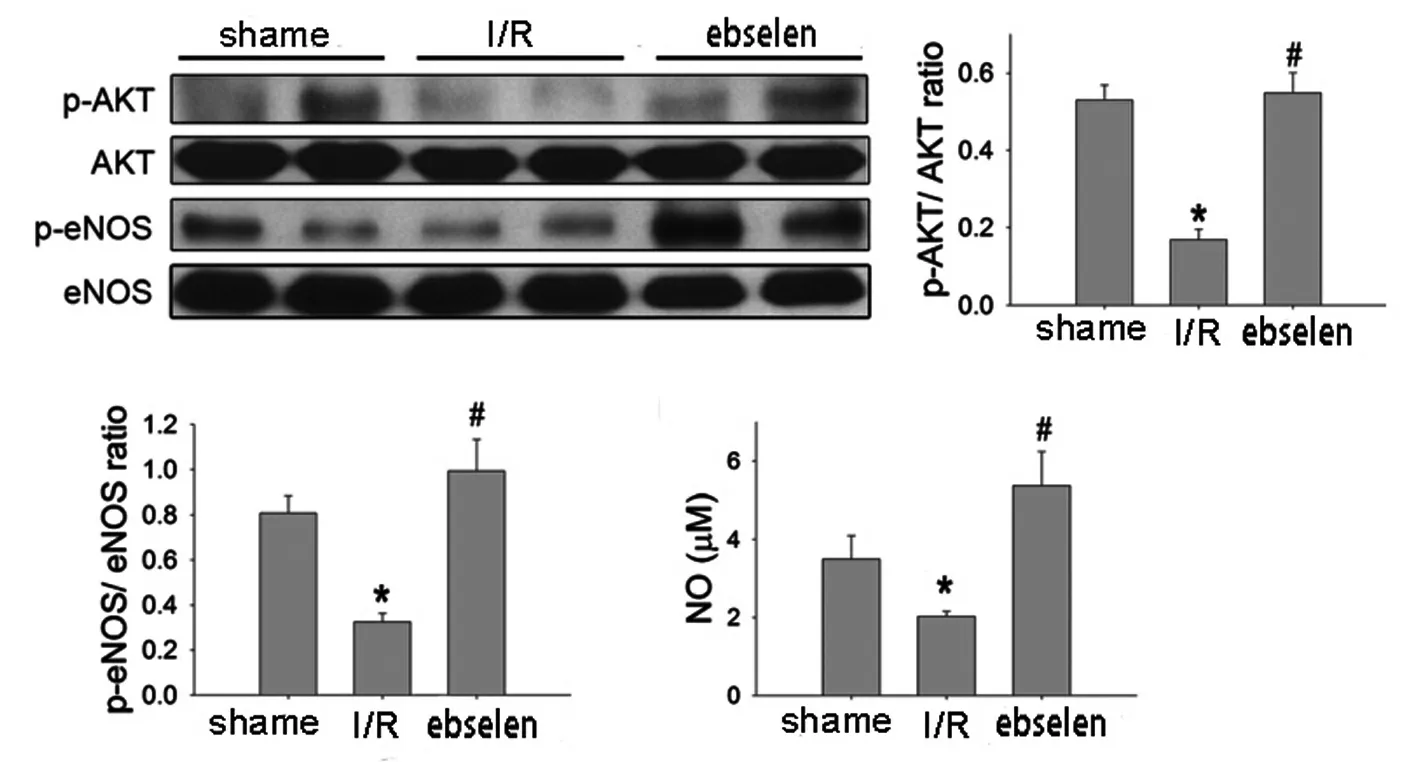
图3 western bolt检测各组心肌细胞Akt/eNOS通路磷酸化的情况
3 讨论
心肌I/R是目前临床上常见的并发症,不仅造成心肌细胞凋亡,破坏心肌组织正常结构,更会造成心功能的下降或者致死性的心律失常[5]。在I/R过程中心肌细胞的凋亡存在着两个主要的信号通路,一个是通过线粒体激活Caspase-3诱导细胞凋亡的内在途径,另一个是通过Fas配体或TNF-α的外在路径[6]。因此,如何通过药物靶向地阻断凋亡路径也为我们的科学研究提供了新思路。在我们的实验中,缺血再灌注组的TNF-α、Caspase-3表达显著增强,验证了心肌缺血再灌注损伤与凋亡路径的激活密不可分,依布硒啉在I/R过程中抑制了心肌凋亡相关途径中TNF-α 和 caspase-3蛋白的表达,这说明依布硒啉具有抑制凋亡路径的作用。
依布硒啉是一种脂溶性化合物,因此很容易透过细胞膜进入细胞,从而发挥显著的抗氧化作用。研究发现依布硒啉在多种器官的缺血再灌注过程中都发挥了保护作用。Chen Y等[7]研究发现依布硒啉通过减少氧化应激来减轻I/R损伤;Steinbrenner H等[8]报道在一例心脏外科手术中,依布硒啉抑制自由基的形成发挥抑制心肌细胞凋亡的作用;Lindenblatt N等[9]动物实验研究显示依布硒抑制血细胞聚集体的形成及保护血管内皮功能障碍从而发挥保护心肌I/R的作用。我们的研究发现依布硒啉可以减轻大鼠心肌细胞的缺血再灌注时心功能的损害;同时依布硒啉减轻了大鼠心肌细胞的再灌注凋亡。
Akt通路在心肌I/R中得作用一直是研究的热点,Yuan Q等[10]研究发现:通过PI3K/Akt抑制剂来抑制AKT的信号后心肌缺血再灌注的保护作用缺失了。AKT的磷酸化促进了许多靶蛋白的激活,其中包括eNOS。Fang R等[11]的研究表明:体内或体外应激时AKT磷酸化也介导了eNOS的快速应答。激活的eNOS在I/R过程中发挥了重要的保护作用[12]。我们的实验则以Akt/eNOS通路为出发点展开验证依布硒啉发挥I/R损伤的保护作用,结果表明:在I/R过程中依布硒啉导致了Akt的磷酸化也促进了其下游蛋白eNOS的磷酸化,eNOS表达的同时也促进了血液中血管内皮舒张因子NO浓度的提高,NO能调节血管内皮细胞的生长和凋亡以及迁移,是血管生成的必须因子[13],因而可以起到保护心肌细胞的作用。
综上所述,依布硒啉可以通过激活Akt/eNOS通路从而发挥保护心肌I/R作用,有关于依布硒啉通过各种信号通路相互作用从而发挥保护心肌I/R作用的机制有待进一步探索。
[1] Liu QQ, Liu H, He ZG,etal. Differential gene and lncRNA expression in the lower thoracic spinal cord following ischemia/reperfusion-induced acute kidney injury in rats[J].Oncotarget, 2017,8(32):53465-53481
[2] Wei K, Wan L, Liu J,etal.Downregulation of TRB3 protects neurons against apoptosis induced by global cerebral ischemia and reperfusion injury in rats[J].Neuroscience,2017, 360:118-127.
[3] 闵清,白育庭,张志,等. 依布硒啉对大鼠心肌缺血再灌注损伤的保护作用[J]中国医院药学杂志:电子版,2007,27(08):1039-1042.
[4] Zeng XC, Li L, Wen H,etal.MicroRNA-128 inhibition attenuates myocardial ischemia/reperfusion injury-induced cardiomyocyte apoptosis by the targeted activation of peroxisome proliferator-activated receptor gamm[J].Mol Med Rep,2016,14(01):129-136.
[5] 金云晔,翟昌林,沈震,等. 丹参酮IIA磺酸钠对大鼠缺血再灌注心肌细胞凋亡的影响[J]中华中医药学刊:电子版,2014,32(06):1414-1418.
[6] Yu Q, Li X, Cao X.Cardioprotective Effects of Phenylethanoid Glycoside-rich Extract from Cistanche deserticola in Ischemia-Reperfusion-Induced Myocardial Infarction in Rats[J].Ann Vasc Surg, 2016,34:234-242.
[7] Chen Y, Liu J, Li S,etal. Histidine-tryptophan-ketoglutarate solution with added ebselen augments myocardial protection in neonatal porcine hearts undergoing ischemia/reperfusion[J].Artif Organs,2015,39(02):126-133.
[8] Steinbrenner H,Bilgic E, Pinto A,etal.Selenium Pretreatment for Mitigation of Ischemia/Reperfusion Injury in Cardiovascular Surgery: Influence on Acute Organ Damage and Inflammatory Response[J].Inflammation,2016,39(04):1363-1376.
[9] Lindenblatt N, Schareck W, Belusa L,etal.Anti-oxidant ebselen delays microvas-cular thrombus formation in the rat cremaster muscle by inhibiting platelet P-selectin expression[J]. Thromb Haemost,2003,90(05):882-892.
[10] Yuan Q, Chen R, Zheng X,etal. Chinese herbal medicine Xinji pill protects the heart from ischemia/reperfusion injury through the Akt/Nrf2 pathway[J].Mol Med Rep,2017, 16(02):1551-1558.
[11] Fang R, Zhang LL, Zhang LZ,etal.Sphingosine 1-Phosphate Postconditioning Protects Against Myocardial Ischemia/reperfusion Injury in Rats via Mitochondrial Signaling and Akt-Gsk3 Phosphorylation[J].Arch Med Res,2017,48(02):147-155.
[12] Rong R, Xijun X.Erythropoietin pretreatment suppresses inflammation by activating the PI3K/Akt signaling pathway in myocardial ischemia-reperfusion injury[J].Exp Ther Med,2015,10(02):413-418.
[13] Zheng L, Ding J, Wang J,etal.Effects and Mechanism of Action of Inducible Nitric Oxide Synthase on Apoptosis in a Rat Model of Cerebral Ischemia-Reperfusion Injury[J].Anat Rec (Hoboken), 2016,299(02):246-255.
