低频强噪声急性暴露对巴马香猪耳蜗毛细胞损伤的观察
2018-03-23陈超吴玮王刚屈昌北韩浩伦李保卫
陈超 吴玮,,3 王刚 屈昌北 韩浩伦 李保卫
工业环境中存在的噪声常为 500 Hz 以下的低频噪声[1]。大量研究表明,内耳是噪声损伤的特征性靶点,连续过度的噪声刺激将导致耳蜗内、外毛细胞的损伤或缺失,造成暂时性听觉阈移和永久性听觉阈移[2]。低频噪声普遍存在于人类的生活环境中,且低频噪声具有衰减慢、声波长及较易穿越障碍物的特点,对人体的影响比高频噪声更长远[3]。目前对噪声的研究主要集中于高频噪声对啮齿类动物听功能的影响以及噪声损伤的发生机 制[4],关于低频强声对哺乳动物损伤的研究较少。本研究拟探讨不同频率和强度的低频强噪声暴露对巴马香猪毛细胞的损伤,以及低频强声长时(30 min)持续暴露时毛细胞的死亡方式,为深入研究低频噪声损伤耳蜗毛细胞的机制提供参考。
1 材料与方法
1.1实验动物及分组 外耳道清洁的健康巴马香猪13只,雌雄不限,体重10.2~18.3 kg,平均12.7±1.6 kg,分为对照组3只,50 Hz实验组5只和70 Hz实验组5只。
1.2噪声暴露和噪声强度检测 由动力源、低频信号发射器、功率放大器和声源发生器组成(第三军医大学实验动物中心提供)发声设备,在声场内发出频率为50~100 Hz、强度≥160 dB SPL的低频强声,将50 Hz实验组、70 Hz实验组巴马香猪分别置于50 Hz、167~170 dB SPL(由于声强设备的技术限制,50 Hz声强只能控制在167~170 dB之间,无法得出精确数值)和70 Hz、164 dB SPL强声声场内(各处声压级相同),持续暴露30 min。对照组不给予噪声暴露,其他饲养条件与实验组相同。
1.3听性脑干反应(ABR)测试 各组动物于实验前在隔声静电屏蔽室内进行双耳ABR检测,50 Hz、70 Hz实验组分别于噪声暴露后即刻行双耳ABR检测。测试方法:3%戊巴比妥(1 mg/kg)耳缘静脉麻醉动物后,颅顶正中接记录电极,测试耳接参考电极,鼻尖处接地极,单耳闭合声场给声,刺激声为短音,带通滤波为100~3 000 Hz,信号放大100 000倍,刺激重复率21.1次/秒,声刺激持续时间100 μs,间歇期10 ms,叠加1 024 次;刺激声强度从80 dB SPL开始,先以10 dB递减,接近反应阈时以5 dB递减至刚好出现波形,再重复一次,以能重复出现稳定的波Ⅴ判断为ABR反应阈值;如果125 dB SPL不能引出反应,则默认其阈值为130 dB SPL。测试时注意动物保温。
1.4畸变产物耳声发射(DPOAE)测试 对照组于实验前在隔声静电屏蔽室内进行双耳DPOAE检测,实验各组分别于实验前、噪声暴露后即刻行双耳DPOAE检测。初始音强度L1=70 dB SPL,L2=60 dB SPL,初始音频比f2/f1=1.2,测试当f2为1 000、2 000、3 000、4 000、5 000、6 000、8 000 Hz的2f1-f2的畸变产物耳声发射幅值,以大于本底噪声3 dB为DPOAE引出。
1.5耳蜗HE染色及免疫组化染色 完成ABR和 DPOAE测试后,动物断头处死,取出双耳耳蜗。针头挑出镫骨,刺破圆窗膜,PBS液冲洗后,部分耳蜗标本置于多聚甲醛溶液固定,10%乙二胺四乙酸二钠盐溶液脱钙60天,包埋耳蜗组织。
1.5.1HE染色 石蜡切片置于70 ℃烤箱内烘烤45分钟后,放入三缸二甲苯溶液中脱蜡各10分钟,之后依次放入梯度乙醇中水化各3分钟后流水冲洗;切片置于苏木素染色2~3分钟,盐酸乙醇分化;置伊红液30秒,盐酸乙醇分化;依次放入梯度乙醇、二甲苯石碳酸、二甲苯、二甲苯各2分钟;中性树脂胶封片。
1.5.2免疫组化染色
1.5.2.1Caspase-3免疫组化染色 石蜡切片脱水;PBS溶液冲洗;2%双氧水去除内源性过氧化氢酶10 min,PBS溶液冲洗;BSA封闭;加抗Caspase-3抗体(用PBS以1∶100配比),4 ℃过夜,PBS溶液冲洗;加入二抗(二抗试剂盒)1 h,PBS溶液冲洗;DAB显色,显色在光镜下控制,约2 min。检测Corti器、螺旋韧带、螺旋神经节局部Caspase-3的表达。以PBS溶液代替抗Caspase-3抗体作为阴性对照;阳性对照选择扁桃体组织切片,方法步骤相同。
1.5.2.2TUNEL法检测凋亡细胞 组织切片二甲苯洗2次,无水乙醇洗2次,用PBS洗后加入蛋白酶K溶液室温水解15 min,去除组织蛋白。用蒸馏水洗4次。加入含2%过氧化氢的PBS,室温反应5 min。PBS清洗后加2滴 TdT酶缓冲液,置室温1~5 min;滴加 54 μl TdT酶反应液,置湿盒中于37 ℃反应1 h。将切片置于染色缸中,加入已预热到37 ℃的洗涤与终止反应缓冲液,于37 ℃保温30 min,每10 min将载玻片轻轻提起和放下一次,使液体轻微搅动;PBS洗 3次,在切片上滴加两滴过氧化物酶标记的抗地高辛抗体,于湿盒中室温反应30 min;用PBS洗4次,每次5 min。在组织切片上直接滴加新鲜配制的0.05%DAB溶液,室温显色3~6 min;用蒸馏水洗4次,室温下用甲基绿进行复染10 min;用蒸馏水洗3次,再用100%正丁醇洗3次,用二甲苯脱水3次,封片。
1.6耳蜗基底膜铺片及荧光染色 经10%乙二胺四乙酸二钠盐溶液脱钙的耳蜗,分离耳蜗基底膜,PI染色观察毛细胞形态学变化。
2 结果
2.1各组巴马香猪噪声暴露前后ABR、DPOAE检测结果 实验前各组动物ABR阈值为20~50 dB SPL,50 Hz组平均33.5±9.4 dB SPL,70 Hz组平均为34.0±4.6 dB SPL;3 000 Hz以上DPOAE均可引出;噪声暴露后实验组ABR及DPOAE均未引出。
2.2各组耳蜗HE染色结果 对照组耳蜗HE染色切片未见明显异常, 50 Hz实验组Corti器细胞排列紊乱,螺旋韧带剥脱; 70 Hz实验组Corti器细胞排列紊乱,螺旋韧带剥脱,血管纹剥脱(图1)。
2.3各组耳蜗免疫组化染色结果 各组耳蜗TUNEL染色、Caspase-3染色均未见阳性表达(图2、3)。
2.4各组耳蜗毛细胞免疫荧光染色 对照组毛细胞排列整齐,低频强声暴露后各实验组耳蜗外毛细胞排列紊乱、不规则,部分外毛细胞缺失(图4),且70 Hz实验组外毛细胞缺失较50 Hz实验组严重。
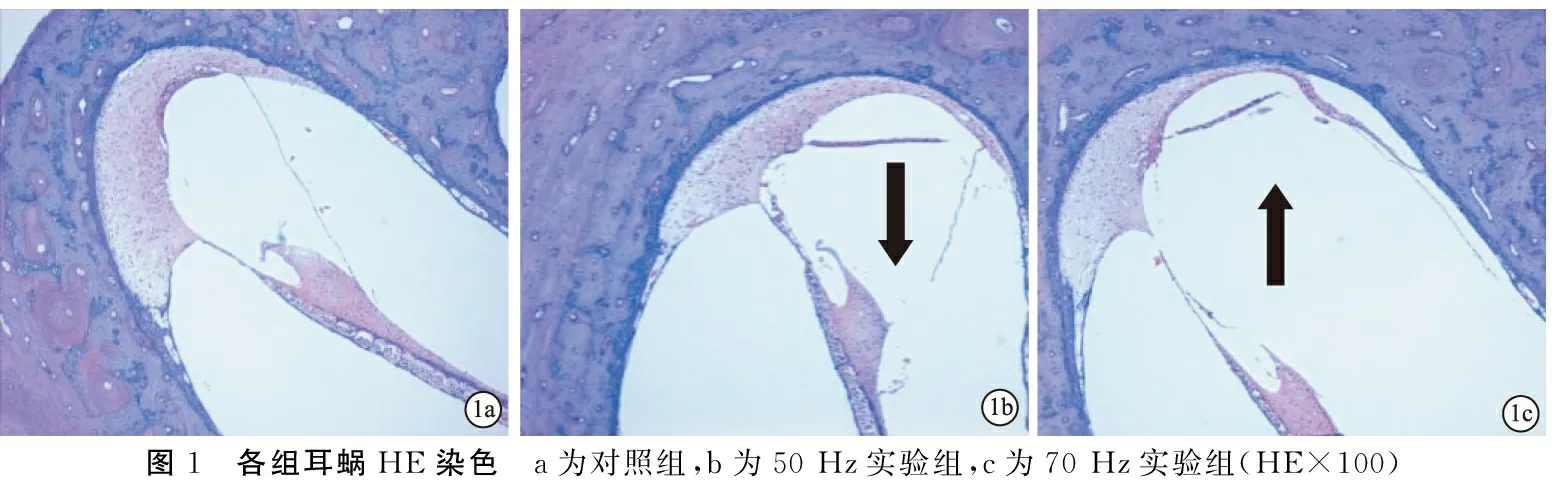
图1 各组耳蜗HE染色 a为对照组,b为50Hz实验组,c为70Hz实验组(HE×100)
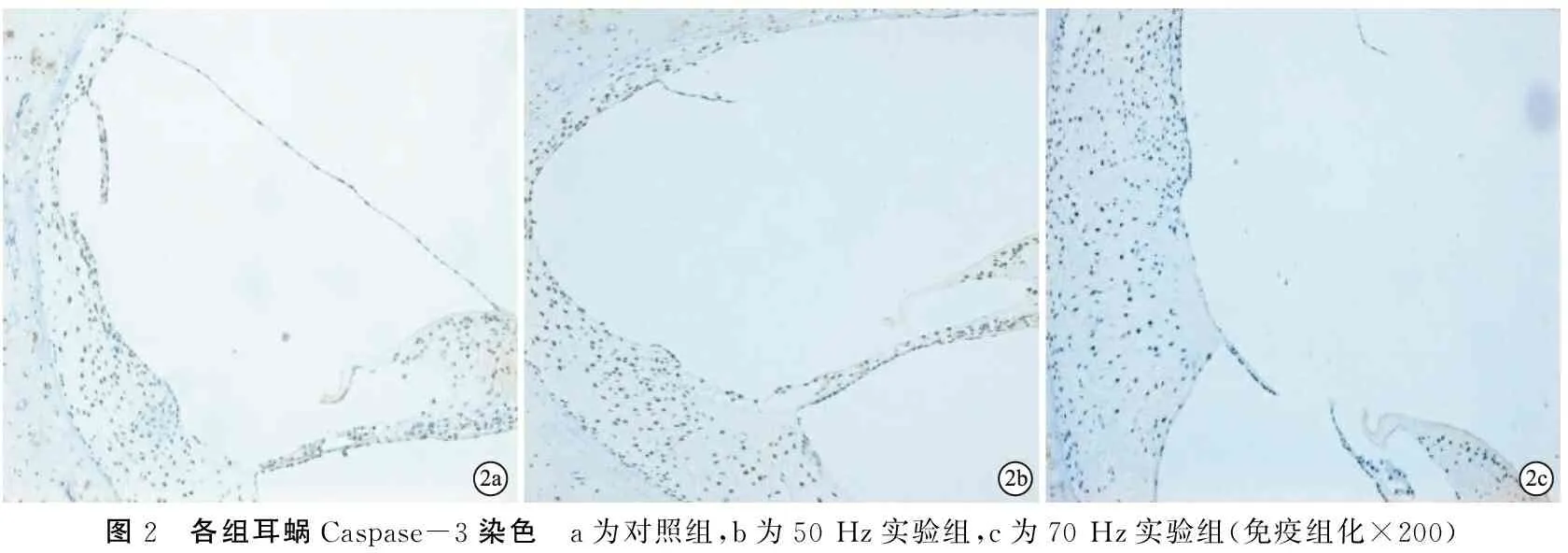
图2 各组耳蜗Caspase-3染色 a为对照组,b为50Hz实验组,c为70Hz实验组(免疫组化×200)

图3 各组耳蜗TUNEL染色 a为对照组,b为50Hz实验组,c为70Hz实验组(免疫组化×200)
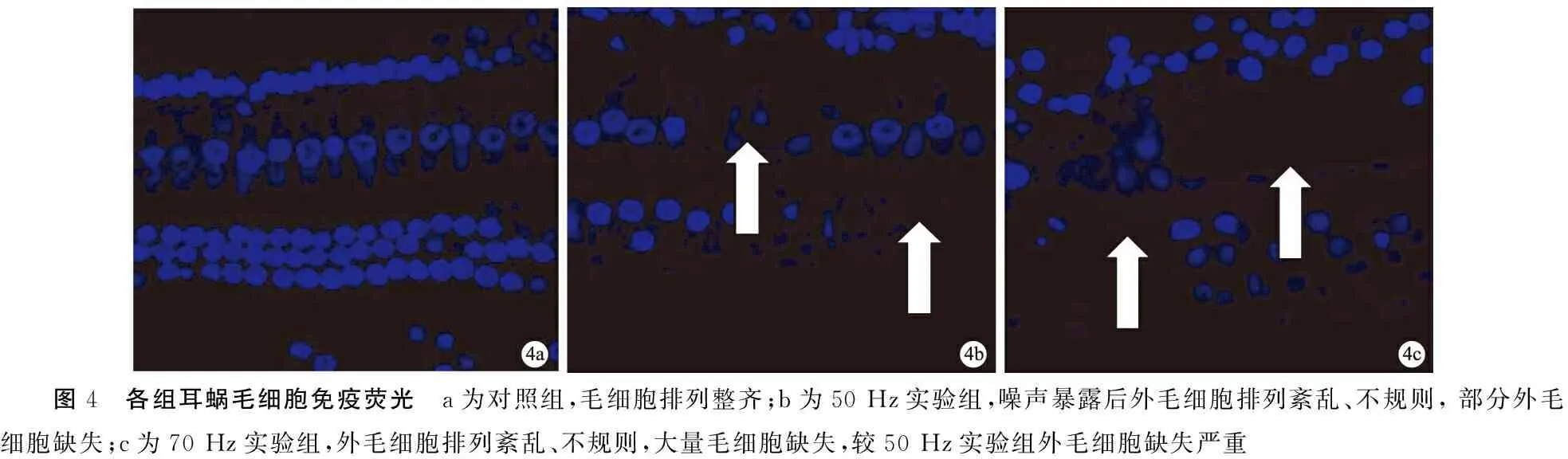
图4 各组耳蜗毛细胞免疫荧光 a为对照组,毛细胞排列整齐;b为50Hz实验组,噪声暴露后外毛细胞排列紊乱、不规则,部分外毛细胞缺失;c为70Hz实验组,外毛细胞排列紊乱、不规则,大量毛细胞缺失,较50Hz实验组外毛细胞缺失严重
3 讨论
有研究显示噪声对于听觉的损伤主要与声强、噪声的频谱性质、持续时间、噪声的类型和接触方式以及个体差异相关[5]。噪声的强度越高,耳聋的程度也越严重,因此强声导致的听损伤更为明显[6,7]。本研究旨在探讨不同频率和声强的低频强噪声暴露对巴马香猪听功能及耳蜗毛细胞影响,并观察低频强声长时间(30 min)持续暴露所致毛细胞的死亡方式。从文中结果看,低频强噪声对巴马香猪听觉产生了明显损伤,其听觉损伤程度较文献报道的150 dB SPL的噪声损伤更为严重[8]。 耳蜗HE染色显示50 Hz实验组Corti器细胞排列紊乱,螺旋韧带剥脱;70 Hz实验组Corti器细胞排列紊乱,螺旋韧带剥脱,血管纹剥脱;毛细胞免疫荧光染色结果显示50 Hz实验组噪声暴露后外毛细胞排列紊乱、不规则,部分外毛细胞缺失,70 Hz实验组外毛细胞排列紊乱、不规则,大量毛细胞缺失,较50 Hz实验组外毛细胞缺失严重。
关于噪声引起耳蜗损害的机制目前主要有三种理论:机械性损伤、代谢性损害和血管性改变,此三种损害机制往往同时存在,共同起作用[9]。一般认为,强度在85~130 dB SPL之间的噪声主要是通过干扰耳蜗内的新陈代谢引起细胞的代谢性损害,从而导致耳蜗毛细胞的一系列病理性改变;声强在110~134 dB SPL的噪声刺激还可引起耳蜗感觉上皮周围血管微循环的改变,进而导致细胞缺氧,引起细胞内某些酶类活性降低和细胞代谢产物的堆积,导致听功能损伤[10];当噪声强度超过130 dB SPL时,造成耳蜗毛细胞破坏的主要原因很可能是噪声的机械性损伤。曾有报道,高强度的噪声可直接导致动物死亡。本实验的最低噪声强度达164 dB SPL,引起听功能损伤的主要原因可能是噪声的机械力直接破坏,造成毛细胞死亡,且70 Hz较50 Hz噪声造成的机械性损伤更为严重;推测此时频率可能成为影响损伤程度的主要因素,随频率增加损伤程度愈加严重。本课题组后期实验将巴马香猪分别暴露于80 Hz(162 dB)、90 Hz(161.5 dB)、100 Hz(170 dB)、80 Hz(164 dB)、140 Hz(166 dB)、200 Hz(167.1 dB),除80 Hz(162 dB)于暴露后2小时死亡,余均在暴露过程中死亡。但关于70 Hz实验组较50 Hz实验组外毛细胞缺失严重的具体原因尚需进一步研究。
文中结果显示各实验组耳蜗Caspase-3、TUNEL染色均未见阳性表达,这与本课题组前期实验将巴马香猪暴露于50 Hz低频强声中5 min的结果不同,徐海燕等[10]曾将巴马香猪暴露于的50 Hz(142 dB)的低频强声中5 min,暴露后实验组动物双耳ABR均未引出,外毛细胞排列及层次均明显错乱、部分消失,这与本实验结果相符,但其实验组动物耳蜗均可见Caspase-3阳性表达,这与本实验结果不同,这可能与毛细胞死亡方式有关。目前主流观点认为噪声暴露后,耳蜗毛细胞的死亡存在凋亡、坏死两种截然不同的死亡方式,但以凋亡为主[11,12]。杨卫平等[13]曾对比研究PI染色、TUNEL染色法、Caspase-3免疫组化染色三种方法检测耳蜗毛细胞死亡模式,结果提示PI染色的耳蜗基底膜可见正常、凋亡、坏死和缺失四种毛细胞核形态,细胞核固缩、荧光染色增强的毛细胞为凋亡,胞核肿胀、荧光染色减弱和个别荧光染色增强的毛细胞为坏死,TUNEL、Caspase-3表达阳性的细胞为凋亡细胞。本实验Caspase-3免疫组化染色、TUNEL染色均未见各组动物耳蜗毛细胞阳性表达,DAPI染核可见多量毛细胞缺失,因此,推测低频强声长时间(30 min)持续暴露时毛细胞的死亡方式为坏死。有研究将成年灰鼠暴露于4 kHz窄带噪声中1 h,分别于噪声刺激后1、4、30天观察耳蜗毛细胞损伤情况,结果显示,毛细胞损伤数量随时间的延长而急剧增加,凋亡的外毛细胞数量明显多于坏死[14],因此认为外毛细胞凋亡为强噪声刺激后灰鼠耳蜗基底膜损伤早期细胞死亡的主要方式[14];灰鼠耳蜗基底膜的损伤主要是噪声刺激后,产生大量自由基,自由基损伤DNA 、蛋白质、膜磷质、细胞质分子、细胞表面受体, 导致耳蜗毛细胞凋亡[15,16]。
综上所述,本研究选择的低频强噪声急性暴露条件能够造成巴马香猪耳蜗外毛细胞不可逆性损伤,且70 Hz实验组较50 Hz实验组损伤严重;耳蜗Caspase-3免疫组化、TUNEL染色均未见阳性表达,表明低频强噪声持续暴露30 min造成的巴马香猪耳蜗外毛细胞主要的死亡方式为坏死。
1 俞鹏, 翟国庆, 黄逸凡,等. 城市居住区设备噪声频率特性分析[J]. 中国环境科学, 2006, 26:491.
2 刘素香. 中低频噪声对电力生产工人健康影响的调查研究[J]. 职业与健康, 2003, 19:3.
3 孟苏北. 城市住宅区低频噪声对人类健康的危害[J]. 中国医药导报, 2007, 4:17.
4 王刚, 吴玮, 屈昌民,等. 高强度低频稳态噪声对大鼠耳蜗形态和功能影响的研究[J]. 中华耳科学杂志, 2014,12:490.
5 徐海艳, 吴玮, 王刚,等. 低频强声对巴马香猪听功能及耳蜗毛细胞表面结构的影响[J]. 听力学及言语疾病杂志, 2016, 24:45.
6 何延军,刘亚光,李道德,等.脉冲与脉冲稳态复合型强噪声对豚鼠听觉器官的影响[J].航天医学与医学工程,2004,17:411.
7 廖华, 郜元坤, 华清泉,等. 脉冲噪声暴露后大鼠频率特异性听性脑干反应变化特点及意义[J]. 听力学及言语疾病杂志, 2011, 19:56.
8 王建军, 冯勃. 高强度低频噪声对豚鼠听力及耳蜗毛细胞的影响[J]. 中华耳科学杂志,2013,11:104.
9 薛来俊, 张大军, 闫玲,等. 职业噪声暴露对作业工人听力损失的影响及机制探讨[J]. 现代医药卫生, 2011, 27:3753.
10 徐海艳,吴玮,王刚,等.低频强噪声暴露后巴马香猪耳蜗Caspase-3表达及毛细胞死亡观察[J].听力学及言语疾病杂志,2016,24:256.
11 韩维举, 陈星睿. 噪声暴露引起耳蜗损伤机制的研究[J]. 中华耳科学杂志, 2013,11:357.
12 王进, 柯振武, 杨伟炎,等. 豚鼠爆震性聋耳蜗结构与功能的动态变化[J]. 西南军医, 2007, 9:3.
13 杨卫平, 胡博华. 三种检测耳蜗毛细胞死亡模式方法的比较[J]. 中华耳科学杂志, 2004, 2:301.
14 杨卫平, 胡博华, Henderson D. 不同强度噪声刺激后灰鼠耳蜗外毛细胞死亡方式观察[J]. 解放军医学杂志, 2005, 30:524.
15 Shoji F, Yamasoba T, Magal E, et al. Glial cell line-derived neurotrophic factor has a dose dependent influence on noise-induced hearing loss in the guinea pig cochlea[J]. Hearing Research, 2000, 142:41.
16 赵晓雨,刘淑红,赵彤,等.强噪声对豚鼠认知功能和血清某些生化指标的影响[J].中国应用生理杂志,2016,32:385.
