叔丁基双氧水诱导HEI-OC1细胞株凋亡与STATs mRNA表达的相关性分析*
2018-03-23曾梓豪罗璇姚裕恒王军义
曾梓豪 罗璇 姚裕恒 王军义
氧化应激损伤是多种感音神经性聋(噪声暴露、电离辐射、药物毒性等)的病理学基础[1],由于氧化应激产生高水平的活性氧(氧自由基,reactiveox-ygenspecies,ROS)对耳蜗毛细胞生物大分子有很强的损伤作用,不仅可导致DNA、蛋白质的直接损伤,还通过调节细胞的大量基因转录和相关信号转导通路的激活影响细胞的生物学过程,严重损伤可能导致细胞坏死或凋亡[2]。目前发现的与耳蜗毛细胞凋亡相关的信号通路包括线粒体途径、内质网途径、死亡受体途径[3],而酪氨酸激酶-信号转导及转录激活子(janus kinase-signal transducers and activators of transcription,JAK-STATs)信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等重要的生物学过程[4,5];与其它信号通路相比,这条信号通路的传递过程相对简单,主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶(Janus kinase,JAK)及信号转导子和转录激活子(signal transducers and activators of transcription,STAT)。JAK-STAT信号通路在以氧化应激损伤为基础的感音神经性聋的相关性研究中少有报道,本研究拟通过构建体外培养毛细胞凋亡模型,分析检测JAK-STAT信号通路中各STAT因子(STAT1、STAT2、STAT3、STAT4、STAT5、STAT6)的变化,以探讨JAK-STAT信号通路与毛细胞凋亡的相关性,为多种感音神经性聋的发生机制提供参考依据。
1 材料与方法
1.1毛细胞株 采用HEI-OC1细胞株(由House研究所提供),该细胞株系美国House研究所(House Ear Institute,HEI)从永生化小鼠耳蜗Corti器分离培育出来的一种能够体外培养传代的毛细胞株。
1.2仪器和试剂 6孔细胞培养板(上海锡诺仪器有限公司,中国),叔丁基过氧化氢(t-BHP)溶液(Sigma,美国)(0、20、40、60 μM),移液枪(Thremo,美国),枪头流式细胞仪(Thremo,美国),Annexin V-FITC/PI细胞凋亡检测试剂盒(凯基生物公司,中国),PBS缓冲液(HyClone,美国),氯仿(凯信化工试剂有限公司,中国),胎牛血清(HyClone,美国),胰酶Tryple Express Enzyme(Gibco,美国),DEPC(生工生物工程股份有限公司,中国),Fermentas 反转录试剂盒K1622(MBI Fermenta,美国),Fermentas K0223 qPCR试剂盒(MBI Fermenta,美国),引物设计合成(广州赛哲生物公司,中国),BPX-82型恒温培养箱(上海博讯实业公司,中国)。
1.3实验方法
1.3.1毛细胞凋亡模型的构建 t-BHP溶液稀释为0 μM(对照组)、20 μM(低浓度组)、40 μM(中浓度组)、60 μM(高浓度组)4种浓度,取正常生长的HEI-OC1细胞,于33°C、10%CO2培养箱中培养,24 h后加入以上4种浓度的t-BHP溶液,在33°C、10%CO2培养箱中培养,15小时后收集各孔内上清液。不含EDTA的胰酶消化贴壁细胞,相应上清重悬收集并在2 000 rpm条件下离心5 min;用PBS洗涤细胞3次,每次2 000 rpm离心5 min;500 μl Binding Buffer 重悬细胞,加入Annexin V-FITC 5 μl,加入PI 5 μl,混匀,室温避光染色15 min,1 h内用流式细胞仪检测细胞凋亡率。
1.3.2实时荧光定量PCR检测STATs mRNA表达 提取RNA,65 ℃反应5 min、冰上冷却3~5 min进行逆转录反应,逆转录反应严格按照Promega A5001试剂盒进行操作,样品于冰上冷却,于25 ℃加入5XReaction Buffer, Ribonuclease Inhibitor,Reverse Transcriptase,PCR Nucleotide Mix(dNTP 混合),MgCl2和Nuclease-Free Water反应5 min,42 ℃中孵育60 min,70 ℃反应10 min,灭活逆转录酶。加入2×qPCR Master Mix 10 μl,10 μM Forward primer 0.3 μl,10 μM Reverse primer 0.3 μl,逆转录产物稀释10倍cDNA template 0.8 μl,ddH2O 8.6 μl,混匀、离心。反应条件:95 ℃反应10 min,进行1次,然后95 ℃反应15 s,60 ℃反应20 s,70 ℃反应20 s,重复40次,最后95 ℃反应15 s,60 ℃反应1 min,95 ℃反应15 s,进行1次,完成解离。应用2-△△Ct法对STATs mRNA表达进行相对定量检测,以2-△△Ct表示染毒组STATs mRNA相对于正常对照组表达的变化倍数,每组细胞每个基因重复6次。引物设计合成见表1。

表1 各STATs mRNA引物序列
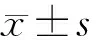
2 结果
2.1t-BHP诱导的HEI-OC1细胞株凋亡水平 各组HEI-OC1细胞凋亡水平见图1,与对照组(凋亡率3.9%)相比,20、40、60 μM染毒组的细胞凋亡率明显上升,分别为7.4%、32.0%、91.2%。
2.2各浓度t-BHP染毒组STATs mRNA表达水平 各组STATs mRNA表达水平见表2。与对照组相比,染毒后STAT1 mRNA的表达水平显著下降(F=5 534.302,P<0.01),各染毒组间差异无统计学意义(P>0.05);染毒后STAT2 mRNA的表达水平均有显著变化(F=1 259.148,P<0.01),低浓度组STAT2 mRNA的表达水平明显下降(P<0.01),但中、高浓度组均出现明显升高(P<0.01);染毒后各组STAT3 mRNA的表达水平均显著下降(F=146.038,P<0.01),但各染毒组间差异无统计学意义(P>0.05);STAT4在HEI-OC1细胞株中未见表达;染毒后各组STAT5 mRNA的表达水平均显著下降(F=685.929,P<0.01),各染毒组间比较差异无统计学意义(P>0.05);染毒后各组STAT6 mRNA的表达水平均显著下降(F=516.11,P<0.01),但各染毒组间差异无统计学意义(P>0.05)。

图1 不同浓度t-BHP组的HEI-OC1细胞凋亡程度比较
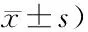
表2 各组STATs mRNA表达水平比较(2-ΔΔCtt值,
3 讨论
JAK-STAT信号通路与细胞的凋亡、增殖及分化密切相关,其传递的基本过程可概括为:多种细胞因子与其相应的膜受体结合促进JAKs磷酸化而被活化,活化的JAKs的JHl结构域催化STATs上相应部位的酪氨酸残基磷酸化,同时STATs 的SH2功能区与受体中磷酸化的酪氨酸残基作用而使 STATs活化,活化的STATs形成同源或异源二聚体进入核内,同其他一些转录因子相互作用调控相应的基因转录[6]。STATs是该通路的关键节点,目前已发现STAT家族存在7个成员:STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6[7],STATs蛋白广泛表达于机体不同类型的细胞和组织中,参与细胞生长、分化、凋亡等多种生理功能的调控,并与炎症、肿瘤和免疫反应关系密切[8],而这7个成员在不同的研究中所表现的生物学功能并无一致的观点,而本研究采用的小鼠源HEI-OC1细胞株STAT5只有一种形态,并无亚型区分。
目前相关的研究热点主要是STAT1、STAT3,有研究[9]发现IFN-γ抑制培养细胞生长的功能依赖于STAT1的转录激活活性,STAT1有抑制鳞状上皮细胞生长及促进凋亡作用,同时其他刺激,如:加热、缺血、DNA损伤都可以通过STAT1促发凋亡[10],但本研究结果显示凋亡HEI-OC1细胞STAT1表达水平明显下降,推测STAT1可能具有抑制HEI-OC1细胞凋亡的作用。目前研究STAT2主要是通过与STAT其它成员形成异源二聚体发挥生物学作用[11],如:STATl-STAT2二聚体在肿瘤细胞持续被激活,通过上调编码凋亡抑制基因和细胞调节因子,如:Bcl-x(L)、Mcl-1、cyclinsDl/2及C-Myc等,进而在肿瘤细胞血管生成、增殖、凋亡等多种生物学功能中发挥作用[12];但也有研究认为STAT2在IFN介导的细胞凋亡中发挥关键作用,在STAT2的SH2保守区域内,Y631突变为Y631F可影响Ⅰ型IFN凋亡效应的信号传导[13];有研究进一步发现STAT2是Ⅰ型IFN诱导细胞凋亡关键介质,STAT2表达缺失会明显降低IFN-α诱导的细胞凋亡能力[14];本研究发现严重凋亡的HEI-OC1细胞STAT2 mRNA表达水平相对于对照组明显升高,推断STAT2具有促进HEI-OC1细胞凋亡的生物学作用。STAT3主要通过细胞因子(如 IL-6)和生长因子(如VEGF)诱导的 JAK-STAT 信号途径以及MAPK途径激活,活化的STAT3形成同源或异源二聚体行使基因转录调控的功能[15],其主要生物学功能是参与细胞生长、分化、恶性转化及凋亡抑制,从而影响肿瘤细胞的增殖、侵袭、转移、血管形成,具有抗凋亡作用,而且STAT3过度激活可表现出致癌基因作用[16];本研究结果显示凋亡的HEI-OC1细胞STAT3 mRNA的表达水平出现显著下降,推断STAT3 mRNA具有抑制HEI-OC1细胞凋亡的生物学作用。目前研究[17]发现STAT4的表达和功能除受上游IL-12、IL-23等细胞因子调控外,也受自身单核苷酸多态性调控,其在B细胞、NK细胞、单核细胞、巨噬细胞和树突状细胞上的变异可能通过抑制凋亡、产生炎症性细胞因子、递呈自身抗原、产生自身抗体来影响自身免疫性疾病进程[18];在本研究中,HEI-OC1细胞中未见STAT4表达。STAT5可在许多细胞因子包括生长激素、血小板生成素、白血病抑制因子 (LIF)和白介素 2、3、5、6 等刺激下被激活[19],激活的STAT5通过调控一系列下游靶基因(细胞调节因子cyclin D1、cyclin D2、p21WAF/Cip1和p27kip,抗凋亡基因Bcl-xl、Bcl-2)的表达,对维持细胞正常功能、调节细胞增殖与分化起到重要作用[20],相关研究发现[21]抑制STAT5a和STAT5b可促进癌细胞凋亡,抑制癌细胞生长;本研究中,t-BHP染毒后各组HEI-OC1细胞中STAT5 mRNA的表达水平均显著下降,推断STAT5 mRNA具有抑制HEI-OC1细胞凋亡的生物学作用。已有相关研究[22]证实STAT6可调节多种肿瘤细胞凋亡相关基因的表达,与细胞凋亡关系密切,但其在细胞凋亡中的作用并无一致性观点,如:通过对STAT6活化状态时不同的人淋巴细胞研究发现,STAT6null表型的淋巴细胞的细胞凋亡率高,认为STAT6在细胞凋亡抑制中起重要作用[23],以上研究表明STAT6可能有抑制细胞凋亡的生物学作用,但对人结肠癌细胞株细胞的Caspase家族蛋白以及Bcl-2家族蛋白的mRNA表达差异性研究发现HT-29(STAT6high)中凋亡抑制基因Bcl-2、Bcl-xl的表达反而比在Caco-2(STAT6null)中低,说明还有其他基因在凋亡的调控中起重要作用[24];本研究中,染毒后各组STAT6 mRNA的表达水平均出现显著下降,推断STAT6 具有抑制HEI-OC1细胞凋亡的生物学作用。由于STATs均以同源或异源二聚体的形式发挥靶基因的调控作用,本研究仅以凋亡毛细胞各STAT mRNA的表达水平作凋亡效应的相关性分析具有一定的局限性,研究显示毛细胞不同凋亡水平与STATs mRNA表达水平的相关性不强,也可能由上述原因所致。
综上所述,本研究成功构建了氧化应急损伤的毛细胞凋亡模型,并且发现随着t-BHP染毒的浓度升高HEI-OC1细胞株凋亡水平升高,在此基础上发现各组STATs mRNA表达水平均出现了显著性变化,STAT2 mRNA在本次研究中的表达水平明显升高,而其它各STATs mRNA均出现表达水平下降,推测JAK-STAT2信号通路具有促进凋亡的生物学作用,JAK-STAT1/STAT3/STAT5/STAT6信号通路具有抑制凋亡的生物学作用;可见氧化应急损伤致毛细胞凋亡与JAK-STAT信号通路具有密切关系,该通路可能是氧化损伤致毛细胞凋亡的重要机制之一,而JAK-STAT信号通路中关键因子STATs表达水平的不同变化也反映了其在凋亡过程中不同的作用机制,但其作用的分子机制尚有待于进一步研究。
1 Gul F, Muderris T, Yalciner G, et al.A comprehensive study of oxidative stress in sudden hearing loss[J].Eur Arch Otorhinolaryngol, 2017, 274:1301.
2 Song EA.Docosahexaenoic acid induces oxidative DNA damage and apoptosis, and enhances the chemosensitivity of cancer cells[J].International Journal of Molecular Sciences, 2016, 17:E1257.
3 Motaghinejad M, Motevalian M, Babalouei F, et al.Possible involvement of CREB/BDNF signaling pathway in neuroprotective effects of topiramate against methylphenidate induced apoptosis, oxidative stress and inflammation in isolated hippocampus of rats: molecular, biochemical and histological evidences[J].Brain Res Bull, 2017,132:82.
5 Groner B.Jak Stat signaling and cancer: opportunities, benefits and side effects of targeted inhibition[J].Mol Cell Endocrinol, 2017,451:1.
6 Meier JA.Toward a new STATe: the role of STATs in mitochondrial function[J].Semin Immunol, 2014,26:20.
7 Zundler S.Integrating immunologic signaling networks: the JAK/STAT pathway in colitis and colitis-associated cancer[J].Vaccines, 2016, 4:E5.
8 Al Zaid Siddiquee K.STAT3 as a target for inducing apoptosis in solid and hematological tumors[J].Cell Research, 2008, 18:254.
9 Liszewski W, Naym DG, Biskup E.Psoralen with ultraviolet A-induced apoptosis of cutaneous lymphoma cell lines is augmented by type I interferons via the JAK1-STAT1 pathway[J].Photodermatol Photoimmunol Photomed, 2017,33:164.
10 Arzt L, Halbwedl I, Gogg-Kamerer M.Signal transducer and activator of transcription 1 (STAT1) knock-down induces apoptosis in malignant pleural mesothelioma[J].Pathology Oncology Research,2017,23:595.
11 Chowdhury FZ.STAT2: a shape-shifting anti-viral super STAT[J].JJAK-STAT, 2013,2:e23633.
12 Shodeinde A, Ginjupalli K, Lewis HD, et al.STAT3 inhibition induces apoptosis in cancer cells independent of STAT1 or STAT2[J].Journal of Molecular Biochemistry,2013,2:18.
13 Scarzello AJ, Romero-Weaver AL, Maher SG, et a1.A mutation in the SH2 domain of STAT2 prolongs tyrosine phosphorylation of STAT1 and promotes type I IFN-induced apoptosis[J].Mol Biol Cell, 2007, 18:2455.
14 Romero-Weaver AL, Wang HW, Steen HC, et al.Resistance to IFN-alpha-induced apoptosis is linked to a loss of STAT2[J].Molecular Cancer Research, 2010, 8:80.
15 Al Zaid Siddiquee K.STAT3 as a target for inducing apoptosis in solid and hematological tumors[J].Cell Research, 2008, 18:254.
16 Geiger JL, Grandis JR.The STAT3 pathway as a therapeutic target in head and neck cancer: barriers and innovations[J].Oral Oncol, 2016,56:84.
17 Maddur MS, Miossec P, Kaveri SV.Th17 cells: biology, pathogenesis of autoimmune and inflammatory diseases, and therapeutic strategies[J].The American Journal of Pathology,2012,181:8.
18 Varikuti S, Oghumu S, Natarajan G, et al.STAT4 is required for the generation of Th1 and Th2, but not Th17 immune responses during monophosphoryl lipid A adjuvant activity[J].International Immunology, 2016, 28:565.
19 Mütze J, Roth J, Gerstberger R.Nuclear translocation of the transcription factor STAT5 in the rat brain after systemic leptin administration[J].Neuroscience Letters, 2007, 417:286.
20 Buitenhuis M, Coffer PJ, Koenderman L.Signal transducer and activator of transcription 5 (STAT5)[J]. Int J Biochem Cell Biol, 2004, 36:2120.
21 Gu L, Dagvadorj A, Lutz J, et al.Transcription factor Stat3 stimulates metastatic behavior of human prostate cancer cells in vivo, whereas Stat5b has a preferential role in the promotion of prostate cancer cell viability and tumor growth[J].The American Journal of Pathology, 2010, 176:1959.
22 Goenka S.Transcriptional regulation by STAT6[J].Immunologic Research, 2011, 50:87.
23 Mottok A, Renn C, Willenbrock K, et al.Somatic hypermutation of SOCS1 in lymphocyte-predominant Hodgkin lymphoma is accompanied by high JAK2 expression and activation of STAT6[J].Blood, 2007, 110:3387.
24 秦琴, 龙洪清, 彭冰, 等.信号转导子与转录活化子6(STAT6)在人结肠癌细胞HT-29(SAT6high)、Caco2(STAT6null)细胞凋亡中的作用[J].南昌大学学报:医学版, 2011, 25:1.
