电针对2型糖尿病模型大鼠下丘脑IRS-1的影响
2018-03-22蔡少康李颖波杨丰樊永智董军立吴群蔡毅
蔡少康,李颖波,杨丰,樊永智,董军立,吴群,蔡毅
电针对2型糖尿病模型大鼠下丘脑IRS-1的影响
蔡少康1,李颖波1,杨丰2,樊永智1,董军立1,吴群1,蔡毅1
(1.武汉市中心医院,武汉 430000;2.湖北省云梦县人民医院,孝感 432000)
观察电针对2型糖尿病(T2DM)模型大鼠下丘脑中胰岛素受体底物蛋白质-1(IRS-1)的影响。将60只Wistar大鼠随机分为正常组15只和观察组45只。观察组采用高能饲料诱导造模,8星期造模成功后将观察组随机分为造模组、治疗组和阻滞组,每组15只。治疗组给予电针治疗;阻滞组给予电针配合脑室灌注磷脂酰肌醇-3羟基激酶(PI3K)阻滞剂治疗。治疗8星期后,采用血糖仪检测各组大鼠空腹血糖(FPG),采用ELISA法检测空腹血清胰岛素(Fins),计算胰岛素抵抗指数(IAI),并采用免疫组化SABC法检测大鼠IRS-1含量的表达。与正常组比较,造模组的FPG、Fins显著上升(均<0.01),IAI、IRS-1表达显著降低(<0.01)。与造模组比较,治疗组的FPG、Fins显著下降(均<0.01),IAI、IRS-1表达显著上升(<0.01)。与阻滞组比较,治疗组的FPG、Fins均显著下降(<0.05,<0.01),IAI、IRS-1表达显著上升(<0.01)。电针可通过调节下丘脑IRS-1的表达,改善T2DM大鼠的FPG、Fins及胰岛素敏感性。
针刺疗法;糖尿病,2型;胰岛素受体底物蛋白;血糖;血清胰岛素;胰岛素抵抗指数;大鼠;下丘脑
据统计,2010年我国糖尿病患者约9千万[1],而现在保守估计,患者数量应已逾1亿5千万之多。糖尿病给社会和家庭带来较大的经济负担和身心压力,糖尿病及其并发症的诊断、治疗、后期的维持费用更是逐年递增,病程超过10年的糖尿病患者与病程在5年之内的患者相比,医疗费用增加了近3倍[2]。因此,寻找一种有效安全而又经济实用的治疗方法迫在眉睫。
2型糖尿病(type 2 diabetes mellitus, T2DM)又称为非胰岛素依赖型糖尿病,是指患者本身具备一定胰岛分泌功能,而胰岛素作用效果反而降低,造成的葡萄糖利用吸收障碍、血清葡萄糖升高的一种现象[3],其基本病理基础就是存在胰岛素抵抗(insulin resistance, IR)。分子生物学认为IR的病理机制之一就在于磷酸酰肌醇3激酶/蛋白激酶B(PI3K/PKB,又名PI3K/Akt)通路的信号异常[4],而胰岛素受体底物1(insulin receptor substrate-1, IRS-1)正是此通路的重要启动因素[5-6]。胰岛素首先与细胞膜表面胰岛素受体(insulin receptor, InsR)的a亚基结合,之后可激活b亚基的酪氨酸蛋白激酶(protein tyrosine kinase, PTK),使InsR构象发生改变,然后InsR磷酸化IRS-1的酪氨酸残基,激活底物蛋白,从而激活PI3K/Akt通路,进而推动一系列因子活动[7-8]。
近年来,针灸在T2DM的治疗方面进行了大量的实验研究[9],本研究旨在探讨电针对T2DM模型大鼠之下丘脑胰岛素信号分子IRS-1的影响,为针灸防治T2DM相关疾病和针灸技术推广应用提供理论支持和实验依据,现报告如下。
1 材料与方法[10]
1.1 实验动物
60只SPF级雄性8周龄Wistar大鼠,平均体重为(200±20)g,由湖北省动物疫病预防控制中心提供[动物许可证号SCXK(鄂)2013-167]。
1.2 主要试剂及仪器
ELISA试剂盒(武汉谷歌生物工程有限公司,美国Sigma公司);山羊血清封闭液、免疫组化SABC相关试剂盒(北京中杉金桥公司);苏木精、3%过氧化氢去离子水、10%水合氯醛、4%多聚甲醛、二甲苯、0.5%Txiton X-100(北京博奥森公司)。
ZS-B/S颅脑立体定位仪(国营西北光学仪器厂);ST-360酶标仪设备(上海科华生物工程有限公司);CT2-BI-2000医学显微图像分析系统(成都泰盟);37XB倒置生物显微镜(上海长方光学仪器有限公司);IX71 OLYMPUS研究级电动倒置显微镜(上海长方光学仪器有限公司);TGL-20M台式高速冷冻离心机(长沙平凡仪器厂);HW-2250轮转式石蜡切片机(德国Leitz公司);YD-A生物组织摊片机(金华市益迪医疗设备厂)。
1.3 实验方法
1.3.1 造模及分组
将60只Wistar大鼠适应性喂养1周,然后随机分为正常组15只和观察组45只。观察组采用高能饲料(购自上海斯莱克实验动物有限责任公司)诱导造模,饲料成分为38.5%碳水化合物,15.0%蛋白质,46.5%脂肪,总热能为5.4 kcal/g[11]。8周后大鼠尾静脉采血检测空腹血糖(fasting plasma glucose, FPG)及空腹血清胰岛素(fasting insulin, Fins),据参考文献[12]计算胰岛素抵抗指数(insulin activation indices, IAI),即IAI=ln(1/FBG×Fins),凡IAI与正常组比较显著降低者(<0.05)为造模成功。然后将观察组随机分为造模组、治疗组和阻滞组,每组15只。
①正常组,标准饮食,不予造模及电针治疗;②造模组,高能饮食,不予电针治疗;③治疗组,造模后给予电针治疗;④阻滞组,造模后给予电针治疗,同时给予脑室内灌注PI-3K阻滞剂Wortmannnin。
1.3.2 电针治疗
取足三里、三阴交、关元、中脘穴。穴位定位参照华兴邦等[13]制定的《实验动物穴位图谱》。常规消毒后,采用0.30 mm×25 mm毫针直刺2~4 mm,然后接G6805-2A型电针治疗仪(同侧足三里和三阴交1对电极,关元和中脘1对电极),采用连续波,频率为1 Hz。留针10 min。每周治疗5次,共治疗8周。
1.3.3 脑室灌注
大鼠先用10%水合氯醛(30 mg/kg)腹腔麻醉后固定于脑立体定位仪,头顶备皮消毒后,皮肤切开1.5 cm以暴露囟门,于中位颅盖骨前囟后0.8 mm处钻孔2 mm,将不锈钢导管(长18.0 mm,外径0.64 mm,内径0.39 mm)插入钻孔并留置,再将带帽不锈钢制导丝(长17.0 mm,直径0.33 mm)插入导管并封闭,用牙科粘合剂固定上述装置。然后缝合皮肤,用碘酒消毒并肌肉注射青霉素;隔日取出管芯并用人工脑脊液清洗。
灌注方法具体操作为,先抽出管芯,将微量注射器、聚氯乙烯导管(内径0.3 mm)及不锈钢导管依次相连,再行Wortmannin注射[14-15](规格为50 nmol/L,剂量为3 mg/kg,药速为1mL/min)。注射完后留针8~10 min,再缓慢退针以防药物返流。
1.4 观察指标
1.4.1 FPG
实验第8周和第16周各组大鼠尾静脉取血,用强生稳步血糖仪及试纸测试。
1.4.2 Fins
实验第8周和第16周各组大鼠尾静脉采血,按ELISA试剂盒步骤操作,采用酶标仪的方法检测,使用不同梯度的标准品计算出不同样本的值。
1.4.3 IRS-1[16-17]
大鼠下丘脑灌注取材,固定,脱水透明,石蜡包埋并切片,贴片烤片,脱蜡水化;采用免疫组化SABC法,0.3% Txiton X-100处理20 min后PBS冲洗,3%甲醇-H2O2室温孵育10 min后PBS冲洗,微波辐射、柠檬酸盐缓冲液45 min、蒸馏水洗5 min×3次后PBS冲洗,滴加10%正常山羊血清、湿盒内37℃孵育约30 min,滴加一抗、二抗,滴加SABC适量后PBS冲洗,滴加DAB显色,苏木精复染,梯度乙醇脱水,封片拍照。每组切片随机挑选4个进行200倍拍照。应用Image-Pro Plus6.0软件分析照片的累积光密度值(IOD值),IOD值越大表示阳性表达越强,每组所有照片的平均IOD值代表该组的IOD值。
1.5 统计学方法
采用SPSS19.0软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用单因素方差分析,方差齐性时用检验进行两两比较,方差不齐时用秩和检验,组间比较用-检验。
2 结果
2.1 各组大鼠实验第16周FPG、FINS及IAI比较
实验第16周,与正常组比较,造模组FPG、Fins显著上升(均<0.01),IAI显著降低(<0.01);与造模组比较,治疗组FPG、Fins显著下降(均<0.01),且IAI显著升高(<0.01);阻滞组FPG、Fins、IAI与造模组比较,差异均无统计学意义(>0.05);与阻滞组比较,治疗组FPG、Fins均显著下降(<0.05,<0.01),且IAI显著上升(<0.01)。详见表1。

表1 各组大鼠实验第16周FPG、FINS及IAI比较(±s)
注:与正常组比较1)<0.01;与造模组比较2)<0.01;与阻滞组比较3)<0.01,4)<0.05
2.2 各鼠大鼠下丘脑IRS-1免疫组化切片结果比较
由图1可见,免疫组化图片染色为棕黄色胞浆染色,如箭头所指即为阳性细胞,其中正常组阳性表达最高,造模组和阻滞组皆表达较少,治疗组表达居中。
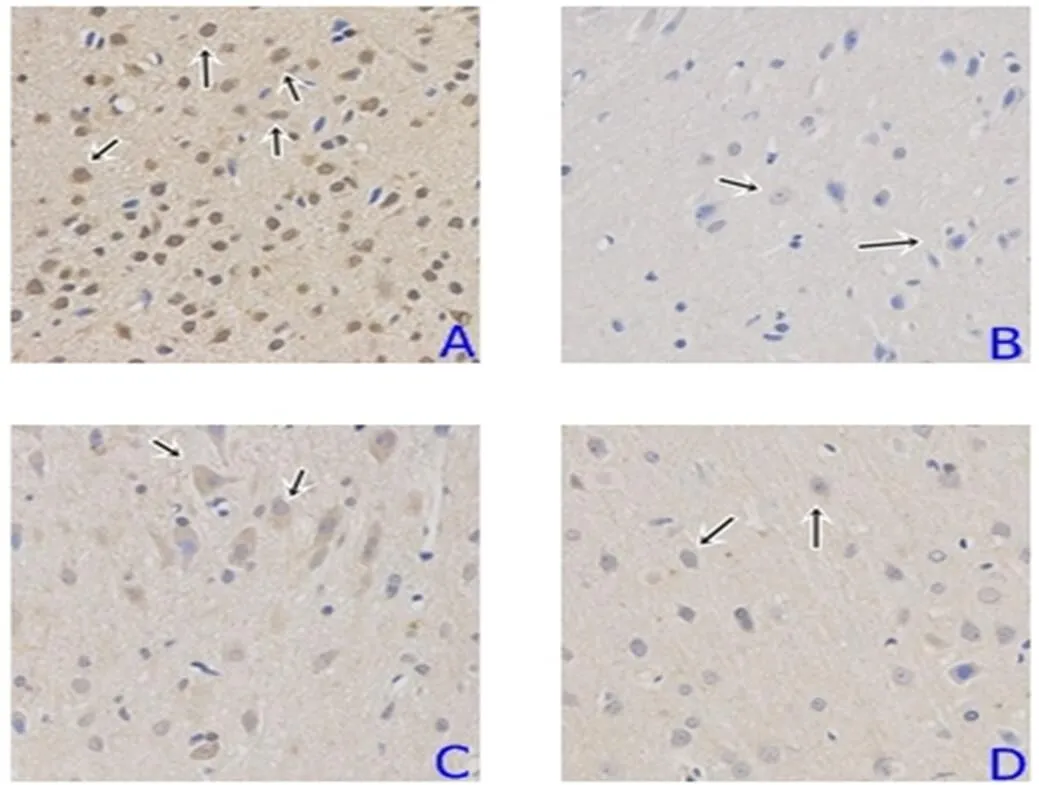
注:A为标准组,B为造模组,C为治疗组,D为阻滞组
2.3 各组大鼠实验第16周IRS-1平均光密度值(IOD)表达比较

表2 各组大鼠实验第16周IRS-1平均光密度值(IOD)表达比较 (±s)
注:与正常组比较1)<0.01;与造模组比较2)<0.01;与阻滞组比较3)<0.01
实验第16周,与标准组比较,造模组的IRS-1显著下降(<0.01);与造模组比较,治疗组和阻滞组的IRS-1均显著上升(<0.01);与阻滞组比较,治疗组的IRS-1显著上升(<0.01)。
3 讨论
中医学很早已对T2DM的发病原因及临床特点作出论述[18-19],正如《素问·奇病论》:“此肥美之所发也,此人必数食甘美而多肥也,肥者令人内热,甘者令人中满,故其气上溢,转为消渴。”其病因病机主要在于阴津亏损,燥热偏盛,且以阴虚为本,燥热为标;其病变脏腑主要在肺、脾、肾。本病治疗宜标本兼顾,补先后天精气之本、泻脏腑肥甘之浊[20]。
《素问遗篇·刺法论》:“正气存内,邪不可干。”足三里为胃经合穴,胃腑之下合穴,针之可调理脾胃,补益气血生化之源,固护后天之本;关元为任脉腧穴,也是足三阴经与任脉交会穴,为元阴、元阳关藏出入之所,针之可益精补气,扶助人体先天之本[21]。金代医学家张子和认为:“邪去则正安。”中脘和三阴交两穴通腑清脏、以除浊本,其中中脘为胃之募穴、八会穴之腑会,处任脉之上,针之可健脾利水、和胃降逆;三阴交为足太阴脾经腧穴、足三阴交会穴,针之可滋阴清热、益气祛湿[22]。诸穴合用,共奏攻补兼施、标本同治之功。
有研究[23]表明,T2DM的发生与胰岛素分泌不足和胰岛素抵抗密切相关,而IRS-1是葡萄糖代谢PI3K/Akt通路的重要环节[24],IRS-1基因敲除小鼠的PI3K活性明显降低,下游物质含量逐级递减,最终诱导T2DM。Kido Y等[25]发现T2DM患者,特别是明显IR倾向者,外周靶组织如骨骼肌、肝脏、脂肪中可发现IRS-1表达降低,而IRS-3、IRS-4等表达升高,说明IRS-1的减低与T2DM的发生呈正相关,刺激恢复IRS-1的表达对治疗T2DM有积极意义。相关研究[26-27]表明,下丘脑是中枢调控机体胰岛素敏感性的重要部位,电针可以有效调节IR大鼠下丘脑神经肽Y和Leptin受体(肥胖基因编码产物)的表达,从而改善IR状态。同时有研究[28]表明,药物和电针方法可提高IRS-1蛋白的表达,从而达到一定的糖尿病治疗效果,并且电针较之于传统降糖药疗效更佳,且无不良反应,这也为糖尿病的治疗提供了新的思路。
本实验结果显示,电针可显著增加T2DM大鼠中枢IRS-1水平,缓解IR以阻遏糖尿病的进程。笔者推测该电针法可能促进了PI3K/PKB通路的修复进程,让处于IRS-1下游的分子数量增加,以重新强化级联效应,从而达到治疗糖尿病的目的。阻滞组的对照即是最好的说明,当经历PI3K阻滞剂的大鼠,即使应用了合理治疗也无法改善IR状况,因为通路已被不可逆地阻断。
至于该针刺法如何介入PI3K/PKB通路,可以影响该通路中哪些信号分子,对诸如此类的分子进行怎样的调节,还有待于进一步的研究。另外,每个疾病的恶化和治疗均有多条信号通路的参与,那么电针能否激发其他通路代偿性开放以及有效促进类似于IRS-1的多个因子在数量及活性上得到有效恢复,也有待于进一步的探索和研究。
[1] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010年版)[J].中国医学前沿杂志(电子版),2011,3 (6):54-109.
[2] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国医学前沿杂志(电子版),2015,7 (3):26-86.
[3] Jiang S, Fang Q, Zhang F,. Functional characteriza- tion of insulin receptor gene mutations contributing to Rabosn-Mendenhall syndrome-phenotypic heterogeneity of insulin receptor receptor mutations[J]., 2011, 58(11):931-940.
[4] 吕娟,陈莉娜,马欣.PI3K/AKT信号通路与胰岛素抵抗相关疾病的关系[J].国外医学(医学地理分册),2012, 33(2):127-131.
[5] Cheng Z, Tseng Y, White MF. Insulin signaling meets mi- tochondria in metabolism[J]., 2010,21(10):589-598.
[6] Inokuchi J. Membrane microdomains and insulin resis- tance[J]., 2010,584(9):1864-1871.
[7] Chang YC, Chuang LM. The role of oxidative stress in the pathogenesis of type 2 diabetes: from molecular me- chanism to clinical implication[J]., 2010, 2(3):316-331.
[8] Muniyappa R, Montagnani M, Koh KK,. Cardiovas- cular actions of insulin[J]., 2007,28(5): 463-491.
[9] 殷茵,刘志诚,徐斌.针灸治疗2型糖尿病的临床研究进展[J].世界中医药,2016,11(11):2480-2482.
[10] 杨丰,吴松,王静芝,等.“双固一通”电针法对胰岛素抵抗模型大鼠下丘脑葡萄糖转运因子-4基因表达的影响[J].湖北中医药大学学报,2014,16(2):5-8.
[11] Zecchin HG, Priviero FB, Souza CT,. Defective in- sulin and acetylcholine induction of endothelial cell -nitric oxide synthase through insulin receptor substrate/ Akt signaling pathway in aorta of obese rats[J]., 2007,56(4):1014-1024.
[12] Park S, Hong SM, Ahn IS. Long-term intracerebro- ventricular infusion of insulin, but not glucose, modu-
lates body weight and hepatic insulin sensitivity by modifying the hypothalamic insulin signaling pathway in type 2 diabetic rats[J]., 2009,89(4):387-399.
[13] 华兴邦,李辞蓉,周浩良,等.大鼠穴位图谱的研制[J].实验动物和动物实验,1991,1(1):13-15.
[14] Carvalheira JB, Ribeiro EB, Araújo EP. Selective imp- airment of insulin signalling in the hypothalamus of obese Zucker rats[J]., 2003,46(12):1629- 1640.
[15] Bandaru SS, Lin K, Roming SL,. Effects of PI3K inhibition and low docosahexaenoic acid on cognition and behavior[J]., 2010,100(3): 239-244.
[16] 刘亚楠,陈莉娜,张静,等.IGF-1R和IRS-1在肺鳞癌组织中的表达及临床意义[J].实用肿瘤学杂志,2015, (3):225-230.
[17] 王丽娜,崔文华,梁珊,等.妊娠期糖尿病患者胎盘组织胰岛素受体底物1、蛋白酪氨酸磷酸酶1B表达及意义[J].山东医药,2015,55(40):56-58.
[18] 赵兵.消渴述源[J].吉林中医药,2002,22(2):1-2.
[19] 王琨.中医饮食护理干预对2型糖尿病临床治疗的影响和研究[J].中国保健营养,2016,26(14):444-445.
[20] 邓致华.中医药治疗糖尿病前期的优势[J].实用糖尿病杂志,2013,9(2):61.
[21] 李强,徐芬,梁凤霞,等.“标本配穴”电针对胰岛素抵抗大鼠股四头肌线粒体超微结构和生物合成功能的影响[J].中国针灸,2014,34(6):578-582.
[22] 李梦梦,卢轩,张智龙.调理脾胃针法腧穴配伍组方思路探析[J].辽宁中医杂志,2014,41(12):2573-2575.
[23] Abdin AA, Baalash AA, Hamooda HE. Effects of rosiglitazone and aspirin on experimental model of induced type 2 diabetes in rats: focus on insulin resistance and inflammatory markers[J]., 2010,24(3):168-178.
[24] Kadowaki T. Insights into insulin resistance and type 2 diabetes from knockout mouse models[J]., 2000,106(4):459-465.
[25] Kido Y, Burks DJ, Withers D,. Tissue- specific insulin resistance in mice with mutations in the insulin receptor, IRS-1, and IRS-2[J]., 2000,105(2):199-205.
[26] 梁凤霞,陈泽斌,王华,等.针刺对糖尿病大鼠下丘脑神经肽Y及其mRNA表达的影响[J].针刺研究,2005,30 (1):18-21.
[27] 梁凤霞,王华.“双固一通”针法对糖尿病大鼠下丘脑瘦素受体及其mRNA表达的影响[C].世界针灸联合会成立20周年大会论文集,2007:410-411.
[28] 袁爱红,刘志诚,魏群利,等.针刺对2型糖尿病大鼠肝组织IRS-1基因表达的调节[J].中国老年学杂志, 2009,29(7):821-823.
Effect of Electroacupuncture on Hypothalamic IRS-1 in a Rat Model of T2DM
-1,-1,2,-1,-1,1,1.
1.,430000,; 2.’,432000,
To investigate the effect of electroacupuncture on hypothalamic insulin receptor substrate 1 (IRS-1) in a rat model of type 2 diabetes mellitus (T2DM).Sixty Wistar rats were randomized to a normal group (15 rats) and an observation group (45 rats). In the observation group, a rat model of T2DM was made by high-energy diet induction. After the model was successfully made 8 weeks later, the observation group was randomized to model making, treatment and blocker groups, 15 rats each. The treatment group received electroacupuncture and the blocker group, electroacupuncture plus intraventricular perfusion of phosphatidylinositol 3-hydroxyl kinase (PI3K) blocker. After 8 weeks of treatment, fasting plasma glucose (FPG) was measured using a glucometer, fasting insulin (Fins) was determined by ELISA, insulin resistance index (IRI) was calculated and IRS-1 expression was examined by SABC immunohistochemistry assay in every group of rats.FPG and Fins increased significantly (both<0.01) and IRI and IRS-1 expression decreased significantly (<0.01) in the model making group compared with the normal group. FPG and Fins decreased significantly (both<0.01) and IRI and IRS-1 expression increased significantly (<0.01) in the treatment group compared with the model making group. FPG and Fins decreased significantly (<0.05,<0.01) and IRI and IRS-1 expression increased significantly (<0.01) in the treatment group compared with the blocker group.Electroacupuncture can improve FPG, Fins and insulin sensitivity by regulating hypothalamic IRS-1 expression in T2DM rats.
Acupuncture therapy; Diabetes mellitus, Type 2; Insulin receptor substrate proteins; Plasma glucose; Insulin; Insulin resistance index; Rats; Hypothalamus
1005-0957(2018)03-0330-05
R2-03
A
10.13460/j.issn.1005-0957.2018.03.0330
2017-11-12
湖北省武汉市重点项目(WX17B02)
蔡少康(1985—),男,住院医师
蔡毅(1980—),男,副主任医师,Email:517221634@qq.com
