功能化超小Gd2O3纳米粒子的制备
2018-03-22褚建祎张祥林
褚建祎,张祥林
(锦州医科大学附属第一医院,辽宁 锦州 121000)
磁共振成像技术(Magnetic Resonance Imaging,MRI)具有三维高质量软组织成像,高空间分辨率、无放射性辐射损伤等优点,已成为临床医学影像诊断最常用和最重要手段[1-2]。同时,造影剂(contrast agents)的使用能够有效提高 MRI 诊断的对比度、分辨率和灵敏度,统计表明,30%以上的 MRI诊断需要使用造影剂增强检查[3]。目前最常见的造影剂多为基于 Gd3+,Fe3+/Fe2+的顺磁性物质,如钆喷酸葡胺(Gd-DTPA)和铁羧葡胺(Resovist)。
随着纳米技术的发展,基于Gd基的超小纳米粒子得到了良好的发展。由于纳米尺寸效应的优势,使其具有良好的药代动力学及较长的体内存留时间,并且能够显著提高弛豫率和灵敏度,可以作为杰出的T1增强造影剂。以往有研究工作表明,GdF3[4]、GdPO4[5]、NaGdF4[6]用做MRI造影增强,均显示良好的分散性,稳定性和较高的弛豫率,能够明显的缩短水分子纵向弛豫时间。本文拟利用溶剂法一步制备超小Gd2O3纳米粒子,Gd2O3纳米粒子表面单位体积Gd3+离子密度为最大,因为其弛豫率最高,可极大提高MRI造影增强的灵敏度。
1 材料与方法
1.1 仪器与试药
乙酸钆Gd(OAC)3(99.99%),二甲基亚砜(DMSO),四甲基氢氧化铵(TMAH),羧基端-三乙二醇,二氯甲烷均购买于Sigma-Aldrich公司,纤维素透析袋(截留分子量:1 000)及尼龙超滤膜(孔径:0.2 μm)购买于Spectrum Labs公司。Gd2O3纳米粒子的形貌和尺寸通过FEI Tecnai G2型透射电子显微镜进行观察。将制备好的纳米粒子的悬浮液超声分散后,取一滴滴于铜网上,自然干燥。1.4 T Bruker minispec mq 60 NMR分析仪用于测量Gd2O3纳米粒子的弛豫率,同时MagnetomVerio 3.0 TMRI 扫描仪(Siemens,德国)对Gd2O3纳米粒子进行体外成像研究。最后纳米粒子水溶液中的Gd浓度由Perkin Elmer 公司Optima 4300 DV型电感耦合等离子体发射光谱仪测定。
1.2 方法
1.2.1 制备 Gd2O3纳米粒子。首先将67 mg,0.02 mmol Gd(OAc)3溶于3 mL DMSO溶液,超声分散后,将含有100 mg,0.056 mmol的四甲基氢氧化铵的1 mL乙醇溶液逐滴加入上述DMSO溶液中。全部加入之后,磁性搅拌上述混合液2 h。加入5 mL乙醇到上述溶液中,轻轻搅拌。然后利用高速离心机在12 000 rpm下离心10 min,收集产物为Gd2O3纳米粒子,利用离心和乙醇对产物超小Gd2O3纳米粒子进行反复清洗3次。最后将获得的Gd2O3纳米粒子分散到1 mL的二氯甲烷中。
1.2.2 表面功能修饰Gd2O3纳米粒子 将40 mg,0.05 mmol的羧基端-三乙二醇溶于1 mL的二氯甲烷中,然后在室温下滴加到Gd2O3纳米粒子的溶液中,将混合溶液封口,磁力搅拌过夜后至溶液变得澄清。将6 mL的环己烷加入到反应器中,此时产生大量的絮状沉淀。利用高速离心机在12 000 rpm下离心10 min,羧基端-三乙二醇修饰的Gd2O3纳米粒子(F-Gd2O3)。收集产物,反复利用环己烷/二氯甲烷对产物进行沉淀和溶解3次,从而获得了将产物通过尼龙超滤膜(0.22 μm),真空干燥40 h,从而获得了性质稳定的功能化Gd2O3纳米粒子。利用Optima 4300 DV 型电感耦合等离子体发射光谱仪对纳米粒子中的Gd3+离子进行测量,所占比重大约为47%。
1.2.3 功能化Gd2O3纳米粒子稳定性测试 将制备的功能化Gd2O3纳米粒子溶于pH=7.4的PBS溶液中,将其置于室温下进行放置,利用动态光散射仪分别对1、3、5、7、14、21 d时对溶液中纳米粒子的水合离子半径进行测量,反映功能化Gd2O3纳米粒子的聚集状态,从而检验纳米粒子的稳定性。
1.2.4 功能化Gd2O3纳米粒子的弛豫率测定 将功能化Gd2O3纳米粒子分别配制成一系列的水悬浮液,浓度依次为0.05 mmol/L(记为mM)、0.10、0.20 mM、0.40 M、0.80 M,同时将pH=7.4的PBS溶液作为对照组,利用1.4 T Bruker minispec mq 60 NMR分析仪对其在40 ℃时的弛豫速率1/T1进行测量,并且对1/T1(S-1)和Gd(mM)进行作图,从而得出纵向弛豫率r1。
1.2.5 MRI成像 配置不同浓度的能化Gd2O3纳米粒子,分别为0.06、0.1、0.5 mM,同时用水做对照剂。利用MagnetomVerio 3.0T MRI 扫描仪对样品进行MRI的T1加权成像,MRI 成像采用T1加权自旋回波序列(SE),参数设置如下:TR 482 ms,TE 16 ms;层厚1 mm,层间距5.2 mm;数据矩阵436×512。
2 结 果
2.1 功能Gd2O3纳米粒子的形貌与性质分析
制备的功能化Gd2O3纳米粒子的形貌与粒径可通过TEM和HRTEM进行观测(图1)。功能化Gd2O3纳米粒子的形态规则,呈球形,粒径均匀分布,大小约为2.5 nm 范围内,具有较强的尺寸优势和高的表面积。另外,通过羧基端-三乙二醇的表面连接,使其能够极好地溶解在水溶液中,并且能够在室温下稳定存在,对其水合半径的测试结果表明,在测定期间内,纳米粒子的水合半径没有明显变化,表明表面羧基端-三乙二醇的修饰能够有效的防止纳米粒子因表面积造成的团聚,显示了较好的稳定性(图2)。

图1 功能化Gd2O3纳米粒子的电子透射电镜照片(a)和高分辨电子透射电镜照片(b)
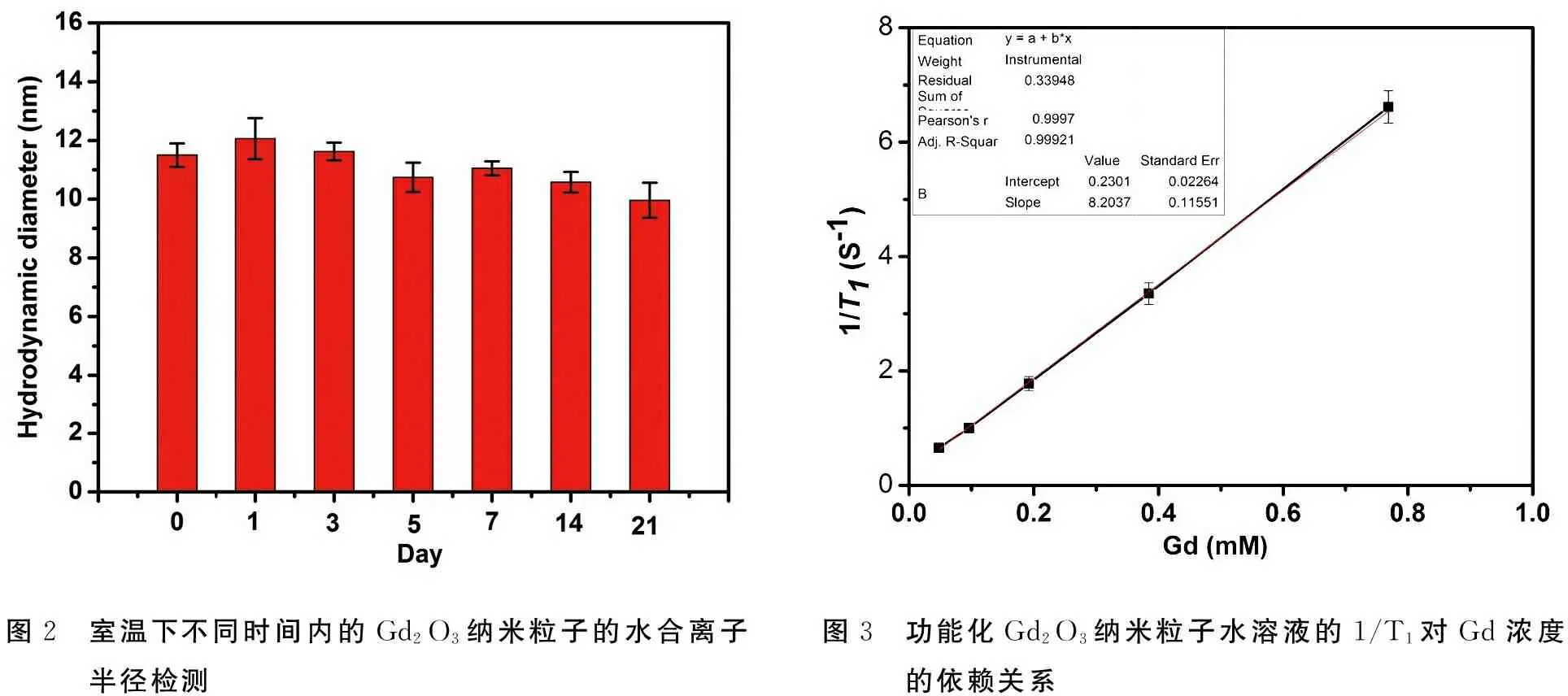
图2 室温下不同时间内的Gd2O3纳米粒子的水合离子半径检测图3 功能化Gd2O3纳米粒子水溶液的1/T1对Gd浓度的依赖关系
2.2 功能化Gd2O3纳米粒子的弛豫率分析
如图3所示,功能化Gd2O3纳米粒子的弛豫率分析显示制备的功能化Gd2O3纳米粒子的水悬浮液的驰豫速率1/T1对Gd浓度的依赖关系。拟合直线为y=0.2301+78.203 7 CGd浓度,故功能化Gd2O3纳米粒子的纵向驰豫率r1为8.203 7 mM-1.S-1。
2.3 功能化Gd2O3纳米粒子的体外T1加权MRI成像
不同浓度的功能化Gd2O3纳米粒子的体外T1加权MRI成像如图4所示,其中水作为对照剂,对应的Gd2O3纳米粒子溶液的信号强度与其浓度表现出明显的依靠关系,随着浓度逐渐增大,对比的MRI成像亮度增加,信号逐渐提高。
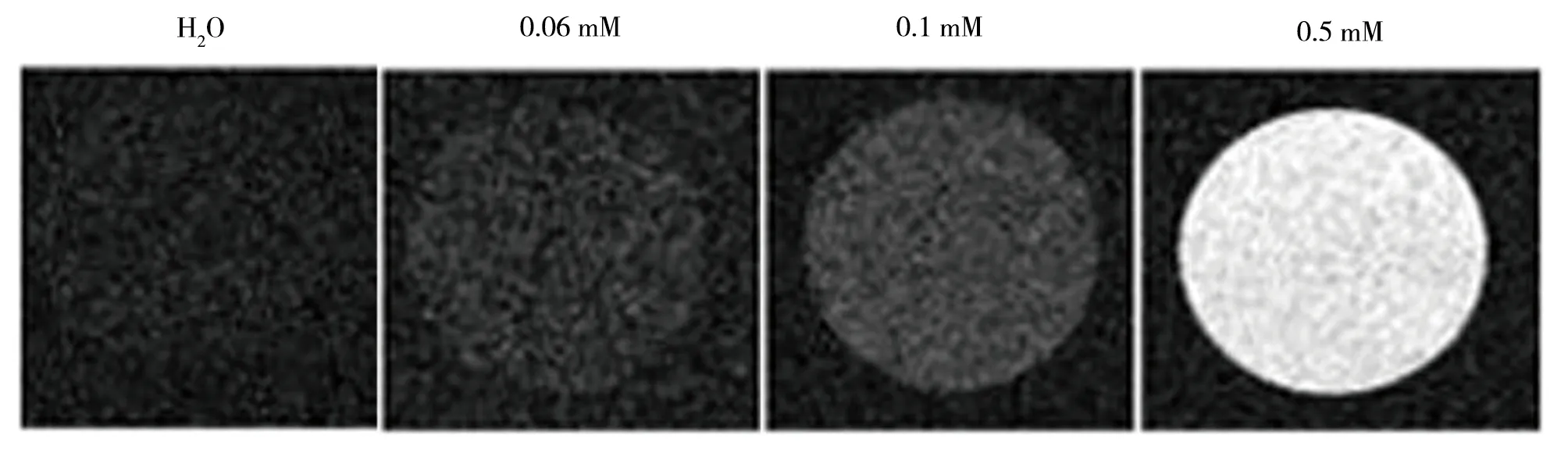
图4 功能化Gd2O3纳米粒子的体外T1加权MRI成像图
3 讨 论
铁基造影剂一般是常用于T2的造影剂(阴性 MRI 造影剂),以缩短横向驰豫时间为主,降低磁共振信号强度,图像呈暗色,在造影增强过程中,易与出血点、钙化点、金属沉积部位等低信号混淆,导致临床诊断困难。另外超顺磁性造影剂对磁场高度敏感,会干扰邻近正常组织的磁场,导致影像模糊或病变周围背景的破坏(磁敏感伪影或模糊效应),也会给临床诊断带来困难[7-8]。所以T2造影剂在临床中应用较少,其应用前景和潜力远不如T1造影剂应用广泛。相对于铁基造影剂,Gd3+基络合物造影剂作为T1造影剂(阳性 MRI 造影剂),可显著提高磁共振的信号强度,图像呈白或亮色,是MRI T1造影剂的最佳选择[9]。自Schering AG 公司最先研发的Gd-DTPA(Magnevist®)成为第一个进入临床应用的造影剂以来[10],有大量的钆造影剂被先后研发出来,并进入临床应用阶段,Gd-DTPA-BMA(Omniscan®)[11],钆弗塞胺Gd-DTPA-BMEA(OptiMARK®)[12],钆钡葡胺Gd-BOPTA(MultiHance®)[13]和钆塞酸二钠Gd-EOB-DTPA(Primovist®)[14],钆特二葡甲胺Gd-DOTA(Dotarems®)[15]及其衍生物等等。尽管Gd3+基络合物造影剂目前已经广泛地用于临床使用,但其增强信号强度弱,成像时间长,使用剂量大,灵敏度低等缺陷仍然限制了其在临床中的进一步应用。
众所周知,水分子没有未成对电子,电子自旋磁矩为零,不具有磁性,为反磁性物质。在没有Gd2O3纳米粒子存在的时候,水分子的纵向驰豫时间很长。然而,当有Gd2O3纳米粒子存在的水溶液中,水分子的纵向驰豫时间会明显缩短,而且随着钆离子浓度的增加,水分子的纵向驰豫时间会呈现等比减趋势,因此纵向驰豫时间T1的倒数1/T1与钆离子的浓度会呈线性正相关递进。本实验结果可以看出,与理论结果相符,Gd2O3纳米粒子的1/T1与Gd浓度呈线性关系并且拟合程度较好,纵向驰豫率r1为8.203 7 mM-1S-1。相比于临床常用的Gd-DTPA(r1为4.8 mM-1S-1),Gd2O3纳米粒子显示了较高的纵向驰豫率,因此具有更好的MRI成像能力。
如图4结果所示,水的信号强度很低,对应的MRI 成像呈暗色,这与水分子的反磁性性质相对应。而作为造影剂,功能化Gd2O3纳米粒子溶液的 MRI 图像明亮,对应的信号强度与其浓度表现出明显的依靠关系,随着浓度逐渐增大,对比的MRI成像亮度增加,信号逐渐提高。这说明制备的功能化Gd2O3纳米粒子作为T1加权造影剂可以明显缩短纵向驰豫时间T1,并随着功能化Gd2O3纳米粒子浓度的增加缩短显著,T1加权MRI成像的信号强度随着纵向驰豫时间的缩短呈现增强趋势。
本文通过溶剂法一步制备了超小的功能化Gd2O3纳米粒子,研究表明,功能化Gd2O3纳米粒子具有杰出的分散性,稳定性和纵向驰豫率,并且在体外的MRI成像证明了其可以作为一种出色的MRI增强造影剂用于未来的MRI成像研究。
(此文图1-4见附页1)
[1] Riegler J,Wells JA,Kyrtatos PG,et al. Targeted magnetic delivery and tracking of cellsusing a magnetic resonance imaging system [J]. Biomaterials,2010,31(20):5366-5371.
[2] Maniam S,Szklaruk J. Magnetic resonance imaging:Review of imaging techniques andoverview of liver imaging [J]. World Journal of Radiology,2010,2(8):309-322.
[3] Shokrollahi H. Contrast agents for MRI [J]. Materials Science and Engineering,2013,33(8):4485-4497.
[4] Tian Y,Yang HY,Li K,et al. Monodispersed ultrathin GdF3 nanowires:oriented attachment,luminescence,and relaxivity for MRI contrast agents [J]. Journal of Materials Chemistry,2012,22(42):22510-22516.
[5] Hifumi H,Yamaoka S,Tanimoto A,et al. Dextran coated gadolinium phosphate nanoparticlesfor magnetic resonance tumor imaging [J]. Journal of Materials Chemistry,2009,19(35):6393-6399.
[6] Hou Y,Qiao R,Fang F,et al. NaGdF4nanoparticle-based molecular probes for magneticresonance imaging of intraperitoneal tumor xenografts in vivo [J]. Acs Nano,2012,7(1):330-338.
[7] Poeckler SC,Koepke J,Gueckel F,et al. MRI with superparamagnetic iron oxide:efficacy inthe detection and characterization of focal hepatic lesions [J]. Magnetic Resonance Imaging,1999,17(3):383-392.
[8] Bulte JW,Kraitchman DL. Iron oxide MR contrast agents for molecular and cellularimaging [J]. NMR in Biomedicine,2004,17(7):484-499.
[9] Caravan P,Ellison JJ,McMurry TJ,et al. Gadolinium(III)chelates as MRI contrast agents:structure,dynamics,and applications [J]. Chemical Reviews,1999,99(9):2293-2352.
[10] Haustein J,Niendorf HP,Krestin G,et al. Renal tolerance of gadolinium-DTPA/dimegluminein patients with chronic renal failure [J]. Investigative Radiology,1992,27(2):153-156.
[11] Chang CA. Magnetic resonance imaging contrast agents design and physicochemicalproperties of gadodiamide [J]. Investigative Radiology,1993,28(7):21-27.
[12] Adzamli K,Periasamy M,Spiller M,et al. NMRD assessment of Gd-DTPA-bis(methoxyethylamide),(Gd-DTPA-BMEA),a nonionic MRI agent [J]. Investigative Radiology,1999,34(6):410-427.
[13] Cavagna F,Daprà M,Maggioni F,et al. Gd-BOPTA/Dimeg:Experimental disease imaging[J]. Magnetic Resonance in Medicine,1991,22(2):329-333.
[14] Lee NK,Kim S,Lee JW,et al. Biliary MR imaging with Gd-EOB-DTPA and its clinicalapplications [J]. Radiographics,2009,29(6):1707-1724.
[15] Bousquet JC,Saini S,Stark D,et al. Gd-DOTA:Characterization of a new paramagneticcomplex [J]. Radiology,1988,166(3):693-698.
