晚期肝癌患者血清转化生长因子β1在肝动脉化疗栓塞术前后变化及对预后的意义
2018-03-22刘磊韩文豪陈涛侯国欣仝现州
刘磊,韩文豪,陈涛,侯国欣,仝现州
(郑州人民医院 普通外科,河南 郑州450000)
原发性肝癌(primary hepatic carcinoma,PHC)起病较为隐匿,患者被确诊时多为中晚期[1]。手术切除针对早期肝癌疗效较好,而介入化疗是中晚期肝癌的主要治疗手段[2]。随着医疗技术和医用材料的进步,经肝动脉导管化疗栓塞(transcatheter arterial chemoembolization,TACE)技术已获得了长足进步,但治疗后对复发和转移的预防和及早发现仍是提高TACE远期疗效的关键[3-4]。转化生长因子β1(transforming growth factor β1,TGF-β1)是一种细胞生长和分化调节因子,已有研究[5-8]表明其在肝癌、乳腺癌、胃癌、结直肠癌、前列腺癌等多种肿瘤中异常表达,并在癌细胞转移过程中发挥重要作用。目前关于血清TGF-β1在晚期PHC患者TACE治疗前后的变化及对预后的意义的研究尚不够详细,本研究拟通过分析TACE治疗前后血清TGF-β1的变化,探讨TGF-β1对TACE预后的具体意义,研究结果报告如下。
1 资料与方法
1.1 临床资料
所有研究对象来自2012年6月—2016年1月郑州人民医院收治的原发性肝癌患者。病例纳入标准:⑴ 经病理学和影像学确诊为中晚期原发性肝癌,不适宜或不愿接受切除手术而行TACE治疗方案的患者;⑵ 肝功能Child-Pugh评分为A或B级,KPS评分≥70分;⑶ 无既往手术切除或TACE、放化疗治疗史;⑷ 对本研究知情同意且有完整随访资料。排除标准:⑴ 严重心、肺、肾功能不全者;⑵ 继发性肝癌或伴有其他肿瘤;⑶ 门静脉或肝静脉主干癌栓;⑷ 癌细胞广泛远处转移,预计总生存期<3个月;⑸ 凝血功能障碍,对碘造影剂过敏者以及有其他TACE治疗禁忌证者。研究最终纳入符合标准的PHC患者116例,收集所有患者的一般资料,并进行术后随访,最长生存随访时间40个月,最短18个月。本研究经过郑州人民医院伦理审查委员会批准通过。
1.2 治疗方法
所有患者接受TACE常规化疗药物方案,主要化疗药物为奥沙利铂(85 mg/m2)和氟尿嘧啶(500 mg/m2)及表柔比星。经皮股动脉穿刺,置入导管,根据肝动脉造影观察瘤灶情况,包括位置、大小和供血血管,对供血动脉缓慢灌注化疗药物奥沙利铂(30 mg/s)+氟尿嘧啶(30 mg/s),而后灌注超液态碘化油和表柔比星或阿霉素的混合剂栓塞瘤灶供血动脉,栓塞完成后退出导管处理伤口。患者治疗完成1个月后进行复查,而后每3个月复查1次,1年后若无异常改为6个月复查1次。患者复查时首先检测甲胎蛋白(AFP)水平、肝功能指标和肝脏超声,怀疑复发时行腹部CT、MRI或肝动脉造影检查进行确诊,若AFP持续1个月超过400 μg/L或持续一个超过200 μg/L且病灶处的影像学检查至少有1项出现典型肝癌表现即可诊断为肝癌复发,并结合其他脏器检查结果判断是否发生了肝外转移。
1.3 观察指标
采集患者术前1 d与术后1、7、30 d时的晨起静脉血,肝素抗凝保存送实验室;3 000r/min转速离心10 min分离血清,而后采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)法检测血清中TGF-β1水平。ELISA试剂盒购自上海酶联生物科技有限公司(美国R&D),操作按照试剂盒说明书进行。
1.4 统计学处理
所有数据采用SPSS 19.0进行统计分析。计量数据采用均值±标准差(±s)表示,不同组间比较采用独立样本t检验,同组间不同时间点比较采用配对样本t检验,多时间点数据之间比较采用重复测量;不同组间计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。将各时间点的TGF-β1水平按照中位数分为高低两组,而后对每个指标进行Kaplan-Meier生存分析,Log-rank检验差异;而后将接近有意义的指标(P<0.2)纳入多因素Cox回归分析其对生存期的影响。
2 结 果
2.1 一般资料
研究所纳入116例PHC患者一般资料如表1所示。根据术前TGF-β1水平的分布可以看出,较大肿瘤直径患者术前TGF-β1水平高于较小直径组,而多个癌灶高于单个癌灶水平,差异均有统计学意义(均P<0.05)。
表1 116例PHC患者一般资料及术前TGF-β1水平的分布(±s)Table 1 The preoperative data and TGF-β1 levels of the 116 PHC patients (±s)

表1 116例PHC患者一般资料及术前TGF-β1水平的分布(±s)Table 1 The preoperative data and TGF-β1 levels of the 116 PHC patients (±s)
资料 n(%) 术前TGF-β1(pg/mL) tP年龄(岁)< 60 51(44.0) 300.1±90.5 0.576 0.566≥ 60 65(56.0) 289.5±104.1性别男 102(87.9) 297.8±99.3 1.08 0.283女14(12.1) 267.7±87.3 Child-Pugh分级A级 48(41.4) 282.5±98.2 1.077 0.284 B级 68(58.6) 302.1±97.9 KPS评分≤90分 18(15.5) 297.1±79.8 0.134 0.893 100分 98(84.5) 293.7±101.4合并病毒性肝炎HBV 76(65.5) 289.2±97.3 0.763 0.469 HCV 23(19.8) 290.5±93.4其他 17(14.7) 321.4±108.9术前 AFP(µg/L)<400 78(67.2) 290.0±92.4 0.653 0.515≥ 400 38(32.8) 302.7±109.7肿瘤最大直径(cm)≤ 5 54(46.6) 271.7±97.4 2.356 0.020> 5 62(53.4) 313.8±95.1癌灶个数(个)1 69(59.5) 266.4±99.9 3.919 0.001≥ 2 47(40.5) 334.9±80.3
2.2 TACE治疗前后TGF-β1水平变化及与复发转移的关系
截止2017年6月30日随访结束,共有75例患者出现肝癌复发或转移,41例患者无进展。与术前相比,总体及各组术后1 d时TGF-β1水平升高,而术后7、30 d时降低,差异均具有统计学意义(P<0.05);复发转移组和无进展组间比较,术前和术后1 d及7 d时水平无差异,术后1个月复发转移组明显高于无进展组(P<0.05)(表2)。
表2 全组及复发转移组、无进展组治疗前后TGF-β1水平变化(pg/mL,±s)Table 2 Changes in TGF-β1 levels in the whole group or patients with recurrence/metastasis and progression-free survival (pg/mL, ±s)
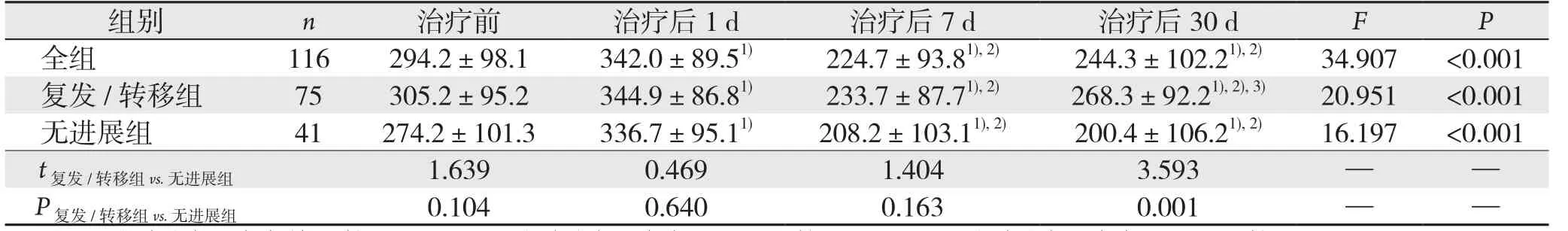
表2 全组及复发转移组、无进展组治疗前后TGF-β1水平变化(pg/mL,±s)Table 2 Changes in TGF-β1 levels in the whole group or patients with recurrence/metastasis and progression-free survival (pg/mL, ±s)
注:1)与同组治疗前比较,P<0.05;2)与同组治疗后1 d比较,P<0.05;3)与同组治疗后7 d比较,P<0.05Note: 1) P<0.05 vs. pretreatment value of the same group; 2) P<0.05 vs. posttreatment day 1 value of the same group; 3) P<0.05 vs.posttreatment day 7 value of the same group
组别 n 治疗前 治疗后1 d 治疗后7 d 治疗后30 d FP全组 116 294.2±98.1 342.0±89.51) 224.7±93.81),2) 244.3±102.21),2) 34.907 <0.001复发/转移组 75 305.2±95.2 344.9±86.81) 233.7±87.71),2) 268.3±92.21),2),3) 20.951 <0.001无进展组 41 274.2±101.3 336.7±95.11) 208.2±103.11),2) 200.4±106.21),2) 16.197 <0.001 t复发/转移组vs.无进展组 1.639 0.469 1.404 3.593 — —P复发/转移组vs.无进展组 0.104 0.640 0.163 0.001 — —
2.3 TGF-β1水平对生存期的影响
将各时间点TGF-β1水平按照中位数分为高水平和低水平两组,而后对各指标进行Kaplan-Meier生存分析。PHC患者癌灶最大直径、癌灶个数、术前、术后30 d时的TGF-β1水平是PHC患者生存期的影响因素(均P<0.05)(表3)(图1)。纳入Log-rank差异检验接近有统计学意义(P<0.2)的指标进行多因素Cox回归分析,方法为“向前:条件”,结果显示,癌灶最大直径、术后30 d TGF-β1水平是无进展生存期的独立影响因素,术后30 d时高TGF-β1水平具有较高的风险出现预后不良(表4)。
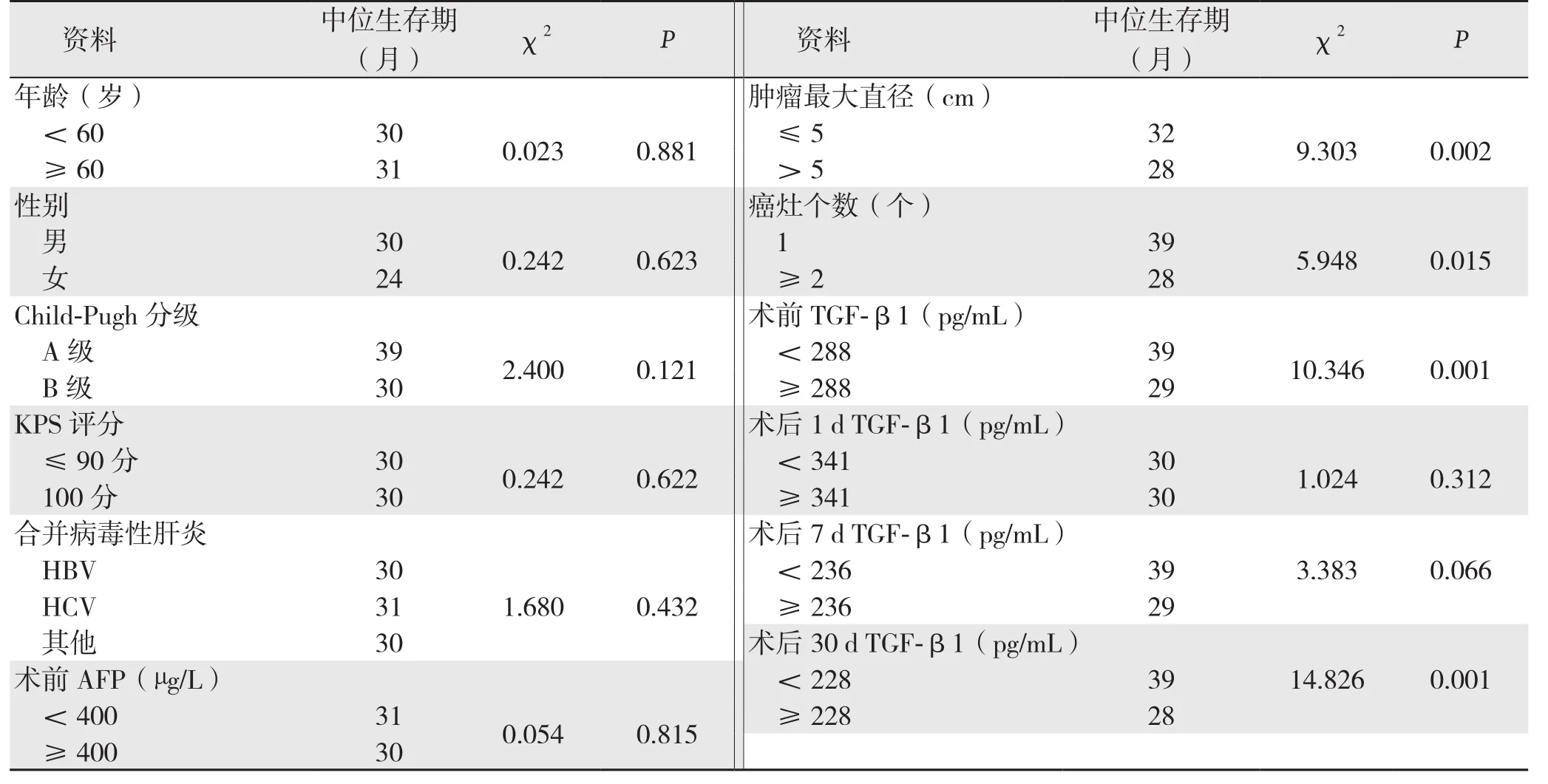
表3 各指标对患者生存期的影响Table 3 In fl uence of each variable on survival time of the patients

图1 不同时间点高TGF-β1组和低TGF-β1组生存曲线Figure 1 Survival curves of high and low TGF-β1 group at different time points

表4 多因素Cox回归分析结果Table 4 Multivariate Cox regression analysis
3 讨 论
我国是乙肝病毒感染的重灾区,并因此导致了肝炎、肝硬化及肝癌等疾病的高发病率[9]。原发性肝癌是我国发病率排名前五的消化系统恶性肿瘤,早期不易被发现,而中晚期时治疗难度大,疗效也难尽人意[10]。TACE是指通过将化疗药物经血管介入术送至癌灶以杀死癌细胞,适用于不可手术切除的中晚期肝癌患者。TACE对肝癌的治疗较为有效,但术后复发和转移的预防仍是延长患者生存期的关键[11]。现有研究[12-15]表明,TGF-β1在包括肝癌在内的多种肿瘤组织中呈高表达状态,且对非小细胞肺癌、宫颈癌、乳腺癌、结直肠癌等恶性肿瘤的预后有一定提示意义,但关于中晚期PHC患者TACE治疗前后TGF-β1水平的变化以及各时间点TGF-β1水平对预后的提示意义需要进一步详细报道。本研究通过检测PHC患者TACE治疗前后TGF-β1水平的变化,并通过随访分析不同TGF-β1水平患者复发、转移和生存情况发现,TGF-β1在PHC患者体内呈异常高水平,TACE术后1 d会首先上升,后降至低于术前的水平,而术前及术后30 d时的TGF-β1水平与患者生存情况密切相关,其中术后30 d时的高TGF-β1水平意味着高复发转移风险,且是患者无进展生存期的独立预后因素。
转化生长因子TGF-β1在肝癌的发生发展过程中具有两面性:正常水平TGF-β1可以调控肝细胞增殖并促进其凋亡,当其表达水平升高时,会转而促进细胞癌变和不受控增殖的发生[16]。现有研究[17]表明,出现这种生物学效应的原因在于肝癌细胞表面的TGF-β1受体缺失,导致抑制增殖和促进凋亡信号不能传导。此外,TGF-β1主要从3个方面作用于肿瘤的发生发展:⑴ TGF-β1具有免疫抑制作用,可以下调免疫蛋白的表达,促进炎性因子分泌,肿瘤组织周围聚集大量炎性细胞因子,营造了肿瘤生长的微环境。Nakamura等[18]研究表明,转染了TGF-β1 cDNA的结肠癌细胞增殖活性显著高于对照组,且会抑制CD8等T细胞分泌,抑制抗肿瘤的T细胞应答信号通路,具有免疫抑制作用。⑵ TGF-β1可以通过下调肿瘤血管生长抑素(angiostatin)的表达,调控肿瘤组织血管新生、促进癌细胞生长、增殖[19-20];Yang等[19]研究表明,TGF-β1高表达也可以通过抑制JNK通路诱发胶质瘤血管再生,从而促进肿瘤细胞生长。⑶ TGF-β1可以提高水解蛋白与细胞黏附分子结合的活性,促进癌细胞的转移和侵袭[21]。因此可以看出,TGF-β1在肿瘤及癌旁组织中的高表达水平与癌细胞的生长活性密切相关。
关于TGF-β1与肝癌的相关性以及其预后意义已得到证实,但大部分研究偏重于分析肝癌患者治疗前的血清TGF-β1水平,且部分临床研究就TACE术后血清TGF-β1水平的变化结论不一[22-23]。Lin等[24]研究表明,治疗前TGF-β1水平与肝癌的疾病等级相关,高TGF-β1水平的肝癌患者生存期显著低于低TGF-β1患者;刘昭明等[25]研究发现,血清TGF-β1水平在肝癌切除术后7、14、28 d时相对于术前降低,且术后14 d时的血清TGF-β1水平对预后的诊断效果最好。本研究结果表明,TGF-β1与癌灶个数和大小有关,因此可以看出TGF-β1水平在某种程度上代表着癌细胞的活性状态;当TACE治疗有效杀死癌灶及周围的癌细胞时,TGF-β1表达水平也会随之下降,因此在术后7 d时PHC患者整体TGF-β1水平低于术前;但在术后1 d时,癌细胞会随着代谢进入外周血中引起血液中TGF-β1水平骤然升高,但随着代谢排出体外后,绝大多数肿瘤细胞被清除导致TGF-β1不再高表达,血清水平又逐渐下降。这也是本研究结果中PHC患者在术后1 d时整体TGF-β1水平较术前显著上升,在术后7 d时显著下降的原因。可以看出,在术前和术后7 d时,复发转移组和无复发组之间的TGF-β1水平均无统计学差异,在术后30 d时差异显著,这表明两组患者的癌细胞活性状态在术前及术后7 d之前尚无明显差异,但复发转移组患者体内的肝癌细胞可能已出现了肝内微转移或术后微残留但未被及时检出。随着残留的癌细胞继续增殖生长,在影像学复发特征显现之前便引起了TGF-β1水平的升高,因此复发转移组患者在术后30 d时呈现出了TGF-β1高表达水平的状态。由此看来,PHC患者术后30 d的TGF-β1水平对其复发转移及生存状况具有积极的预示意义,值得临床进行重视,但TGF-β1的具体作用路径及诊断时具体标准尚需要进一步的大样本研究。
[1] Colagrande S, Inghilesi AL, Aburas S, et al. Challenges of advanced hepatocellular carcinoma[J]. World J Gastroenterol, 2016,22(34):7645–7659. doi: 10.3748/wjg.v22.i34.7645.
[2] 李雪松, 夏锋. 晚期肝癌治疗方案选择[J]. 肝胆外科杂志, 2014,22(4):250–254.Li XS, Xia F. Selection of treatment plan for advanced liver cancer[J]. Journal of Hepatobiliary Surgery, 2014, 22(4):250–254.
[3] Tsurusaki M, Murakami T. Surgical and Locoregional Therapy of HCC: TACE[J]. Liver Cancer, 2015, 4(3):165–175. doi:10.1159/000367739.
[4] 叶甲舟, 谢志波, 白涛, 等. 术后辅助肝动脉化疗栓塞对存在早期复发危险肝癌患者的必要性[J]. 中华肝胆外科杂志, 2016,22(4):217–222. doi:10.3760/cma.j.issn.1007–8118.2016.04.001.Ye JZ, Xie ZB, Bai T, et al. Postoperative adjuvant transarterial chemoembolization after curative resection reduces early recurrence of hepatocellular carcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2016, 22(4):217–222. doi:10.3760/cma.j.issn.1007–8118.2016.04.001.
[5] Zu X, Zhong J, Tan J, et al. TGF-β1 induces HMGA1 expression in human breast cancer cells: implications of the involvement of HMGA1 in TGF-β signaling [J]. Int J Mol Med, 2015, 35(3):693–701. doi: 10.3892/ijmm.2015.2062.
[6] Ma H, Wei Y, Leng Y, et al. TGF-β1-induced expression of Id-1 is associated with tumor progression in gastric cancer[J]. Med Oncol,2014, 31(7):19. doi: 10.1007/s12032–014–0019–3.
[7] 张玉洁, 章明放. 前列腺癌组织TGF-β1和AR与ERα表达及其相关性分析[J]. 中华肿瘤防治杂志, 2012, 19(11):844–847.Zhang YJ, Zhang MF. Expression and correlation of TGF-β1 and AR,ERα in prostate cancer tissues[J]. Chinese Journal of Cancer Prevention and Treatment, 2012, 19(11):844–847.
[8] Ma J, Gao HM, Hua X, et al. Role of TGF-β1 in human colorectal cancer and effects after cantharidinate intervention[J]. Asian Pac J Cancer Prev, 2014, 15(9):4045–4048.
[9] 姚豫桐, 安志明, 罗兰云, 等. 乙肝相关性肝癌术前乙型肝炎病毒DNA载量与围手术期并发症的关系[J]. 中国普通外科杂志,2016, 25(1):19–24. doi:10.3978/j.issn.1005–6947.2016.01.004.Yao YT, An ZM, Luo LY, et al. Relationship between preoperative hepatitis B virus DNA level and perioperative complications in patients with hepatitis B-related hepatocellular carcinoma[J].Chinese Journal of General Surgery, 2016, 25(1):19–24.doi:10.3978/j.issn.1005–6947.2016.01.004.
[10] Yim HJ, Suh SJ, Um SH. Current management of hepatocellular carcinoma: an Eastern perspective[J]. World J Gastroenterol, 2015,21(13):3826–3842. doi: 10.3748/wjg.v21.i13.3826.
[11] Ishikawa T, Abe S, Inoue R, et al. Predictive factor of local recurrence after balloon-occluded TACE with miriplatin (MPT) in hepatocellular carcinoma[J]. PLoS One, 2014, 9(7):e103009. doi:10.1371/journal.pone.0103009.
[12] Huang AL, Liu SG, Qi WJ, et al. TGF-β1 protein expression in nonsmall cell lung cancers is correlated with prognosis[J]. Asian Pac J Cancer Prev, 2014, 15(19):8143–8147.
[13] Fan DM, Tian XY, Wang RF, et al. The prognosis signi fi cance of TGF-β1 and ER protein in cervical adenocarcinoma patients with stage Ib~IIa[J]. Tumour Biol, 2014, 35(11):11237–11242. doi:10.1007/s13277–014–2110-y.
[14] 张琳, 吕志栋, 刘相萍, 等. 转化生长因子-β1通过诱导上皮-间充质转化促进乳腺癌细胞侵袭转移的研究[J]. 中华实验外科杂志, 2015, 32(5):979–982. doi:10.3760/cma.j.issn.1001–9030.2015.05.011.Zhang L, Lu ZD, Liu XP, et al. Transforming growth factor-β1 enhances the invasion and metastasis ability of breast cancer cells by inducing epithelial-mesenchymal transition[J]. Chinese Journal of Experimental Surgery, 2015, 32(5):979–982. doi:10.3760/cma.j.issn.1001–9030.2015.05.011.
[15] 刘贤伟, 曹俊达, 熊功友, 等. TGF-β1、Smad7与树突状细胞在结直肠癌肝转移中作用的初步研究[J]. 中国普通外科杂志, 2015,24(1):63–69. doi:10.3978/j.issn.1005–6947.2015.01.012.Liu XW, Cao JD, Xiong GY, et al. Preliminary study of roles of TGF-1, Smad7 and dendritic cells in colorectal cancer liver metastases[J]. Chinese Journal of General Surgery, 2015, 24(1):63–69. doi:10.3978/j.issn.1005–6947.2015.01.012.
[16] 汪海波, 朱健, 郗二平, 等. ROCKⅠ/Ⅱ基因下调对TGF-β1诱导的人主动脉平滑肌细胞迁移及增殖的影响[J]. 中国普通外科杂志,2017, 26(6):735–741. doi:10.3978/j.issn.1005–6947.2017.06.011.Wang HB, Zhu J, Xi EP, et al. Effects of ROCK I/II gene downregulation on TGF- 1 induced migration and proliferation in human aortic vascular smooth muscle cells[J]. Chinese Journal of General Surgery, 017, 26(6):735–741. doi:10.3978/j.issn.1005–6947.2017.06.011.
[17] Ozaki I, Hamajima H, Matsuhashi S, et al. Regulation of TGF-β1-Induced Pro- Apoptotic Signaling by Growth Factor Receptors and Extracellular Matrix Receptor Integrins in the Liver[J]. Front Physiol, 2011, 2:78. doi: 10.3389/fphys.2011.00078.
[18] Nakamura S, Yaguchi T, Kawamura N, et al. TGF-β1 in tumor microenvironments induces immunosuppression in the tumors and sentinel lymph nodes and promotes tumor progression[J]. J Immunother, 2014, 37(2):63–72. doi: 10.1097/CJI.0000000000000011.
[19] Yang XJ, Chen GL, Yu SC, et al. TGF-β1 enhances tumor-induced angiogenesis via JNK pathway and macrophage infiltration in an improved zebrafish embryo/xenograft glioma model[J].Int Immunopharmacol, 2013, 15(2):191–198. doi: 10.1016/j.intimp.2012.12.002.
[20] O'Mahony CA, Albo D, Tuszynski GP, et al. Transforming growth factor-beta 1 inhibits generation of angiostatin by human pancreatic cancer cells[J]. Surgery, 1998, 124(2):388–393.
[21] Chen Y, Ma L, He Q, et al. TGF-β1 expression is associated with invasion and metastasis of intrahepatic cholangiocarcinoma[J]. Biol Res, 2015, 48:26. doi: 10.1186/s40659–015–0016–9.
[22] 李新峰, 符亚辉, 吴林波, 等. 化疗栓塞术对中晚期肝癌患者血清TGF-β1、bFGF和VEGF的影响[J]. 实用临床医药杂志, 2016,20(9):54–56. doi:10.7619/jcmp.201609015.Li XF, Fu YH, Wu LB, et al. Influence of transcatheter arterial chemoembolization on serum TGF-β1, bFGF and VEGF levels of patients with advanced liver cancer[J]. Journal of Clinical Medicine in Practice, 2016, 20(9):54–56. doi:10.7619/jcmp.201609015.
[23] 赵永昌, 陈士新, 刘亚民, 等. 经肝动脉介入化疗栓塞治疗对原发性肝癌患者免疫功能的影响[J]. 实用癌症杂志, 2017,32(8):1273–1275. doi:10.3969/j.issn.1001–5930.2017.08.016.Zhao YC, Chen SX, Liu YM, et al. Effects of Transcatheter Arterial Chemoembolization on Immune Function in Patients with Primary Liver Cancer[J]. The Practical Journal of Cancer, 2017, 32(8):1273–1275. doi:10.3969/j.issn.1001–5930.2017.08.016.
[24] Lin TH, Shao YY, Chan SY, et al. High Serum Transforming Growth Factor-β1 Levels Predict Outcome in Hepatocellular Carcinoma Patients Treated with Sorafenib[J]. Clin Cancer Res,2015, 21(16):3678–3684. doi: 10.1158/1078–0432.CCR-14–1954.
[25] 刘昭明, 李祯, 许丙辉, 等. 老年肝癌肝切除术后E-钙黏蛋白、血管内皮生长因子、胰岛素原生长因子II、转化生长因子β1水平对预后的评估价值[J]. 中国老年学杂志, 2016, 36(16):4010–4012.doi:10.3969/j.issn.1005–9202.2016.16.066.Liu ZM, Li Z, Xu BH, et al. Prognostic value of levels of E-cadherin,vascular endothelial growth factor, insulin like growth factor II and transforming growth factor β1 in old liver cancer patients after hepatectomy[J]. Chinese Journal of Gerontology 2016,36(16):4010–4012. doi:10.3969/j.issn.1005–9202.2016.16.066.
