选择性COX-2抑制剂在开腹肝脏术后镇痛的应用
2018-03-22陈美婷金保裴丽坚朱波迟天毅徐海峰郑永昌徐意瑶赵海涛杜顺达卢欣毛一雷桑新亭黄宇光
陈美婷,金保,裴丽坚,朱波,迟天毅,徐海峰,郑永昌,徐意瑶,赵海涛,杜顺达,卢欣,毛一雷,桑新亭,黄宇光
(中国医学科学院北京协和医学院北京协和医院 1. 肝脏外科 2. 麻醉科,北京 100730)
术后疼痛是患者术后最关心的问题之一,影响着患者的生活质量和快速康复。急性术后疼痛是一般术后即刻发生,持续时间一般<7 d,若处理不当会转化为慢性术后疼痛(chronic postsurgical pain,CPSP),即术后8周以上仍存在手术相关性疼痛且除外其他病因所致的疼痛[1]。CPSP的发生,除与年龄、性别、麻醉方式相关外,还与切口大小、手术类型、术后重度疼痛持续时间长[2]等相关,发生风险约5%~50%[3]。
开腹肝脏手术一般切口较大,术后疼痛剧烈[4]。临床上常用阿片类药物或非甾体抗炎药(nonsteroid anti-inflammatory drugs,NSAID)进行镇痛。单一阿片类药物副作用较大,合用NSAID药物虽可降低阿片类药物用量,但因其抑制环氧合酶(cyclooxygenase,COX)会导致胃肠道不良反应、抑制血小板聚集等副作用。选择性环氧合酶2(COX-2)抑制剂与阿片类药物联合用药,可以增加阿片类药物的敏感性,从而减少其用量及副作用[5–7]。在腹腔镜胆囊切除等腹部手术中可促快速康复[7],但在开腹肝脏术后镇痛疗效及康复情况如何?笔者将开腹肝血管瘤切除患者随机分组,比较单用阿片类药物和阿片类药物联合帕瑞昔布术后镇痛及康复情况差异,旨在探讨探讨选择性COX-2抑制剂帕瑞昔布钠在开腹肝脏术后镇痛的应用效果。
1 资料与方法
1.1 研究对象
选取2014年9月—2016年12月就诊于北京协和医院肝脏外科的肝脏血管瘤患者,其入选标准为:年龄20~70岁,无慢性疼痛史、长期服用镇痛药物史和药物酒精滥用史,无非甾体抗炎药、阿片类药、磺胺类药物过敏;排除标准为合并有活动性消化道溃疡、胃肠道出血、炎性肠病,术前1周内使用过镇痛药物或非甾体类抗炎药物及术前存在疼痛病史。本研究经过北京协和医院伦理委员会批准(伦理审批编号S-685),术前与患者签署知情同意书。
1.2 分组与镇痛方法
通过计算机SPSS软件获得随机码,将56例患者被随机分为对照组和观察组,对照组行静脉患者自控镇痛(patient-control analgesia,PCA),观察组行静脉PCA+帕瑞昔布钠。对照组麻醉前静脉给生理盐水2 mL,手术结束准备关腹前接镇痛泵,舒芬太尼浓度1 µg/mL。镇痛泵设置:⑴ 没有背景量;⑵ 2 mL/次;⑶ 锁定时间5 min,1 h限量10 mL。术后生理盐水1 mL 1次/12 h,共72 h。观察组的PCA配泵方法同对照组,麻醉前给帕瑞昔布钠40 mg 1次,术后静脉注射帕瑞昔布钠40 mg,1次/12 h,共72 h。
随机分组后,患者并不被告知分组情况。因为临床工作的特殊性,配置药物的护士必须知道是安慰剂(生理盐水)还是药物(帕瑞昔布钠),药物及安慰剂均溶于2 mL生理盐水。在配置药物护士的监督下由另一护士执行,执行护士采用盲法。相关信息的采集者对所有患者进行信息采集,但并不被告知患者分组。因此患者、执行护士、信息采集者3方均采用盲法。
1.3 研究方法
1.3.1 术前准备 所有患者术前检测肝肾功能、血氨、炎症指标,炎症指标包括血沉(ESR)、超敏C反应蛋白(hsCRP),行B超检测门静脉流速。术前1 d由专业医务人员指导患者掌握视觉模拟评分(VAS评分)的评分标准,学习并掌握PCA泵的使用方法。
1.3.2 麻醉方式及术中观察 对照组予2 mL生理盐水后进行全身麻醉,麻醉常规诱导:丙泊酚2 mg/kg,芬太尼 0.1~0.3 µg/kg,罗库溴铵 0.6 mg/kg,咪达唑仑1~2 mg。麻醉维持:术中持续监测脑电双频指数(bispectral index,BIS),调整舒芬太尼+七氟烷+50%O2+50%N2O+罗库溴铵维持BIS于40~60之间,必要时可泵入小剂量瑞芬太尼,维持心率、血压于术前±30%范围内;术毕准备关腹时接镇痛泵(具体方案同前)。观察组麻醉前不给予生理盐水而给予帕瑞昔布钠40 mg,其余同对照组。所有患者选取右肋缘下切口,行右肝血管瘤剥除或联合肝段切除术。记录手术相关信息:手术时间、切除肝段数、出血量、肝门阻断时间及肝拉钩持续时间。
1.3.3 术后观察 ⑴ 镇痛方式:对照组患者术后给予PCA镇痛泵,手术当日晚9点开始给予生理盐水2 mL,1次/12 h,共72 h。观察组除与对照组用相同的PCA镇痛泵外,手术当日晚9点开始给予帕瑞昔布钠40 mg,1次/12 h,共72 h;记录术后6、18、30、42、54、66 h的静息及活动VAS评分、PCA剂量。若患者出现VAS>6分,通过增加PCA自控无法缓解,可给予哌替啶50 mg肌肉注射进行疼痛补救,将哌替啶用量换算为阿片类药物用量。⑵ 术后42、66 h测量肝肾功及炎症指标,术后第3天复查B超检测门静脉流速,并记录患者的下地、排气时间及相关不良反应,包括恶心、呕吐的次数。患者出院后统计此次住院的镇痛药物、肠外营养费用及住院总费用。
1.4 统计学处理
本研究中采用SPSS 19.0软件对数据进行分析,正态分布的计量资料用平均值±标准差(±s)表示,组间比较采用t检验,多个相关样本比较用Friedman秩和检验;计数资料用频数表示,组间比较采用χ2分析。P<0.05为差异有统计学意义。
2 结 果
2.1 基本情况
两组患者年龄、性别、体质量指数(BMI)、手术史、饮酒史、入院后血生化检查、红细胞沉降率(ESR)、超敏C反应蛋白(hsCRP)、门静脉流速等之间差异均无统计学意义(均P>0.05)。观察组行联合肝段切除6例,对照组行联合肝段切除15例,余为单纯血管瘤剥除术,两组患者在手术时间、出血量、肝门阻断时间和肝拉钩持续时间等均统计学差异(均P>0.05)(表1)。
2.2 术后血清学和影像学指标
患者术后42 h 观察组和对照组血氨分别为(39.5±13.9)µmol/L、(38.7±10.6)µmol/L,66 h两组血氨分别为(32.7±13.2)µmol/L、(37.7±11.8)µmol/L,两组术后42、66 h测量值之间组内比较、组间比较以及与术前比较均无统计学差异(均P>0.05)。术后42、66 h,观察组ESR分别为(27.12±15.63)mm/h、(38.44±19.39)mm/h,对照组分别为(21.31±13.09)mm/h和(38.23±23.85)mm/h;观察组h s C R P分别为(8 9.5 2±4 6.7 9)m g/L、(1 0 9.2 5±5 6.0 5)m g/L,对照组分别为(110.59±50.66)mg/L、(116.09±59.42)mg/L,均较术前明显升高(P=0.001),但两组间术后42、66 h的ESR与hsCRP均无统计学差异(均P>0.05)。术后3 d的门静脉流速,在对照组为(23.6±11.0)cm/s,观察组为(27.0±6.4)cm/s,与术前比较均无统计学差异(均P>0.05),两组间差异亦无统计学意义(P=0.282)(表2)。
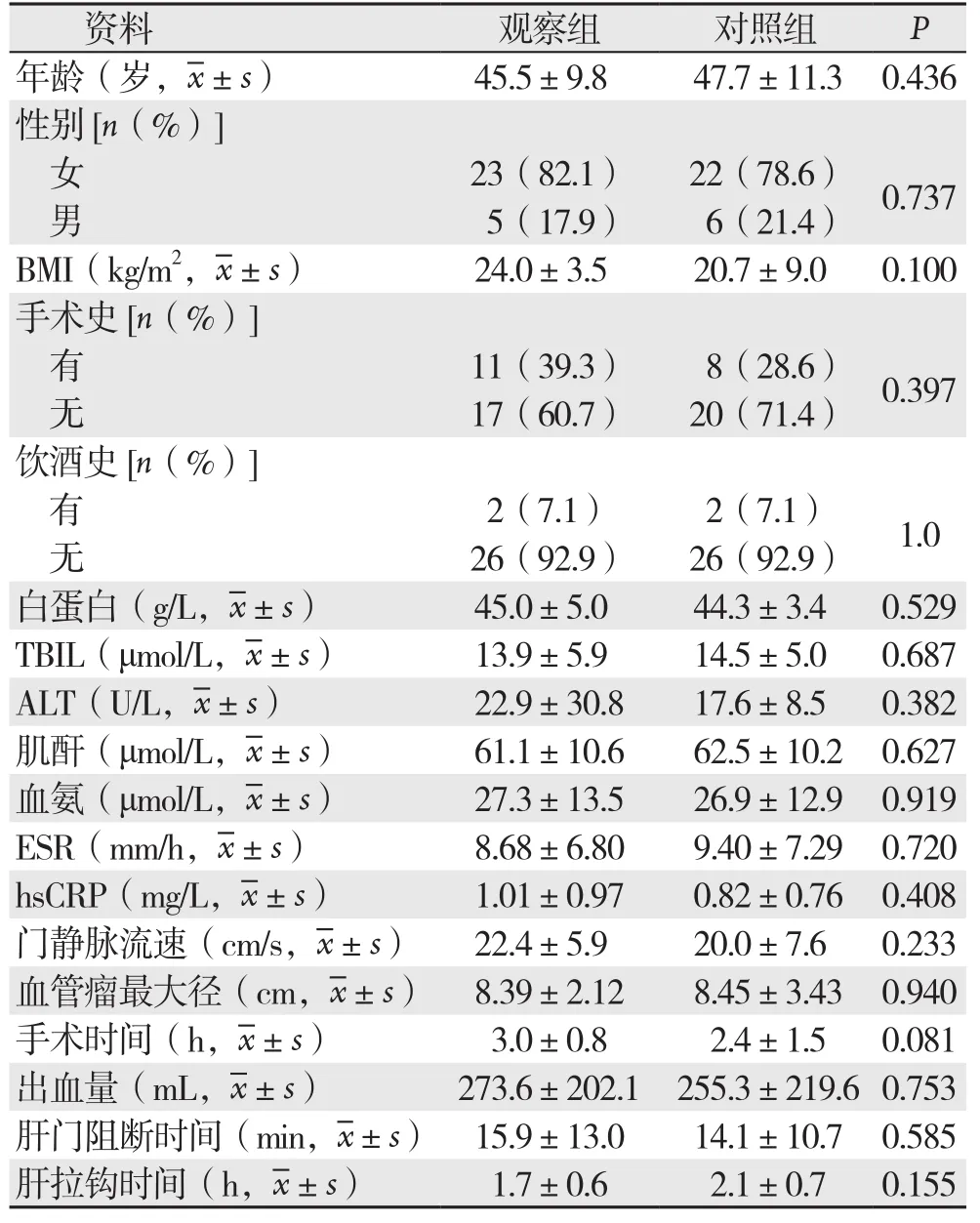
表1 入选患者基本资料与术中情况(n=28)Table 1 Baseline data and intraoperative variables of the patients (n=28)
表2 观察组与对照组术后血清学指标及门静脉流速比较(n=28,±s)Table 2 Comparison of the postoperative serum indexes and portal vain velocities between observation group and control group (n=28, ±s)

表2 观察组与对照组术后血清学指标及门静脉流速比较(n=28,±s)Table 2 Comparison of the postoperative serum indexes and portal vain velocities between observation group and control group (n=28, ±s)
指标 观察组 对照组 P血氨(μmol/L)术后42 h 39.5±13.9 38.7±10.6 0.813术后66 h 32.7±13.2 37.7±11.8 0.214 ESR(mm/h)术后42 h 27.12±15.63 21.31±13.09 0.078术后66 h 38.44±19.39 38.23±23.85 0.970 hsCRP(mg/L)术后42 h 89.52±46.79 110.59±50.66 0.713术后66 h 109.25±56.05 116.09±59.42 0.728术后门静脉流速(cm/s) 27.0±6.4 23.6±11.0 0.282
2.3 镇痛效果
术后镇痛效果方面,观察组术后VAS评分均低于对照组,术后多个时间点的测量有统计学差异(均P<0.05),具体时间点的组间比较发现,术后第1、2天(30、42 h)静息及活动后VAS评分有统计学差异(30 h,P=0.025及0.026,42 h,P=0.026及0.038),及术后第3天(54 h)静息时疼痛评分明显降低(P=0.003)(图1)。而在镇痛药的用量方面,观察组较对照组降低,术后第3天(54 h)的总镇痛药物剂量观察组明显减少(P=0.010)。一些患者因为镇痛不满意,予疼痛补救,观察组共5例需要疼痛补救,对照组为17例,疼痛补救例数观察组明显减少(P=0.001)(图2)。
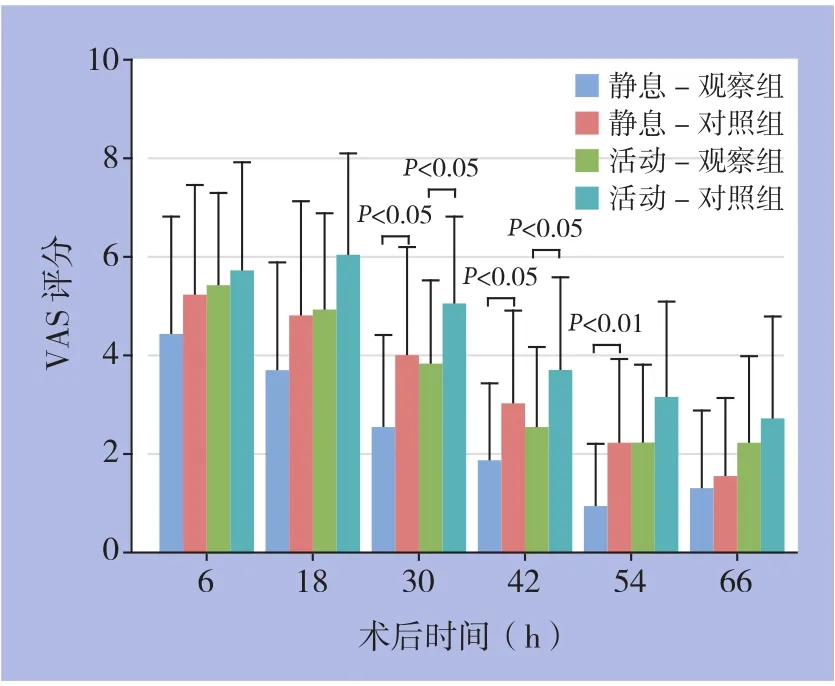
图1 观察组及对照组术后不同时间点的静息及活动VAS评分Figure 1 Resting and exertion pain VAS scores of observation group and control group at different postoperative time points

图2 观察组及对照组镇痛药用量(镇痛药量将补救用量按照舒芬太尼等效剂量换算)Figure 2 Doses of sufentanil used in observation group and control group (dose of the analgesics used for additional pain relief converted to the equivalent dose of sufentanil)
2.4 术后恢复及不良反应情况
观察组术后出现恶心13例(46.4%),对照组为1 8例(6 4.3%);观察组发生呕吐5例(17.8%),对照组则为13例(46.4%);与对照组比较,观察组术后恶心、呕吐等不良反应减少,其中呕吐发生率差异有统计学意义(P=0.022)。观察组与对照组术后下地时间、排气时间均无统计学差异(均P>0.05)(表3)。

表3 术后恢复及不良反应情况比较(n=28)Table 3 Comparison for postoperative recovery variables and adverse reactions (n=28)
2.5 治疗费用
不考虑术前费用,观察组和对照组术后住院总费用分别为(29 267.9±6 782.6)元和(32 927.0±8 979.9)元,两组间差异无统计学意义(P=0.094)。
3 讨 论
开腹手术后疼痛较为剧烈,镇痛方式以多模式镇痛为主。多模式镇痛包括阿片类药物、NSAID、对乙酰氨基酚及伤口周围局部神经阻滞等[2],可较好地改善疼痛,并促术后快速康复。阿片类药物是其中重要组成部分,起到了很好的镇痛效果,但恶心、呕吐、瘙痒、尿潴留、便秘、呼吸抑制等副作用常有发生[8]。选择性COX-2抑制剂可以降低阿片类用量并减少非选择性NSAID的副作用[5–10],尤其是血小板抑制和胃肠道反应,可用于术后轻、中度疼痛的镇痛,或作为多模式镇痛的一部分在术前、术后使用[11]。近年来,一些随机对照研究已经证实了选择性COX-2抑制剂的在介入、口腔及泌尿系等手术方面的镇痛效果[5,9–12]。Shengping等[7]将180例行腹腔镜胆囊切除术的患者随机分组,比较帕瑞昔布及安慰剂术后8~24 h的VAS评分及镇痛药物用量,发现帕瑞昔布组VAS评分、阿片类药物用量及疼痛补救均较对照组显著降低。而在疼痛程度更高的膝关节置换术疼痛管理中,Sarridou等[13]也得到了相似的结论,帕瑞昔布可显著降低术后疼痛,并可减少吗啡相关的不良反应、促进术后康复。但有关帕瑞昔布在开腹肝脏术后镇痛效果的研究及可能的机制却并未见报道。本研究是一项前瞻性随机对照研究,在国内首次评估了帕瑞昔布钠在开腹肝脏术后的镇痛效果。
在药物安全性方面,本研究首先检验了帕瑞昔布钠对肝功能的损害情况,结果发现两组患者术后肝血氨水平均无明显变化。这提示对于术前肝功能正常的患者,应用帕瑞昔布钠是安全的,并不会增加肝功能损伤。
研究[14]提示,适当升高的门静脉压力,会促使肝细胞的再生;但是,过高的门静脉压力,会导致肝细胞的衰亡。选择性COX-2抑制剂可抑制血管内皮的前列环素,促进血管收缩。选择性COX-2抑制剂是否会增加术后门静脉压力,并没有相关报道。门静脉流速与门静脉压力存在一定相关性[15],本研究选择门静脉流速来间接反映门静脉压力。结果发现观察组和对照组术后门静脉流速并无明显差异,提示帕瑞昔布钠的使用,并没有显著收缩门静脉、额外增加门静脉压力。
帕瑞昔布钠因为选择性抑制COX-2,所以能起到镇痛的作用;另外,通过降低中枢前列腺素水平以抑制中枢神经敏化的作用[16],可以增加阿片类药物的敏感性,降低阿片类药物的剂量。本研究提示,作为多模式镇痛之一,帕瑞昔布钠确实缓解了开腹肝脏手术后患者的疼痛。观察组在术后活动及静息的VAS评分较对照组下降,并且在术后第1、2天的VAS评分有统计学差异。另外,两组术后第3天阿片类药物的使用量上,观察组明显减少。这提示帕瑞昔布联合阿片类药物应用可以增加阿片类药物的镇痛效果,缓解患者术后的疼痛;同时,也降低了阿片类药物的使用。
文献[8]报道阿片类术后恶心及呕吐发生率高达25%~36%。本研究中,对照组仅使用阿片类药物镇痛,术后发生恶心、呕吐的比例分别为64.3%、46.4%,观察组联合使用帕瑞昔布钠,恶心、呕吐发生比例降为46.4%、17.8%,较单独阿片类镇痛下降明显。另外,帕瑞昔布钠的使用,在一定程度上降低了阿片类药物肠道抑制的副作用,观察组术后平均排气时间为53.2 h,较对照组的61.6 h提前,不过,可能影响排气的因素较多,同时本研究例数较少,并未有统计学差异。
研究[16]提示,术后疼痛与手术创伤刺激脊髓背根痛觉神经元及局部组织释放炎症因子密切相关。ESR和CRP是临床应用较多的炎症指标,可反映患者全身炎症反应情况。本研究发现两组患者术后ESR及CRP均较术前增加,但并没有明显差异,提示开腹肝脏手术造成了全身较为严重的炎症反应。本研究发现术后观察组较对照组的ESR及CRP有所降低,但无统计学差异,提示帕瑞昔布钠可能降低了炎症反应。这种炎症反应的降低,可能参与了选择性COX-2抑制剂的镇痛机制[16–17]。类似的,在急性或慢性疼痛患者血清或组织液中,发现促炎细胞因子升高[18–19];镇痛药物治疗后促炎细胞因子下降[20]。本研究后续将检测相关的细胞因子,以研究帕瑞昔布镇痛在分子水平的机制。
帕瑞昔布钠相对于阿片类药物价格较高。本研究结果提示,麻醉诱导前以及术后3 d,每天2支帕瑞昔布钠的应用,并不显著增加患者的总住院费用。相反,在对照组,因疼痛补救而使用的阿片类药物明显增加,相应的费用虽然较少,也比观察组增加。
综上所述,对于一般开腹肝脏手术患者,联合使用帕瑞昔布钠是安全的;并且可以明显改善患者术后活动及静息时的疼痛,减少阿片类药物用量及疼痛补救,也减少阿片类药物引起的副作用。另外,联合镇痛在促进术后恢复的同时,并不增加患者的住院费用。因此,帕瑞昔布钠联合阿片类药物应用于开腹肝脏手术患者,是一项安全、有效、经济的镇痛措施。
志谢:感谢辉瑞制药有限公司对本研究资助。
[1] Haroutiunian S, Nikolajsen L, Finnerup N B, et al. The neuropathic component in persistent postsurgical pain: a systematic literature review[J]. Pain, 2013, 154(1):95–102. doi: 10.1016/j.pain.2012.09.010.
[2] 中华医学会麻醉学分会. 成人术后疼痛处理专家共识[J]. 临床麻醉学杂志, 2010, 26(3):190–196.Society of Anesthesiology of Chinese Medical Association. Expert consensus on postoperative pain management in adults[J]. Journal of Clinical Anesthesiology, 2010, 26(3):190–196.
[3] Reddi D, Curran N. Chronic pain after surgery: pathophysiology,risk factors and prevention[J]. Postgrad Med J, 2014, 90(1062):222–227. doi: 10.1136/postgradmedj-2013–132215.
[4] 张翼, 罗洪亮, 吴华俊, 等. 模式化与传统腹腔镜肝左外叶切除术的临床对比研究[J]. 中国普通外科杂志, 2017, 26(1):77–82.doi:10.3978/j.issn.1005–6947.2017.01.013.Zhang Y, Luo HL, Wu HJ, et al. Stylized versus traditional laparoscopic left lateral hepatic lobectomy: a clinical comparative study[J]. Chinese Journal of General Surgery, 2017, 26(1):77–82.doi:10.3978/j.issn.1005–6947.2017.01.013.
[5] Lv N, Kong Y, Mu L, et al. Effect of perioperative parecoxib sodium on postoperative pain control for transcatheter arterial chemoembolization for inoperable hepatocellular carcinoma: a prospective randomized trial[J]. Eur Radiol, 2016, 26(10):3492–3499. doi: 10.1007/s00330–016–4207–8.
[6] Schug SA, Joshi GP, Camu F, et al. Cardiovascular safety of the cyclooxygenase-2 selective inhibitors parecoxib and valdecoxib in the postoperative setting: an analysis of integrated data[J]. Anesth Analg, 2009, 108(1):299–307. doi: 10.1213/ane.0b013e31818ca3ac.
[7] Lin S, Hua J, Xu B, et al. Comparison of bupivacaine and parecoxib for postoperative pain relief after laparoscopic cholecystectomy:a randomized controlled trial[J].Int J Clin Exp Med, 2015,8(8):13824–13829.
[8] Arshad Z, Prakash R, Gautam S, et al. Comparison between Transdermal Buprenorphine and Transdermal Fentanyl for Postoperative Pain Relief after Major Abdominal Surgeries[J].J Clin Diagn Res, 2015, 9(12):UC01–04. doi: 10.7860/JCDR/2015/16327.6917.
[9] Cillo JE Jr, Dattilo DJ. Pre-emptive analgesia with pregabalin and celecoxib decreases postsurgical pain following maxillomandibular advancement surgery: a randomized controlled clinical trial[J].J Oral Maxillofac Surg, 2014, 72(10):1909–1914. doi: 10.1016/j.joms.2014.05.014.
[10] Mehta A, Hsiao W, King P, et al. Perioperative celecoxib decreases opioid use in patients undergoing testicular surgery: a randomized,double-blind, placebo controlled trial[J]. J Urol, 2013, 190(5):1834–1838. doi: 10.1016/j.juro.2013.04.058.
[11] Pipanmekaporn T, Punjasawadwong Y, Charuluxananan S, et al.The Effectiveness of Intravenous Parecoxib on the Incidence of Ipsilateral Shoulder Pain After Thoracotomy: A Randomized,Double-Blind, Placebo-Controlled Trial[J]. J Cardiothorac Vasc Anesth, 2017, pii: S1053–0770(17)30526–8. doi: 10.1053/j.jvca.2017.05.048.
[12] 金亮, 蔡飞, 李琪, 等. 肝血管瘤患者瘤体剥除与介入栓塞术后生存质量对比评价[J]. 中国普通外科杂志, 2016, 25(1):103–108.doi:10.3978/j.issn.1005–6947.2016.01.016.Jin L, Cai F, Li Q, et al. Comparison of quality of life in patients with liver hemangioma after enucleation and transcatheter arterial embolization[J]. Chinese Journal of General Surgery, 2016,25(1):103–108. doi:10.3978/j.issn.1005–6947.2016.01.016.
[13] Sarridou DG, Chalmouki G, Braoudaki M, et al. Intravenous parecoxib and continuous femoral block for postoperative analgesia after total knee arthroplasty. A randomized, double-blind,prospective trial[J]. Pain Physician, 2015, 18(3):267–276.
[14] Urdaneta A, Siso A, Urdaneta B, et al. Lack of correlation between the central anti-nociceptive and peripheral anti-in fl ammatory effects of selective COX-2 inhibitor parecoxib[J]. Brain Res Bull, 2009,80(1/2):56–61. doi: 10.1016/j.brainresbull.2009.05.009.
[15] 谭友文, 於学军, 殷玉梅. 肝硬化门静脉高压门脉血流动力学检测及其临床意义[J]. 中华超声影像学杂志, 2001, 10(3):151–153.Tan YW, Yu XJ, Yin YM. Clinical significance examining the portal system hemodynamics of po rtal hypertension in patients with cirrhosis by color Doppler ultrasound[J]. Chinese Journal of Ultrasonography, 2001, 10(3):151–153.
[16] Wu Q, Purusram G, Wang H, et al. The efficacy of parecoxib on systemic in fl ammatory response associated with cardiopulmonary bypass during cardiac surgery[J]. Br J Clin Pharmacol, 2013,75(3):769–778. doi: 10.1111/j.1365–2125.2012.04393.x.
[17] Kaminska B, Mota M, Pizzi M. Signal transduction and epigenetic mechanisms in the control of microglia activation during neuroin fl ammation[J]. Biochim Biophys Acta, 2016, 1862(3):339–351. doi: 10.1016/j.bbadis.2015.10.026.
[18] 郑小林, 李明杰, 郑英键, 等. 单侧入肝血流联合肝静脉阻断在复杂肝切除中的应用[J]. 中国普通外科杂志, 2010, 19(7):779–782.Zheng XL, Li MJ, Zheng YJ, et al. Application of combined hemihepatic infow and hepatic veins occlusion in major hepatectomy[J]. Chinese Journal of General Surgery, 2010,19(7):779–782.
[19] Chen MT, Jin B, Du SD, et al. Role of a selective cyclooxygenase-2 inhibitor on pain and enhanced recovery after open hepatectomy: a randomized controlled trial [J]. Transl Cancer Res, 2017, 6(4):806–814. doi: 10.21037/tcr.2017.08.17.
[20] Richebé P, Julien M, Brulotte V. Potential strategies for preventing chronic postoperative pain: a practical approach: Continuing Professional Development[J]. Can J Anaesth, 2015, 62(12):1329–1341. doi: 10.1007/s12630–015–0499–4.
