喉癌相关基因的生物信息学分析及真核表达载体的构建
2018-03-22,,
, ,
(1.南华大学医学院肿瘤研究所,肿瘤细胞与分子病理学湖南省重点实验室,湖南 衡阳 421001;2.郴州市第一人民医院病理科)
喉癌相关基因(Laryngeal cancer related gene,LCRG1)是课题组前期采用mRNA差异显示和cDNA文库筛选技术克隆的一个新基因(GenBank:AF268387)[1-3]。LCRG1由6个外显子[1,4]和8个内含子组成[2],编码一个具有288个氨基酸残基并含蛋白激酶C磷酸化位点的蛋白质,且与已知蛋白质无显著同源性[1]。LCRG1定位于参与喉癌最常见的杂合性缺失(Loss of heterozygosity,LOH)区域的抑瘤基因所在的17q12~21.1染色体上, D17s800~D17s930位点之间[1]。在40%的原发性喉癌组织中LCRG1表达缺失或下调[3-4],能抑制喉癌细胞的生长,增殖以及肿瘤形成[1]。目前国内外尚无LCRG1单克隆抗体,本研究利用生物信息学预测LCRG1的蛋白二级结构及抗原表位,拟构建LCRG1真核表达载体,并使其在HEK293细胞中获得表达,进而纯化LCRG1蛋白,能为制备单克隆抗体奠定基础。
1 材料与方法
1.1生物信息学分析
1.1.1 喉癌相关基因的蛋白氨基酸序列 人LCRG1蛋白的氨基酸序列(由基因组序列推导)共有288个氨基酸残基,检索自GenBank NO.AF268387,见图1。
MARLVAVCRDGEEEFPFERRQIPLYIDDTL
TMVMEFPDNVLNLDGHQNngAQLKQFIQRH
GMLKQQDLSIAMVVTSREVLSALSQLVPCV
GCRRSVERLFSQLVESGNPALEPLTVGPKG
VLSVTRSCMTDAKKLYTLFYVHGSKLNDMI
DAIPKSKKNKRCQLHSLDTHKPKPLGGCWM
DVWELMSQECRDEVVLIDSSCLLETLETYL
RKHRFCTDCKNKVLRAYNILIGELDCSKEK
GYCAALYEGLRCCPHERHIHVCCETDFIAH
LLGRAEPEFAGGYEYVIC
图1人LCRG1蛋白的氨基酸序列
1.1.2 喉癌相关基因的蛋白二级结构预测 采用Garnier-Robson,Chou-Fasman和Karplus-Schultz方法预测蛋白质的二级结构。所有计算由DNAstar软件包中的Protean程序完成。
1.1.3 喉癌相关基因的蛋白抗原表位预测 以7个氨基酸残基为一组,按Kyte-Doolittle的氨基酸亲水性标准和Hopp&Woods方法,分别预测其亲水性;按Emini方法预测蛋白质的表面可能性;按Jameson-Wolf方法预测抗原性指数。所有计算由DNAstar软件包中的Protean程序完成。
1.2 V152H-LCRG1质粒的构建
1.2.1 设计用于喉癌相关基因和载体V152H的引物
引物送苏州金唯智生物科技有限公司合成,LCRG1-F:ATAGCTAGCAATGGCGCGACTCGTGGCA,LCRG1-R:CGGGATCCGCAAATTACATACTCATACCCTCCTGC,V152H-F: TGATCAAGCTTCTGCCTGC,V152H-R:CATTACTTGTCATCGTCGTCCTTG。
1.2.2 喉癌相关基因片段的扩增 以正常喉黏膜cDNA为模板,通过PCR克隆LCRG1基因序列。在0.2 mL无酶EP管中依次加入10×Pfu Buffer(含有 Mg2+)5 μL, 2.5 mmol/L dNTP混合液4 μL,LCRG1-F/R,V152H-F/R引物各1 μL,模板DNA 0.2 μL,Pfu 1 μL,ddH2O 35.8 μL,PCR反应体积共50 μL。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,共30个循环。PCR产物经1%琼脂糖凝胶电泳并拍照记录。
1.2.3 PCR产物纯化 (1)向盛放目标胶块的离心管中加入400 μL Buffer DE-A,混合均匀后于75 ℃加热,间断混合,直至凝胶块完全熔化。(2)加入200 μLBuffer DE-B,混合均匀。(3)将第二步形成的混合液转移到DNA制备管,并置于2mL离心管。12 000 rpm,离心1 min,弃滤液。(4)将制备管放回2 mL离心管,加500 μL Buffer W1,12 000 rpm,离心30 s,弃滤液。(5)将制备管继续放回2 mL离心管,加700 μL Buffer W2,12 000 rpm离心30 s,弃滤液。以同样的方法再加入700 μL Buffer W2洗涤一次,12 000 rpm,离心1 min,弃滤液。(6)将制备管置回2 mL离心管中,12 000 rpm,离心2 min。⑺将制备管放入1.5 mL离心管中,在制备膜中央加入25 μL预热的65 ℃的无菌去离子水,室温静置1 min。最后,12 000 rpm,离心1 min,洗脱DNA。
1.2.4 双酶切目的基因和载体 NheI和BamHⅠ酶切(同时取1μg V152H载体质粒同步酶切),使用Fermentas公司的快酶。 酶切体系如下:10×FD Buffer 5μL,NheI 1.5 μL,BamHⅠ1.5 μL,37 ℃酶切2 h,LCRG1回收产物400 ng,无菌水补足50 μL;10×FD Buffer 5 μL,NheI 1μL,BamHⅠ 1 μL,37 ℃酶切2 h,V152H 1 μg,无菌水补足50 μL。
1.2.5 Axygen PCR清洁试剂盒回收酶切产物 (1)在酶切反应液中,加入150 μL的Buffer PCR-A,混匀后,转移到制备管中,将制备管置于2 mL离心管中,12 000 rpm,离心1 min,弃滤液。(2)依次将制备管放回2 mL离心管中,并分别加700 μL Buffer W2和400 μL Buffer W2,12 000 rpm,离心1 min,弃滤液。(3)最后将制备管置于洁净的1.5 mL离心管中,在制备管膜中央加入25 μL预热65 ℃的ddH2O,室温静置1 min,12 000 rpm,离心1 min,洗脱DNA。
1.2.6 目的基因片段与载体的连接、转化及鉴定 (1)目的基因与载体体积按5∶1混合,在10 μL反应体系中,20 ℃连接2 h。(2)取5μL连接产物与60 μL TOP10感受态细胞混匀,置于冰上冰浴30 min。(3)42 ℃热冲击90 s,立即冰上放置2 min。(4)超净台内加入500 μL无抗性的LB培养液,37 ℃、180 rpm摇床孵育1 h。(5)1 h后涂Amp抗性LB平板,37 ℃培养箱培养过夜。(6)挑取转化板的单克隆,置于10 μL无菌水中重悬,取1 μL菌液作模板,应用引物V152F/R进行PCR鉴定。并将重组质粒命名为V152H-LCRG1。
1.3 V152H-LCRG1转染真核细胞与表达鉴定(1)制备密度>1×108个/mL的人胚肾HEK293细胞悬液备用。(2)用稀释液将100 μg质粒稀释至1 mL,轻轻混匀。(3)用稀释液稀释200 μL LipofectamineTM2000至终体积为1 mL,轻轻混匀,室温放置5 min。(4)将第二步与第三步的液体混合,并轻轻混匀,室温孵育30 min。(5)将第一步制备的HEK293细胞转移到500 mL摇瓶中,加入新鲜预热的 ExpressionMedium至终体积为98 mL。(6)加入2 mL孵育后的DNA-LipofectamineTM2000混合物,在含8%CO2浓度的37 ℃培养箱内,以125 rpm培养。(7)48 h后收集细胞培养物,SDS-PAGE电泳进行表达鉴定。
1.4喉癌相关基因的蛋白真核表达与纯化(1)在含8%CO2浓度的37℃培养箱内,以125 rpm培养HEK293细胞,并进行转染试验。(2)转染后7天,1200 rpm,离心5 min,收集细胞。(3)样品准备:4 ℃,离心收集表达上清。离心上清中加入binding buffer以调整样品的成分。0.45 μm滤膜处理,准备上样。(4)平衡:10个柱体积的binding buffer平衡镍柱。(5)上样:0.45 μm滤膜处理好的样品全部上样。(6)洗杂:20个柱体积binding buffer洗杂,直至无物质流出。(7)洗脱1:5个柱体积elution buffer洗脱,收集洗脱产物。(8)洗脱2:5个柱体积elution buffer洗脱,收集洗脱产物。(9)洗脱产物通过SDS-PAGE检测。(10)透析与浓缩:洗脱产物透析到PBS(pH7.4)溶液中,并浓缩。
2 结 果
2.1 Garnier-Robson、Chou-Fasman和Karplus-Schultz方法预测喉癌相关基因的蛋白二级结构本研究利用分子生物信息学中Garnier-Robson、Chou-Fasman方法共同预测人LCRG1的蛋白二级结构中α-螺旋结构,β-折叠结构,β-转角结构,用Garnier-Robson方法预测无规则卷曲结构(Chou-Fasman方法无该预测功能),Karplus-Schultz方法预测柔性区域,结果如表1所示。其中,α-螺旋结构和β-折叠结构与抗体较难嵌合,故不作为抗原表位。而β-转角结构和无规则卷曲结构是蛋白质中的柔性区域,一般出现在蛋白质抗原表位,能更好的与抗体嵌合,极可能成为抗原表位[5]。因此,本研究柔性区域预测结果(包括Garnier-Robson方法和Chou-Fasman方法预测的转角区域、Garnier-Robson方法预测的无规则卷曲区域、Karplus-Schultz方法预测的柔性区域)以及这些区域的邻近157,159区域都具有成为抗原表位的可能性。

表1 分子生物信息学预测的人LCRG1蛋白二级结构
G:Garnier-Robson 方法;C:Chou-Fasman方法;共:Garnier-Robson和Chou-Fasman两种方法所预测的相同区段;K:Karplus-Schultz方法预测
2.2 Kyte-Doolittle方法、Hopp&Woods方法、Emini方法和Jameson-Wolf方法预测喉癌相关基因的蛋白抗原表位以7个氨基酸残基为一组,按Kyte-Doolittle的氨基酸亲水性标准和Hopp&Woods方法,分别预测其亲水性;按Emini方法预测蛋白质的表面可能性;按Jameson-Wolf方法预测抗原性指数。结果如表2所示。综合抗原表位预测结果中亲水性指数,抗原指数,表面可能性指数均较高的区域有9-22,41-52,91-100,103-110,125-134,145-148,151-163,166-177,187-192,209-225,235-242,251-259,273-282等13个区域。

表2 LCRG1蛋白的抗原表位预测结果
K:Kyte-Doolittle方法;H:Hopp&Woods方法;共:Kyte-Doolittle和Hopp&Woods两种方法预测的相同区段;E:Emini方法;J:Jameson-Wolf方法
2.3喉癌相关基因的PCR扩增利用PCR,以正常喉黏膜cDNA为模板,扩增后得到约867 bp大小的目的条带。经1.0%琼脂糖凝胶电泳检测,结果如图2所示。
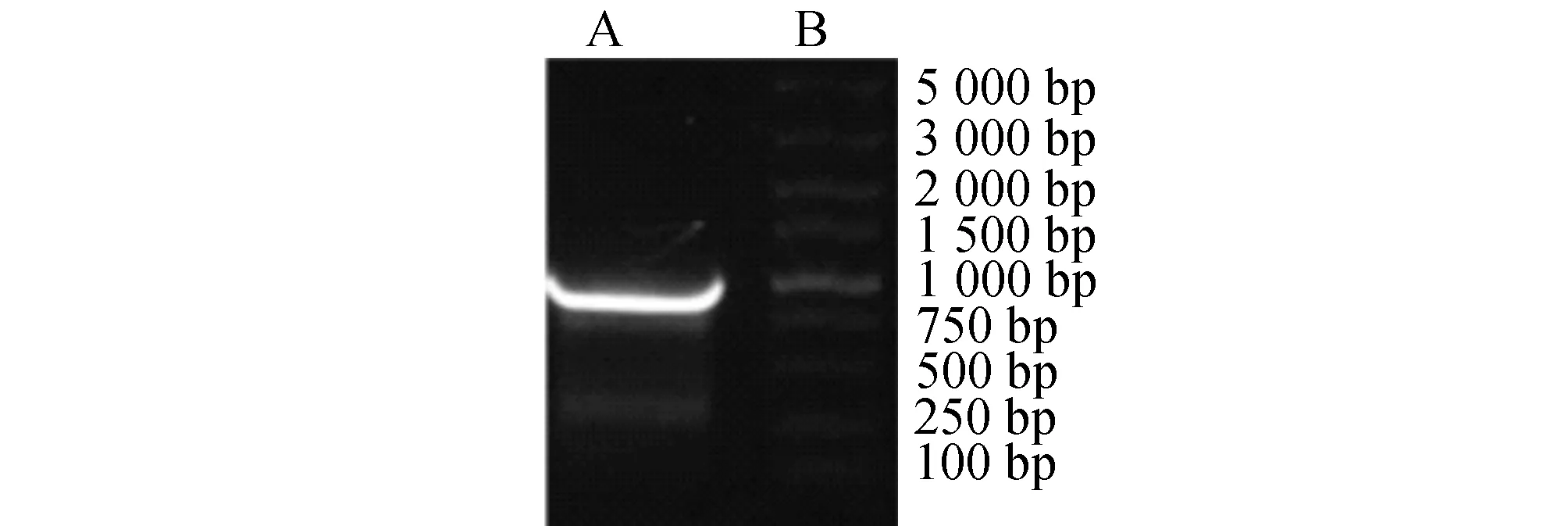
图2 以正常喉黏膜cDNA为模板的PCR产物A:PCR产物;B:PCR分子质量标准(DL5000)
2.4重组V152H-LCRG1质粒的构建将目的基因片段与载体进行连接,并转化到感受态细胞,再通过PCR鉴定得到阳性克隆,最后将验证正确的克隆送往金唯智生物科技有限公司进行测序,结果显示测序正确,如图3所示。
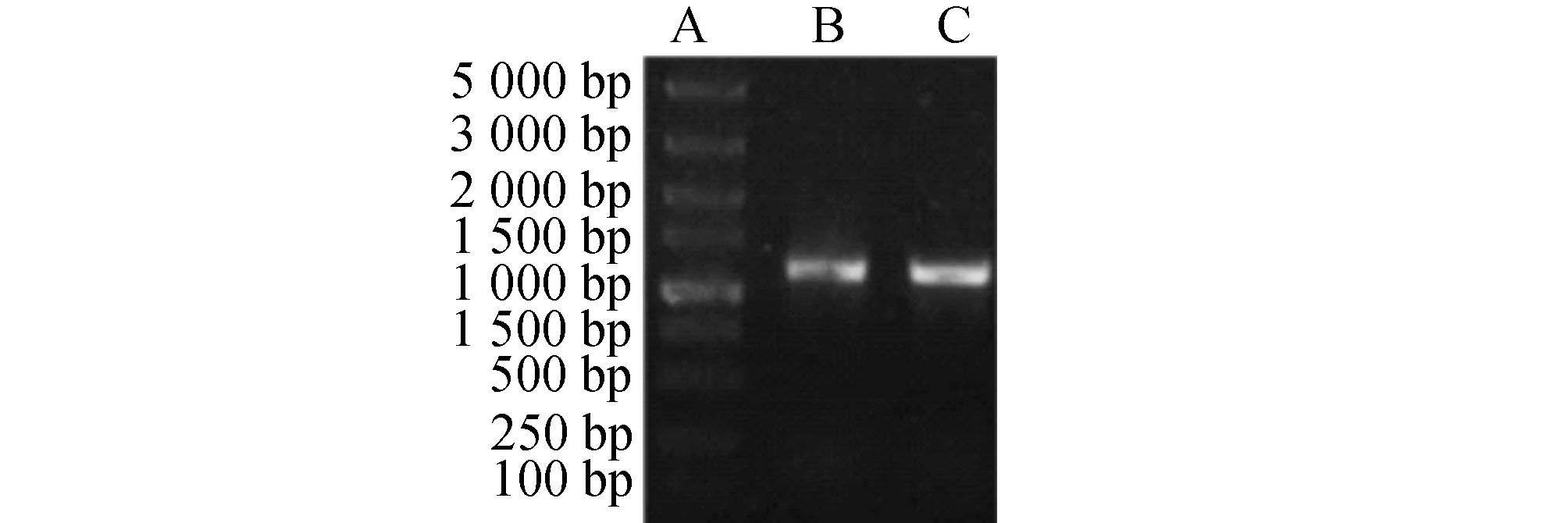
图3 V152H-LCRG1质粒构建PCR克隆验证及测序A:PCR分子质量标准(DL5000);B:重组V152H-LCRG1质粒PCR产物;C:验证测序条带
2.5喉癌相关基因的重组蛋白表达与纯化通过将LCRG1重组质粒V152H-LCRG1转染到人胚肾HEK293细胞获得真核表达,表达产物经Ni2+2NTA柱层析纯化,进而得到纯度>95%的目的蛋白,如图4所示。

图4 LCRG1重组蛋白的真核表达与纯化A:Marker;B;上样;C:洗杂;D:洗脱1;E:洗脱2.
3 讨 论
喉癌是常见的上呼吸道恶性肿瘤,在呼吸系统肿瘤中发病率仅次于鼻咽癌[6]。喉癌对放化疗敏感度低,早期喉癌患者可经一种或多种方案得到有效治疗,但大多数晚期患者因复发或转移而亡[2]。尽管近年来喉保留功能措施取得不少成就,但患者的长期生存率却未得到明显改善[6-7]。众所周知,喉癌的发生发展与癌基因、抑癌基因失衡有关[8]。但目前对喉癌发生发展的具体分子机制依然知之甚少。因此,探索喉癌相关基因的功能研究将为喉癌的靶向治疗开辟新途径。
喉癌相关基因是喉癌候选抑瘤基因,可以调节细胞的生长、分化、凋亡和肿瘤的形成,在喉癌组织中表达下调[3]。基因转录水平失调是肿瘤相关基因表达异常的常见机制之一[9]。课题组前期对LCRG1基因转录调控进行了相关研究,明确了LCRG1基因的核心启动子区域位于转录起始点上游-169至﹢127位点,全长共含296 bpDNA片段[8]。且研究表明,该核心启动子区域是基因转录必不可少的启动子序列[9]。另外,Northern Blot结果显示LCRG1在人心脏、脑、胎盘、肺、肝、骨骼肌、肾、胰等组织中都具有长约3.4 kb的转录本,在心脏和胰腺组织中表达丰富[1,10]。为了明确LCRG1在喉癌中表达下调的分子机制,Northern印迹分析和PCR-单链构象多态性技术分析分别表明基因缺失、基因重排以及编码区突变都不是LCRG1在喉癌中表达下调的原因[11]。不过,LCRG1 基因启动子甲基化分析却表明LCRG1基因启动子甲基化可能参与LCRG1基因的表达调控[11]。因此,LCRG1基因在喉癌中表达下调或缺失除了自身调控机制外,可能与其上下游信号通路,尤其与上游调控分子有关。但课题组前期利用已知的公认数据库对LCRG1进行分析,没有发现任何已知基因和蛋白质与LCRG1具有显著同源性[10]。这说明LCRG1是一个功能未知的新基因。因此,纯化LCRG1蛋白,制备LCRG1抗体有利于LCRG1基因更多的功能研究。
蛋白质抗原表位的预测有利于合成多肽疫苗,制备诊断试剂和筛选单克隆抗体[5]。重组蛋白是应用重组DNA或重组RNA技术,获得连接有可以翻译成目的蛋白的基因片段的重组载体并通过转染进入可以表达目的蛋白的宿主细胞,使之表达特定的重组蛋白分子的蛋白质。伴随基因工程技术和蛋白质组学的发展,重组功能性蛋白的市场需求日益加大,重组蛋白技术日趋成熟,再加上重组蛋白可以通过大规模制备而源源不断地获得,使其有望成为药物分子的靶标治疗[12]。纯化重组蛋白有助于抗体的生产和药物试剂的开发[13]。因此,获得大量高度纯化且正确折叠的蛋白质显得尤为重要[14]。
本研究从LCRG1蛋白层面入手,用分子生物信息学预测LCRG1蛋白的二级结构及抗原表位,不仅可以加深对LCRG1蛋白的认识,还能为制备LCRG1单克隆抗体提供理论依据。另外,本研究通过琼脂糖凝胶电泳检测以及PCR验证成功构建V152H-LCRG1质粒,并将质粒转染进入人胚肾HEK293细胞中,从而获得LCRG1重组蛋白真核表达。之后经上样,洗杂,洗脱等步骤将LCRG1重组蛋白进一步纯化,得到纯度>95%的目的蛋白。这不仅为进一步制备能用于临床病理标本免疫组化的单克隆抗体奠定了基础,也有利于后期对LCRG1蛋白进行更多的功能研究,从而为喉癌的靶向治疗开辟新途径。
[1] LI Y,CHEN Z.Molecular cloning and characterization of LCRG 1,a novel gene localized to the tumor suppressor locus D17S800-D17S930[J].Cancer Letters,2004,209(1):75-85.
[2] 龚勇.miR-21-5p靶向作用喉癌候选抑瘤基因LCRG1对Hep2细胞生物学性状影响的研究[D].南华大学,2015.
[3] ZHANG X,XIAO Z,CHEN Z,et al.Comparative proteomics analysis of the proteins associated with laryngeal carcinoma-related gene 1[J].Laryngoscope,2006,116(2):224-30.
[4] LI YJ,XIE HL,CHEN ZC,et al.Cloning and expression analysis of a laryngeal carcinoma related gene,LCRG1[J].Acta Biochimica Et Biophysica Sinica,2001,33(3):315-19.
[5] 吴晓平,张红星,吴异健,等.番鸭呼肠孤病毒YB株σC蛋白同源性分析及B细胞表位预测[J].中国家禽,2013,35(3):20-4.
[6] 吴峰,胡承浩,王丹,等.SP100的表达在喉癌中的生物学意义及其靶向治疗的研究[J].现代肿瘤医学,2017,25(14):2234-38.
[7] HAMILTON DW,PEDERSEN A,BLANCHFORD H,et al.A comparison of attitudes to laryngeal cancer treatment outcomes:a time trade-off study[J].Clinical Otolaryngology,2017.
[8] 李金花.喉癌候选抑癌基因LCRG1启动子的克隆及功能初步研究[D].南华大学,2008.
[9] 谢海龙,陈主初,李金花,等.LCRG1基因启动子关键顺式调节元件的鉴定[J].生物化学与生物物理进展,2009,36(5):633-40.
[10] 李友军,谢海龙,陈主初,等.喉癌相关基因LCRG1的克隆和表达分析[J].生物化学与生物物理学报:英文,2001,33(3):315-9.
[11] 李金花,曾龙武,谢海龙.喉癌组织中LCRG1基因启动子的克隆、突变和甲基化检测[J].临床与实验病理学杂志,2013,29(8):819-24.
[12] 苏鹏,龚国利.重组蛋白表达技术的研究进展[J].中国酿造,2016,35(10):9-12.
[13] 曹和平.重组蛋白质生产技术(英文)[J].江西农业大学学报,2010,32(5):1018-31.
[14] LICHTY JJ,MALECKI JL,AGNEW HD,et al.Reprint of:Comparison of affinity tags for protein purification[J].Protein Expression & Purification,2011,41(1):98-105.
