姜黄素调节AKT/PI3K活性抑制人膀胱癌T24细胞的增殖和迁移
2018-03-22,,,,,*
,,,, ,*
(1.南华大学附属第一医院泌尿外科,湖南 衡阳 421001;2.湘潭市湘潭县人民医院泌尿外科)
膀胱癌是一种严重威胁人类健康的泌尿生殖道恶性肿瘤,它的发病率在恶性肿瘤中位居第七位,全世界每年约有15万患者死于该疾病。膀胱癌具有极强的侵袭能力,患者手术后极易复发,且生存率较低。据调查我国膀胱癌患者的数量逐年增加,故研发治疗膀胱癌的药物显得尤为重要[1-3]。姜黄素(Curcumin)是从姜黄中提取出来的一种多酚类化合物,它具有调节炎症、抗氧化和抗肿瘤等多种功能[4]。研究证实姜黄素具有抑制血管瘤、肾癌、前列腺癌和卵巢癌等多种恶性肿瘤的功能[4-7],它也能诱导膀胱癌细胞凋亡[8]。但姜黄素抑制膀胱癌侵袭的机制尚未完全研究清楚。本研究采用不同浓度的姜黄素干预膀胱癌T24细胞,检测其对膀胱癌T24细胞的生长和侵袭的影响,并初步探讨其作用机制。
1 材料与方法
1.1材料与试剂人膀胱癌T24细胞购自美国菌种保存中心(美国ATCC),由南华大学附属第一医院中心实验室保存并传代。姜黄素从美国Sigma公司购买,其纯度大于99%。CCK-8细胞计数试剂盒购自日本同仁化学研究所;兔抗人金属基质蛋白酶2(matrix metalloproteinase 2,MMP2)和MMP9单抗购自奥博森生物技术有限公司;兔抗人蛋白激酶B(Protein Kinase B,AKT)、p-AKT、磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)和p-PI3K抗体购自美国CST公司;小牛血清和培养基RPMI1640购自美国Gibco公司;DMSO、青霉素和链霉素等其他所用的生化试剂为分析纯产品,购自上海生工生物公司。
1.2细胞培养及处理使用含10%小牛血清的RPMI-1640培养基培养T24细胞,培养条件为:5% CO2、37 ℃。等T24细胞长满培养瓶壁,使用0.25%胰酶进行消化并传代;待细胞生长到对数生长期时开始进行干预实验。使用DMSO溶解姜黄素20 mmol/L母液,并保存在-20℃,姜黄素作用终浓度参照文献[9],分别为0、10、20、30 和40 μmol/L,每组设3个平行。
1.3细胞增殖实验收集培养好的细胞,并将其制成5×105个/mL的细胞悬液,并按照100 μL/孔接种到96孔板,37 ℃培养箱中,培养24 h,然后加入终浓度为0、10、20、30 和40 μmol/L的姜黄素,每组3个平行,继续按照上述条件培养72h。孵育结束后使用PBS洗涤细胞,加入新培养基,再在每孔加入10 μL CCK8检测试剂,继续培养1 h。使用酶标仪检测OD450值并按照试剂盒说明书计算细胞增殖率。
1.4细胞迁移实验将200 μL(2.5×105个/mL)细胞悬液到加入包被了Matigel基质胶的Transwell上室,下室加入600 μL含10%血清的RPMI-1640培养基,将其放到培养箱中再培养24 h。取出小室,弃上室中的培养基,用4%多聚甲醛将滤膜固定10 min。丢弃甲醛,再用1%结晶紫进行染色3 min。擦掉未穿过Transwell小室膜的细胞,在显微镜高倍镜下随机挑选5个视野并进行计数,然后将处理组除以对照组得到抑制率。
1.5 Western Blot检测收集对数生长期的T24细胞,并制成5×105个/mL的细胞悬液。并按照接种200 μL/孔接种到24孔板,然后分别加入终浓度为0、10、20、30 和40 μmol/L的姜黄素,将其放在37 ℃培养箱中,培养24 h。5 000 rpm室温下离心,并收集细胞。加入细胞裂解液裂解细胞,10 000 rpm,4 ℃离心后取上清,定量后取50 μg总蛋白进行SDS-PAGE电泳。使用半干法将其转移到PVDF膜,利用5%脱脂奶粉封闭,然后加入相应的一抗(兔抗人MMP2、MMP9、AKT、p-AKT、PI3K和p-PI3K的抗体,同时以β-actin为内参),4 ℃孵育过夜。第二天用TBST将PVDF膜清洗3次,加入辣根过氧化物酶标记的羊抗兔IgG二抗室温孵育1 h。使用TBST缓冲液洗3次和TBS缓冲液洗一次,然后进行显色并拍照。
1.6统计学分析使用统计软件SPSS 19.0进行统计学分析,计量资料以均数±标准差进行表示,使用单因素方差分析(ONEWAY ANOVA)比较组间的多个样本,P<0.05为差异具有统计学意义。
2 结 果
2.1姜黄素能够抑制T24细胞增殖分别以0、10、20、30 和40 μmol/L的姜黄素分别处理T24细胞0、24、48和72 h。实验结果显示与未处理组相比,姜黄素能够明显抑制T24细胞增殖。且随着姜黄素浓度的递增及处理的时间延长,T24细胞的增殖抑制率就越高,即姜黄素对T24细胞的增殖抑制具有浓度和时间依懒性(图1)。
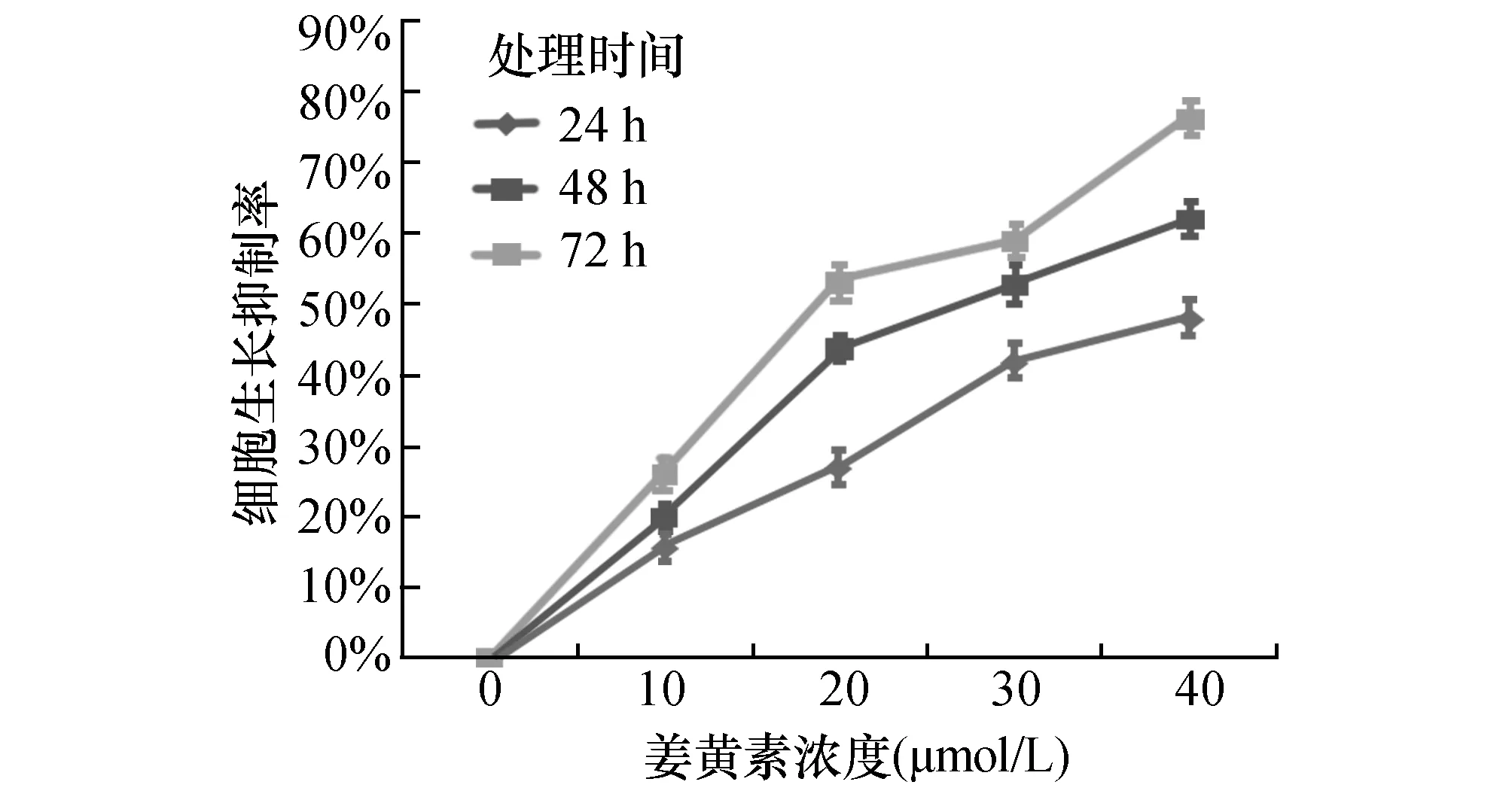
图1 姜黄素处理能够抑制T24细胞的增殖
2.2姜黄素能够减弱T24细胞侵袭能力Transwell 侵袭实验结果显示使用姜黄素干预后,能够透过上室Matrigel胶的T24细胞数量明显要少于未处理组。终浓度为10 μmol/L的姜黄素就能有效抑制膀胱癌T24细胞的侵袭。相对于对照组细胞,处理24 h后,终浓度为10、20、30 和40 μmol/L姜黄素能够抑制T24细胞侵袭能力。姜黄素干预后,能够穿过Matrigel胶的细胞数量明显小于未处理组(表1,图2),它们的抑制效率分别为27.4%、37.1%、58.1%和64.5%(图3)。

表1 姜黄素抑制T24细胞的侵袭性能力
与0 μmol/L姜黄素浓度组比较,aP<0.05

图2 姜黄素对T24细胞侵袭的影响

图3 不同浓度的姜黄素能够抑制T24细胞的侵袭力与对照组(0 μmol/L)相比,*P<0.05;**P<0.01
2.3姜黄素能够下调T24细胞表达MMP2和MMP9蛋白分别使用0、10、20、30 和40 μmol/L的姜黄素干预膀胱癌T24细胞,然后使用蛋白质印记法检测MMP2和MMP9的表达含量,结果发现,姜黄素干预后膀胱癌细胞MMP2和MMP9的表达量明显降低,且呈浓度依懒性,姜黄素浓度越高,细胞表达MMP2和MMP9的浓度越低(图4)。

图4 姜黄素处理膀胱癌T24细胞能够降低MMP2和MMP9的表达
2.4姜黄素对AKT、p-AKT、PI3K和p-PI3K表达的影响使用western blotting检测AKT、p-AKT、PI3K和p-PI3K的表达,发现与对照组相比,姜黄素干预24 h后能够抑制膀胱癌细胞中p-AKT和p-PI3K的表达,但是对总AKT和PI3K的影响并不明显(图5)。

图5 不同浓度的姜黄素对膀胱癌T24细胞AKT、p-AKT、PI3K和p-PI3K表达的影响
3 讨 论
姜黄素是从姜黄中提取出来的一种具有多重生物学效应的酚类物质。研究发现它具有抗氧化、抗炎症和抗肿瘤等多种功能[4]。姜黄素可以通过抑制肿瘤细胞增殖、降低肿瘤细胞侵袭力和诱导肿瘤凋亡等多种途径抑制肿瘤的生长[4,10,11]。同时姜黄素具有毒性低,副作用小和抗肿瘤谱宽等特征,故作为抗肿瘤药物具有非常广泛的应用前景。本实验结果证明姜黄素能够抑制膀胱癌T24细胞的增殖及侵袭力,这与仇炜和龙向阳等人的结果一致[10,11]。
姜黄素在抗肿瘤过程中的机制非常复杂,有研究表明姜黄素能够通过抑制MiR-203的表达来下调AKT2和Src基因的表达而发挥抗肿瘤活性[12]。姜黄素还能下调Sp1、Sp3和Sp4等蛋白从而抑制膀胱瘤的生长,姜黄素能够通过抑制PI3K/Akt信号通路,活化肿瘤细胞的凋亡信号,诱导膀胱癌EJ细胞凋亡[8]。PI3K/Akt途径在肿瘤的增殖、侵袭和转移过程中具有重要功能,磷酸化的PI3K(p-PI3K)和AKT(p-Akt)为它们的活化状态[13]。本研究发现姜黄素干预后, PI3K和Akt的磷酸化水平降低,表明姜黄素能够抑制膀胱瘤T24细胞中PI3K/Akt的活化。
抑制肿瘤细胞的侵袭是治疗恶性肿瘤的关键问题之一,膀胱癌的高侵袭性是患者术后容易复发的主要原因之一[1,2]。MMP具有降解细胞外基质的功能,它们在肿瘤的侵袭和转移中起非常重要作用[14]。调查发现膀胱癌肿瘤患者中MMP2和MMP9的表达量要明显高于正常组织,且与肿瘤的浸润性密切相关。MMP2和MMP9表达量越高的患者,预后越差[15-17]。本研究通过western blotting检测姜黄素处理T24细胞后,发现MMP2和MMP9的表达量下调,且呈浓度依赖性。这显示姜黄素可能通过减少MMPs的表达,从而抑制膀胱癌细胞的侵袭。
综上所述,本研究发现姜黄素可能通过下调P13K/AKT信号通路,降低MMP2和MMP9的表达,抑制膀胱癌T24细胞的增殖和侵袭,从而抑制膀胱癌的生长增殖,在未来的研究中,将通过动物实验对其体内抗肿瘤活性开展研究以进一步为临床应用提供实验证据。
[1] SIDDIQUI MR,GRANT C,SANFORD T,et al.Current clinical trials in non-muscle invasive bladder cancer[J].UrolOncol,2017,35(8):516-27.
[2] VELAER KN,STEINBERG RL,THOMAS LJ,et al.Experience with sequential intravesical gemcitabine and docetaxel as salvage therapy for non-muscle invasive bladder cancer[J].CurrUrol Rep,2016,17(5):38.
[3] 苏军,张思维,陈万青.中国膀胱癌死亡现状及流行趋势分析[J].现代泌尿科杂志,2013,18(3):228-32.
[4] SHANMUGAM MK,RANE G,KANCHI MM,et al.The multifaceted role of curcumin in cancer prevention and treatment[J].Molecules,2015,20(2):2728-69.
[5] WANG X,DENG J,YUAN J,et al.Curcumin exerts its tumor suppressive function via inhibition of NEDD4 oncoprotein in glioma cancer cells[J].Int J Oncol,2017,51(2):467-77.
[6] DIAZ OSTERMAN CJ,GONDA A,STIFF T,et al.Curcumin induces pancreatic adenocarcinoma cell death via reduction of the inhibitors of apoptosis[J].Pancreas,2016,45(1):101-9.
[7] WAGHELA BN,SHARMA A,DHUMALE S,et al.Curcumin conjugated with PLGA potentiates sustainability,anti-proliferative activity and apoptosis in human colon carcinoma cells[J].PLoS One,2015,10(2):e0117526.
[8] TONG QS,ZHENG LD,LU P,et al.Apoptosis-inducing effects of curcumin derivatives in human bladder cancer cells[J].Anticancer Drugs,2006,17(3):279-87.
[9] 陈茜,陈丽娟,党媛媛,等.姜黄素通过阻滞MAPK/ERK通路抑制人子宫内膜癌HEC-1-B细胞的侵袭转移[J].山西医科大学学报,2015,46 (8):762-8.
[10] 仇炜,沈永青,倪晓辰.姜黄素激活人膀胱癌 T24细胞自噬诱导细胞凋亡[J].河北医药,2015,2015(20):3054-7.
[11] 龙向阳,许武军,谢皇,等.姜黄素抑制膀胱癌T24细胞增殖及Hsp90α的表达[J].中南医学科学杂志,2016,44(3):283-5.
[12] SAINI S,ARORA S,MAJID S,et al.Curcumin modulates microRNA-203-mediated regulation of the Src-Akt axis in bladder cancer[J].Cancer Prev Res (Phila),2011,4(10):1698-709.
[13] TIAN B,ZHAO Y,LIANG T,et al.Curcumin inhibits urothelial tumor development by suppressing IGF2 and IGF2-mediated PI3K/AKT/mTOR signaling pathway[J].J Drug Target,2017,25(7):626-36.
[14] WIECZOREK E,JABLONOWSKI Z,TOMASIK B,et al.MMP,VEGF and TIMP as prognostic factors in recurring bladder cancer[J].ClinBiochem,2015,48(18):1235-40.
[15] 彭东涛,苟欣,何梓铭.膀胱癌组织中MMP9、MMP2与PCNA及临床指标的研究[J].重庆医科大学学报,2003,28(4):467-9.
[16] 徐海波,熊异平,余恒勇.膀胱癌组织中MMP-2、MMP-9、Survivin、Livin和VEGF表达的临床意义分析[J].标记免疫分析与临床,2017,24(1):51-4.
[17] 孟勇,柴劲.MMP-2、MMP-9含量表达与膀胱癌分期及病理分级的相关性[J].中国老年学,2013,33(22):5563-4.
