同型半胱氨酸对乳鼠心肌细胞自噬水平及mTOR信号通路的影响
2018-03-22,,*
, , *
(1.首都医科大学基础医学院生理学与病理生理学系,北京100069;2.代谢紊乱相关心血管疾病北京市重点实验室)
高同型半胱氨酸血症(Hyperhomocysteinemia,HHcy)是心血管疾病的一个独立的危险因素[1],可通过多种机制如氧化应激[2]、炎症反应[3]、免疫异常[4]等引起心血管病变。有研究发现,同型半胱氨酸(Homocysteine,Hcy)可直接促进血管内皮细胞[5]及心肌细胞发生凋亡[6]。凋亡是细胞的一种程序性死亡方式,同时细胞内还存在另一种重要的死亡调节方式,即细胞自噬(autophagy)。研究表明[7,8],自噬与凋亡在体内可以相互转化,自噬水平的降低可以促进细胞发生凋亡。对于终末分化的心肌细胞来说,自噬与凋亡都是直接影响细胞功能的关键因素,而Hcy是否可能直接抑制心肌细胞自噬,目前尚不清楚。为此,本研究拟利用细胞实验探究Hcy对心肌细胞自噬水平的影响,并且初步探讨其中的调节机制,旨在为揭示HHcy对心血管的损伤机制提供新的思路和实验依据。
1 材料与方法
1.1材料与试剂胎牛血清、DMEM高糖培养基(Hyclone公司,美国);Hcy试剂(Sigma-Aldrich公司,美国);LC3双标腺病毒Ad-GFP-RFP-LC3购自汉恒生物公司;LC3抗体、mTOR抗体、p-mTOR抗体、P70 S6K抗体、p-P70 S6K抗体(Cell Signaling Technology,美国)、GAPDH抗体、山羊抗兔IgG/生物素标记和山羊抗小鼠IgG/生物素标记(Santa Cruz公司,美国);Annexin V-Alexa Fluor 488/PI kit凋亡检测试剂盒购自四正柏生物公司。 酶标仪(Molecular Devices公司,美国); Western blot电泳仪,Western blot电转仪,凝胶成像系统(Bio-Rad公司,美国)。
1.2主要方法
1.2.1 原代乳鼠心肌细胞提取 选取正常SD大鼠0~3天乳鼠(雌雄不限),手持乳鼠为其全身喷洒75%酒精进行消毒,而后用剪刀从剑突左缘剪开胸骨暴露心脏,迅速取出心脏并放入冰冷PBS中浸泡清洗。使用眼科剪将心脏充分剪碎至1 mm3碎块后收集至50 mL离心管,加入适量PBS,1000 rpm,37 ℃离心5 min。弃掉PBS,加入1 mL消化酶混合液,于37 ℃水浴中摇动消化3 min,将酶悬液吸出加入到含10% 胎牛血清的DMEM培养基中终止消化,如此反复添加酶混合液至心脏组织消化完全。收集消化液与培养基混合液,1 000 rpm,37 ℃,离心10 min, 加入新鲜培养基重悬后接种于培养皿内,贴壁 1.5 h后,将培养基转到新的离心管中,1 000 rpm,37 ℃,离心10 min,收集细胞,弃上清,加入新鲜培养基重悬,重新接种于培养皿中进行细胞培养,所得即为乳鼠心肌细胞(Neonatal rat cardiomyocytes,NRCMs)。
1.2.2 细胞α-actinin荧光染色 原代乳鼠心肌细胞贴壁48 h后,吸弃培养基,PBS清洗2 min,3次。使用4%多聚甲醛4℃固定细胞20 min,PBS清洗5 min,3次,而后使用5% 的血清白蛋白封闭液室温孵育30 min,PBS清洗5 min,3次。一抗(α-actinin,1∶2 000比例稀释)孵育4 ℃过夜,PBS清洗5 min,3次。加入对应二抗避光室温孵育1 h,使用含有DAPI的防荧光淬灭的封片剂封片,避光静置数分钟,而后在荧光显微镜下采集图像。
1.2.3 心肌细胞感染及给药 提取原代心肌细胞接种于六孔板,使用含10%胎牛血清的DMEM高糖培养基培养,细胞贴壁48 h后,进行感染及给药实验。吸弃培养基,加入1/2体积新培养基,加入Ad-GFP-RFP-LC3腺病毒原液(MOI=100,病毒滴度1×1010PFU/mL),4 h后换全体积培养基,培养24~48 h后给药处理。氯喹(Chloroquine,CQ,20 μmol/L)预先刺激30 min后,给予Hcy(500 μmol/L)刺激共孵育,24 h后在荧光显微镜下采集图像。
1.2.4 Annexin V-Alexa Fluor 488/PI kit凋亡检测
收集细胞培养基至离心管内,使用不含EDTA的胰酶消化细胞,轻轻吹打后收集细胞加入到前面收集的细胞培养基内,1 000 rpm,5 min离心,吸除培养基,加入预冷的PBS重悬细胞,再次离心,小心去除上清,用1×结合缓冲液(1∶3比例用去离子水稀释)重悬细胞,调节细胞浓度为1~5×106/mL,取100 μL细胞悬液于流式Ep管,加入5 μL Annexin V-Alexa Fluor 488,混匀后室温避光5 min,加入10 μL 20 μg/mL碘化锭溶液(PI),最后加入400 μL PBS混匀,利用流式细胞仪检测AnnexinV(+)/PI(-)细胞数。
1.3统计学分析数据分析采用SPSS 13.0统计软件,所有数据均用均数±标准差表示。组间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1原代乳鼠心肌细胞形态观察与鉴定原代乳鼠心肌细胞贴壁3天后,利用倒置显微镜镜下观察心肌细胞形态及自发搏动情况(图1A)。采用细胞免疫荧光法检测心肌细胞α-肌动蛋白,对心肌细胞进行鉴定(图1B)。镜下所见心肌细胞生长状态良好,成簇生长,搏动明显,表明提取细胞技术成熟,原代心肌细胞可用于后续实验。
2.2 Hcy可诱导心肌细胞发生凋亡乳鼠心肌细胞贴壁3 天后,在培养基中加入Hcy(500 μmol/L)与心肌细胞共同孵育24 h,然后对心肌细胞进行AnnexinV/PI双标记染色,利用流式细胞仪计数。结果显示,与对照组相比Hcy处理组AnnexinV(+)/PI(-)细胞明显增多(图2,P<0.05)。
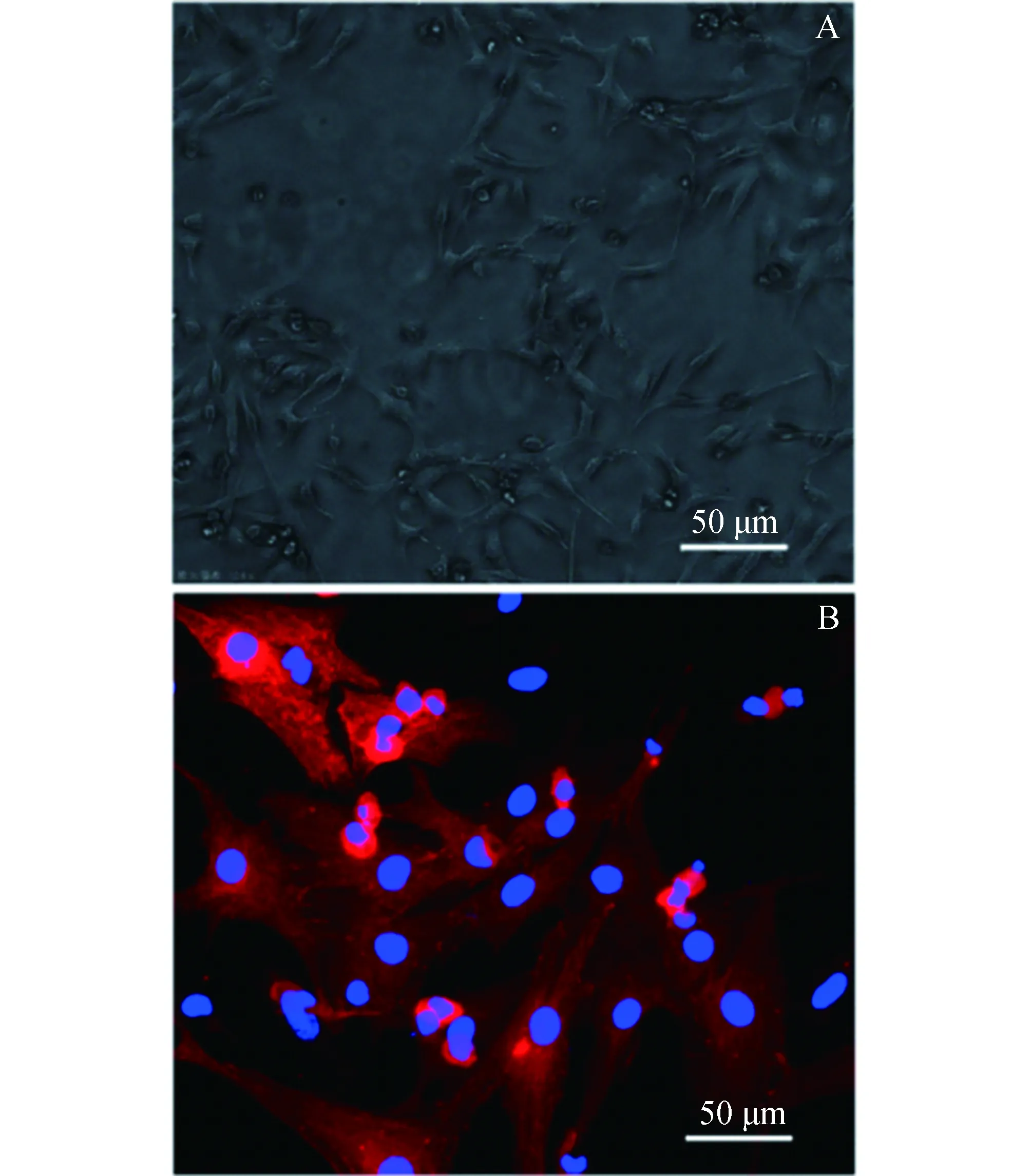
图1 原代乳鼠心肌细胞形态观察与鉴定(200×)A:原代心肌细胞形态,B:心肌细胞α-actinin染色

图2 Hcy可诱导心肌细胞发生凋亡与Control 组比较,*P<0.05
2.3 Hcy降低原代心肌细胞自噬水平乳鼠心肌细胞贴壁3天后,在培养基中加入梯度浓度的Hcy与心肌细胞共同孵育24 h,利用wstern blot方法检测自噬相关蛋白LC3的改变。结果显示,心肌细胞LC3II/LC3I的比值随Hcy浓度升高而降低(P<0.05),且具有浓度依赖性(图3A)。为了进一步检测Hcy对乳鼠心肌细胞自噬流的影响,首先使用溶酶体抑制剂氯喹(chloroquine,CQ),防止LC3-Ⅱ蛋白被溶酶体降解,从而使其在胞内聚集,而后加入Hcy共同孵育观察其对LC3-Ⅱ的作用。激光共聚焦显微镜下观察发现,Hcy刺激后,细胞内LC3-Ⅱ的荧光点状聚集明显减少(图3B)。
2.4 Hcy可激活mTOR信号通路为探讨Hcy降低心肌细胞自噬水平的可能机制,利用western blot方法检测自噬的重要调控通路mTOR及其下游蛋白P70 S6K的磷酸化水平。结果显示,Hcy处理可以明显提高mTOR及其下游蛋白磷酸化水平(图4)。

图3 Hcy抑制原代心肌细胞自噬水平(400×)A:与Control 组比较,#:P<0.05,*P<0.01;B:Ad-GFP-RFP-LC3,激光共聚焦镜下观察

图4 Hcy可激活mTOR信号通路与Control 组比较,#P<0.05,*P<0.01
3 讨 论
大量的临床试验及流行病学研究已经表明,血浆同型半胱氨酸水平增高是心力衰竭以及动脉粥样硬化等心血管疾病的重要独立危险因素,中国高血压防治指南将空腹血浆总Hcy水平 > 10 μmol/L定义为高同型半胱氨酸血症[9]。血浆Hcy水平与发生心脑血管疾病呈正相关,Hcy每升高5μmol/L,脑卒中增加59%,而Hcy每降低3 μmol/L,可降低脑卒中风险约24%。但目前对于高同型半胱氨酸血症促进心力衰竭及心血管损伤的具体机制尚存在很多疑问。自噬是细胞维持内环境稳定的一种重要机制,指细胞将损伤的蛋白质以及细胞器运输到溶酶体进行降解消化,以实现细胞本身的代谢需要和相关细胞器更新的过程,主要以胞质内出现自噬体为特征[10]。生理状态下自噬水平较低,降解的细胞内成分可以提供营养或原料供给细胞循环再利用[11];病理状态下,自噬水平发生上调或者下调,作为一种适应性反应以维持细胞内整体的稳态平衡。有研究发现,抑制细胞自噬可以促进细胞凋亡的发生[12]。作为调节细胞死亡的两种重要机制,自噬与凋亡对维持细胞正常生理功能具有重要作用。本研究发现,给予原代乳鼠心肌细胞Hcy共孵育刺激,心肌细胞凋亡率升高的同时细胞自噬水平明显降低。
细胞自噬水平受一系列信号分子的调节,其中哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)是自噬的重要调节蛋白。mTOR对细胞内ATP和氨基酸等营养物质敏感[13]。在营养丰富的情况下,mTOR受Akt信号通路磷酸化激活,进而抑制自噬水平[14-15]。mTOR的下游信号通路p70S6K的磷酸化可间接反映mTOR信号通路的活性[16]。有研究发现,Hcy在神经细胞可直接激活mTOR信号通路。本研究利用western blot技术观察了心肌细胞mTOR以及下游p70S6K的磷酸化水平。结果表明,500 μmol/L Hcy刺激可明显上调心肌细胞mTOR以及下游p70S6K的磷酸化,这提示mTOR信号通路可能参与了Hcy对心肌细胞自噬的抑制作用。但是,结果中100 μmol/L Hcy刺激后mTOR磷酸化水平只有升高的趋势,而其下游p70S6K磷酸化水平升高,可能是因为mTOR是289 kD的大分子蛋白,因技术手法局限没有检测出明显差异。
综上,本研究表明高浓度的Hcy促进凋亡发生的同时可抑制心肌细胞自噬水平,mTOR信号通路可能参与其中。本研究为揭示HHcy的心肌损伤机制提供了新的思路和实验依据。
[1] SHINAWI M.Hyperhomocysteinemia and cobalamin disorders[J].Mol Genet Metab,2007,90(2):113-21.
[2] STEED M,TYAGI S.Mechanisms of cardiovascular remodeling in hyperhomocysteinemia[J].Antioxid Redox Signal,2011,15(7):1927-43.
[3] LIU Z,LUO H,ZHANG L,et al.Hyperhomocysteinemia exaggerates adventitial inflammation and angiotensin II-induced abdominal aortic aneurysm in mice[J].Circ Res,2012,111(10):1261-73.
[4] MA K,LV S,LIU B,et al.CTLA4-IgG ameliorates homocysteine-accelerated atherosclerosis by inhibiting T-cell overactivation in apoE(-/-)mice[J].Cardiovasc Res,2013,97(2):349-59.
[5] ZHANG Z,WEI C,ZHOU Y,et al.Homocysteine Induces apoptosis of human umbilical vein endothelial cells via mitochondrial dysfunction and endoplasmic reticulum stress[J].Oxid Med Cell Longev,2017,2017:5736506.
[6] WANG X,CUI L,JOSEPH J,et al.Homocysteine induces cardiomyocyte dysfunction and apoptosis through p38 MAPK-mediated increase in oxidant stress[J].J Mol Cell Cardiol,2012,52(3):753-60.
[7] RUBINSTEIN A,KIMCHI A.Life in the balance-a mechanistic view of the crosstalk between autophagy and apoptosis[J].J Cell Sci,2012,125(Pt 22):5259-68.
[8] MAIURI M,ZALCKVAR E,KIMCHI A,et al.Self-eating and self-killing:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741-52.
[9] 中国高血压防治委员会.中国高血压防治指南2010年修订版[J].中国医学前沿杂志:电子版,2011,3(5):42-91.
[10] LEE J,GIORDANO S,ZHANG J.Autophagy,mitochondria and oxidative stress:cross-talk and redox signalling[J].Biochem J,2012,441(2):523-40.
[11] KUMA A,MIZUSHIMA N.Physiological role of autophagy as an intracellular recycling system:with an emphasis on nutrient metabolism[J].Semin Cell Dev Biol,2010,21(7):683-90.
[12] BOYA P,CASARES N.Inhibition of macroautophagy triggers apoptosis[J].Mol Cell Biol,2005,25(3):1025-40.
[13] LIU Y,SCHIFE M,CZYMMEK K,et al.Autophagy regulates programmed cell death during the plant innate immune response[J].Cell,2005,121(4):567-77.
[14] WANG X,PROUD C.The mTOR pathway in the control of protein synthesis[J].Physiology (Bethesda),2006,21:362-69.
[15] WU S,SUN G,CHA T,et al.CSC-3436 switched tamoxifen-induced autophagy to apoptosis through the inhibition of AMPK/mTOR pathway[J].J Biomed Sci,2016,23(1):60.
[16] ZHAO G,PAN H,OUYANG D,et al.The critical molecular interconnections in regulating apoptosis and autophagy[J].Ann Med,2015,47(4):305-15.
