彩色超声检测微血管密度与血流阻力指数对卵巢肿瘤的诊断价值分析
2018-03-22,,
,,
(深圳市龙岗区第六人民医院超声科,广东 深圳 518117)
卵巢肿瘤作为临床常见的女性生殖系统肿瘤,患者的预后与病理性质、肿瘤分期密切相关。早期鉴别诊断卵巢肿瘤,作为提高恶性卵巢肿瘤患者远期疗效的关键环节。彩色超声(彩超)作为检查诊断卵巢肿瘤的常规方法,但在鉴别诊断良性、恶性卵巢肿瘤上存在争议,与不同病理性质卵巢肿瘤的彩超形态学特点缺乏特异性而密切相关[1]。近年来,血管生成学说对于指导肿瘤的临床诊断具有重要作用;在卵巢肿瘤的发病、生长、浸润、转移过程中,均依赖肿瘤病灶内血管的生成[2]。微血管密度、血流阻力指数均作为反映卵巢肿瘤血管生成情况的量化观察指标。对此,为进一步提高卵巢肿瘤的诊断效果,本研究旨在分析彩超微血管密度与血流阻力指数对卵巢肿瘤的诊断价值。
1 资料与方法
1.1一般资料选取本院2013年2月~2015年10月期间,治疗的107例卵巢肿瘤患者作为研究对象,年龄范围39.5~58.4岁、平均年龄48.4±4.8岁;经手术-病理诊断为良性卵巢肿瘤64例、恶性卵巢肿瘤43例;根据肿瘤TNM分期[3]对恶性卵巢肿瘤进行分组,Ⅰ或Ⅱ期30例、Ⅲ或Ⅳ期17例。
1.2研究方法所有患者均采取彩超检查,使用美国GE Voluson E8彩色多普勒超声诊断仪,高频线阵探头频率7.5~10 MHz;手术治疗前,进行腹部超声检查,清晰显示肿瘤病灶的位置、大小、形态结构、边界清晰情况、内部回声等,重点扫查怀疑病灶的区域,随之进入彩超血流显像,重点观察肿瘤病灶内部、周边的血管形态、血流分布特点,并测量血流阻力指数;微血管密度参照Weider血管计数法,高度糖基化的i型跨膜糖蛋白(CD34)免疫组化染色后,在低倍镜下寻找血管密度最高的区域,在高倍镜下对染色血数进行计数,并平均值。
1.3观察指标分析良性与恶性卵巢肿瘤的彩超形态学特点,根据肿瘤TNM分期对恶性卵巢肿瘤进行分组,对比良性卵巢肿瘤与恶性卵巢肿瘤、Ⅰ或Ⅱ期与Ⅲ或Ⅳ期恶性卵巢肿瘤的微血管密度、血流阻力指数;并分析微血管密度联合血流阻力指数对卵巢肿瘤的诊断敏感性、特异性、阳性预测值、阴性预测值。
1.4统计学分析采用SPSS12.0软件处理实验数据,计数资料使用χ2检验;采用Pearson等级相关性分析;以P<0.05为差异具有统计学意义。
2 结 果
2.1良性与恶性卵巢肿瘤的彩超形态学特点对比良性卵巢肿瘤的彩超形态学特点以囊性回声或边界清晰的实性回声为主,周围分布高阻力血流信号;恶性卵巢肿瘤的彩超形态学特点以囊实混合性回声为主,病灶内血流信号强,以阻力血流信号多见(见图1、图2)。

图1 边界清晰的实性回声,形态规整,边界清晰,周围分布高阻力血流信号;病理:良性卵巢肿瘤
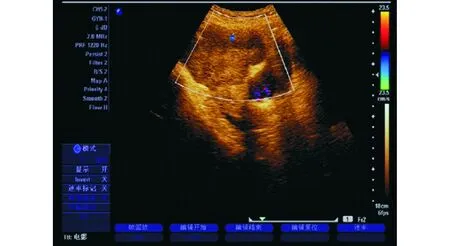
图2 囊实混合性回声,形态欠规则,边界尚清,内部回声不均匀,病灶内血流信号强,以阻力血流信号为主;病理:恶性卵巢肿瘤
2.2恶性与良性卵巢肿瘤的微血管密度、血流阻力指数对比恶性卵巢肿瘤的微血管密度高于良性卵巢肿瘤,血流阻力指数小于良性卵巢肿瘤,详见表1。
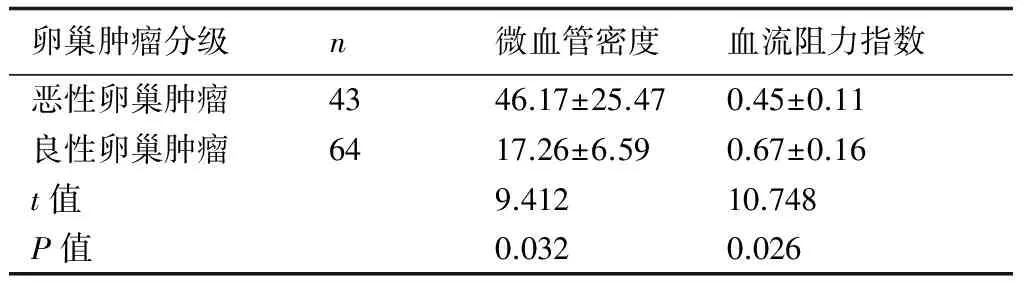
表1 恶性与良性卵巢肿瘤的微血管密度、血流阻力指数
2.3不同TNM分期恶性卵巢肿瘤的微血管密度、血流阻力指数对比Ⅲ或Ⅳ期恶性卵巢肿瘤的微血管密度高于良性卵巢肿瘤,血流阻力指数小于Ⅰ或Ⅱ期恶性卵巢肿瘤;经T检验,均具有显著性差异(P<0.05),详表2。

表2 不同TNM分期恶性卵巢肿瘤的微血管密度、血流阻力指数
2.4微血管密度联合血流阻力指数诊断卵巢肿瘤价值分析微血管密度联合血流阻力指数诊断卵巢肿瘤的诊断敏感性、特异性、阳性预测值、阴性预测值均高于单一检查方法,详见表3。

表3 微血管密度联合血流阻力指数诊断卵巢肿瘤价值分析
3 讨 论
卵巢肿瘤的早期症状缺乏特异性,且卵巢肿瘤的病灶较为隐蔽,早期恶性卵巢肿瘤易呈浸润性生长,导致临床常延误卵巢肿瘤的诊断治疗时机。在卵巢肿瘤的发病过程中,肿瘤血管生成与其生长、分期、预后密切相关。肿瘤血管生成是指肿瘤病灶的微血管内皮细胞在血管生成因子的刺激下,进入细胞增殖周期,通过多种方式形成新的血管[4]。卵巢肿瘤尤其是恶性卵巢肿瘤的典型特征为高度血管生成。有研究认为,血管生成作为卵巢肿瘤发病的重要过程,可加快卵巢肿瘤的发病进程并发生转移[5]。对此,卵巢肿瘤病灶及其周围分布大量新生的微血管,且新生的微血管的管壁薄,顺应性较差,对血流的阻力显著低于正常血管。目前评价卵巢肿瘤血管生成情况的方法主要有:微血管密度及彩超测定的血流阻力指数;两种方法在鉴别诊断良性、恶性卵巢肿瘤上各具有优缺点,可相互补充,协同提高对卵巢肿瘤的诊断效果。
彩超作为检查诊断卵巢肿瘤的常规方法,可检测卵巢肿瘤的病理基础,可鉴别卵巢肿瘤病灶的形态结构,检测卵巢肿瘤的血管生成趋势。本研究发现,良性卵巢肿瘤的彩超形态学特点以囊性回声或边界清晰的实性回声为主,周围分布高阻力血流信号;恶性卵巢肿瘤的彩超形态学特点以囊实混合性回声为主,病灶内血流信号强,以阻力血流信号多见;提示良性、恶性卵巢肿瘤的血管生成情况具有差异性,但单纯通过彩超形态学特点,难以特异性鉴别诊断良性、恶性卵巢肿瘤,与彩超形态学特点缺乏特异性有关。有研究认为[6],彩超在诊断卵巢肿瘤过程中,存在同图异病、同病异图的情况,严重降低对卵巢肿瘤的诊断准确性。此外,一些恶性卵巢肿瘤的早期形态规则,边界清晰,且内部回声均匀,彩超形态学特点与良性卵巢肿瘤高度相似;进一步提示卵巢肿瘤在彩超检查诊断的基础上,需借助血管生成的观察指标,提高对卵巢肿瘤的诊断效果。
微血管密度被认为反映卵巢肿瘤血管生成情况的金标准;在微血管密度的测定过程中,且CD34在微血管中表达良好,以CD34作为特异性标记物,对CD34进行染色,可清晰反映卵巢肿瘤微血管的多少[7]。有研究发现[8],随着微血管密度的增大,卵巢肿瘤的生长与浸润程度随之增大,提示卵巢肿瘤具有恶化或转移的趋势。卵巢肿瘤的病情严重程度与微血管密度呈正相关,对恶性卵巢肿瘤的发生、发展及预后而提出血管病理学解释。在恶性卵巢肿瘤的发病期间,癌细胞呈不可控状态生长繁殖,肿瘤内及其周围组织的新生血管成熟程度较低,形成的新血管分布具有随意性,且其管壁结构不牢固,可导致癌细胞的转移扩散[9]。此外,新形成的血管为癌细胞的生长繁殖提供营养支持,可加剧病情的进展。在本研究中,恶性卵巢肿瘤的微血管密度高于良性卵巢肿瘤,Ⅲ或Ⅳ期恶性卵巢肿瘤的微血管密度高于良性卵巢肿瘤,进一步佐证上述观点。
由于血流阻力指数可反映卵巢肿瘤的血流动力学,可评估卵巢肿瘤的血管生成趋势。有研究认为[10],血流阻力指数可间接诊断良性或恶性卵巢肿瘤,结合彩超的形态学特点,可综合判断卵巢肿瘤的病理特点及预后情况。由于良性、恶性卵巢肿瘤或不同肿瘤TNM分期的卵巢肿瘤内血管的形态结构、数量均具有差异性,其中以血流阻力指数的差异性最为显著。随着卵巢肿瘤病情的恶化,新生血管的分布不规则,管壁顺应性较低,在血液循环过程中,血管内的收缩与舒张变异减小,导致血流阻力指数减小[11]。此外,在卵巢肿瘤的发展过程中,引起血管代偿性扩张,可进一步减小血流阻力指数。有研究证实,恶性卵巢肿瘤的血流为低阻型,以血流阻力指数较小为主要特征,随着恶性卵巢肿瘤的浸润或转移而进一步减小。此外,在恶性卵巢肿瘤TNM分期升高的情况下,肿瘤新生血管越多,血流阻力指数越小,有利于血供正常。本研究显示,恶性卵巢肿瘤的血流阻力指数小于良性卵巢肿瘤;Ⅲ或Ⅳ期恶性卵巢肿瘤的血流阻力指数小于I或Ⅱ期恶性卵巢肿瘤;进一步提示彩超测定血流阻力指数对于诊断卵巢肿瘤具有积极作用。此外,微血管密度联合血流阻力指数诊断卵巢肿瘤的诊断敏感性、特异性、阳性预测值、阴性预测值均高于单一检查方法;提示彩超微血管密度与血流阻力指数可协同提高对卵巢肿瘤的诊断效果。
综上所述,彩超微血管密度与血流阻力指数可协同提高对卵巢肿瘤的诊断。
[1] SUN J,YIN M,ZHU S,et al.Ultrasound-mediated destruction of oxygen and paclitaxel loaded lipid microbubbles for combination therapy in hypoxic ovarian cancer cells[J].Ultrason Sonochem,2016,28:319-26.
[2] 王娟娟,于冰.卵巢肿瘤彩超血流指标与微血管密度及促血管生成素的相关性[J].中国临床医学影像杂志,2015,26(10):728-31.
[3] PRAT J,BELHADJ H,BEREK J,et al.Abridged republication of FIGO’s staging classification for cancer of the ovary,fallopian tube,and peritoneum [J].Eur J Gynaecol Oncol,2015,36(4):367-9.
[4] SHA-SHA H,LI H,JIE M,et al.DVP parametric imaging for characterizing ovarian masses in contrast-enhanced ultrasound[J].Eur J Gynaecol Oncol,2015,36(5):574- 8.
[5] 王新燕,唐桂波.彩色多普勒超声血流阻力指数结合CA125对卵巢肿瘤的诊断价值[J].中国医学影像学杂志,2012,13(9):692-4.
[6] 许险峰,李振洲,敖礼,等.血清CA125、CA72-4联合超声血流检测在卵巢上皮恶性肿瘤诊断中的价值[J].中国妇幼保健,2010,25(27):3866-8.
[7] SALEHI HS,LI H,MERKULOV A,et al.Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer:ex vivo and in vivo studies[J].J Biomed Opt,2016,21(4):46006.
[8] MEYS EM,KAIJSER J,KRUITWAGEN RF,et al.Subjective assessment versus ultrasound models to diagnose ovarian cancer:A systematic review and meta-analysis[J].Eur J Cancer,2016,58:17-29.
[9] SUH-BURGMANN E,KINNEY W.The value of ultrasound monitoring of adnexal masses for early detection of ovarian cancer[J].Front Oncol,2016,6:25.
[10] SUDARSHAN VK,MOOKIAH MR,Acharya UR,et al.Application of wavelet techniques for cancer diagnosis using ultrasound images:A Review [J].Comput Biol Med,2016,69:97-111.
[11] 林琳,齐铮琴,赵锦,等.经阴道彩色多普勒超声与病理微血管密度对卵巢肿瘤诊断的相关性研究[J].河北医科大学学报,2011,32(2):158-1.
