传统热炸法对梅花鹿鹿茸不同部位细胞因子含量的影响
2018-03-21邓红梅丁倩男王春梅赓迪戴俊东董玲
邓红梅,丁倩男,王春梅,赓迪,戴俊东,董玲
(北京中医药大学生命科学学院,北京 100102)
鹿茸为鹿科动物梅花鹿(Cervus nippon Temminck)或马鹿(CervuselaphusLinnaeus)的雄鹿未骨化密生茸毛的幼角,是我国传统名贵中药材,在我国东北、西北和内蒙及西南山区均有分布,其中,吉林省产的梅花鹿鹿茸质量最佳[1]。鹿茸是唯一能够完全再生的哺乳动物器官,每年周期性地脱落,完全再生。鹿茸的生长速度在哺乳动物中是不可思议的,生长速度可达1cm/d~2cm/d[2]。鹿茸的药理学功能也非常明确,《本草纲目》中记载:“鹿茸生精补髓、养血益阳、强筋健骨、益气强志”。现代科学研究证明,鹿茸具有促进机体生长发育、调节新陈代谢的功能[3]。近年来,国内、外学者相继在鹿茸中发现各种细胞生长因子,如胰岛素样生长因子(Insulin-1ikegrowthfactor,IGF)、表皮生长因子(Epidermal growth factor,EGF)、神经生长因子(Nervegrowthfactor,NGF)等[4]。鹿茸的快速生长与鹿茸中生长因子的调节密切相关[5],鹿茸的药理功能也与鹿茸中所含的生长因子密不可分。因此,鹿茸中生长因子的含量变化与鹿茸的品质是呈正相关的。
新鲜鹿茸中含有70%左右的水分,没有及时干透或再受潮的鹿茸会在自身酶或外界腐败菌的作用下变质,降低或失去药用价值。鹿茸需经过炮制和干燥后进行保存、运输和应用。大部分市场销售的鹿茸是采用传统的沸水煮炸和风干相结合的加工方法[6],这种方法对鹿茸中的生长因子含量产生什么样的影响呢?本研究对炮制前、后鹿茸细胞因子含量进行了测定,为鹿茸的加工工艺改进提供参考。
从组织学上看,鹿茸从顶端到基部是增生区、成熟区和肥大区(互有重叠,无法完全分开)、钙化区。相对应鹿茸饮片分4个等级,即一等:腊片;二等:粉片;三等:血片:四等:骨片。传统认为,一等质量最佳,依次递减[7,8]。现代实验也证明,不同部位鹿茸的药理活性差异很大,梢部最好,基部最差,与传统认识相一致[9]。本研究比较了炮制前、后鹿茸上部(增生区)、中部(成熟区和肥大区)、下部(钙化区)的生长因子含量变化,为鹿茸的质量控制和评价提供依据。
1 实验材料
1.1 药物与试剂
鲜梅花鹿茸二杆茸(伟博海泰生物技术有限公司,并由北京中医药大学戴俊东教授鉴定);考马斯亮蓝G-250、牛血清白蛋白(BSA)(北京拜尔迪公司);检测生长因子EGF、NGF和IGF-1的ELISA试剂盒(Bluegene公司);其他试剂均为分析纯。
1.2 仪器
HH-S6B数显恒温水浴锅(金坛市正基仪器有限公司);UV-2000紫外分光光度计(尤尼柯上海仪器有限公司);ULT1386-3-V30超低温冰箱(日本三洋电器公司);SpectraMax190酶标仪(美国MD分子仪器公司);Biofugestratos高速冷冻台式离心机(Thermo公司);FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司);JMS-80B胶体磨(廊坊恒诺机械有限公司);LambdaPlus单通道移液器(Corning上海管理有限公司);BSA124S电子天平(Sartorius工业称重设备北京有限公司);Milli-Q Plus超纯水制备系统(Millipore实验室设备上海有限公司)。
2 实验方法
2.1 鹿茸的分段
用酒精灯对新鲜二杠鹿茸火燎去毛,将去毛后鲜鹿茸切成上、中、下3部分,分别对应未骨化、部分骨化和完全骨化部位。每部分均再纵向切成2份,1份作为鲜品,1份用保鲜膜裹住断面,用于传统炮制。
2.2 鹿茸的传统炮制
按照文献[10]所描述的方法进行,将鲜鹿茸反复放入沸水中以排尽血水,烘干水分至酥脆。
2.3 鹿茸可溶性蛋白样品的制备
将鲜鹿茸和热炸过的鹿茸切成薄片,液氮低温条件下粉碎成末,按照固、液质量比1∶2加入超纯水,充分混悬,利用胶体磨对混悬液匀浆5min,4℃12000r/min离心15min,取上清,分装于-80℃下保存备用。
2.4 鹿茸可溶性蛋白质浓度的测定
采用Bradford方法[11]对鹿茸水提上清液进行蛋白质浓度测定。
2.5 生长因子含量的测定
采用酶联免疫吸附实验(ELISA)方法对各生长因子的含量进行测定,参考文献[12],按照试剂盒说明进行。
2.6 数据分析
Excel软件对实验数据进行整理,结果以x±s表示,利用SAS软件对数据进行统计学分析,采用t检验组间比较,P<0.05有显著性差异,P<0.01有极显著性差异。
3 结果
3.1 炮制前、后鹿茸不同部位可溶性蛋白含量
鹿茸中可溶性蛋白的含量从上部到下部依次降低,鲜品上部可溶性蛋白含量是下部的1.45倍。经炮制处理后,鹿茸中可溶性蛋白的溶出量明显减少,结果见表1。

表1 炮制前、后鹿茸不同部位可溶性蛋白含量Table 1 The content of the soluble proteins in the velvet antler before and after processing.
3.2 炮制前、后鹿茸不同部位EGF含量
鲜鹿茸的上部和中部能检测到EGF含量,上部是中部的2.6倍;在鲜鹿茸下部未检测到EGF。与鲜鹿茸相比,炮制后鹿茸中可溶性EGF含量明显降低,只有上部能检测到较低的含量;中、下部含量太低,未检测到。见表2。
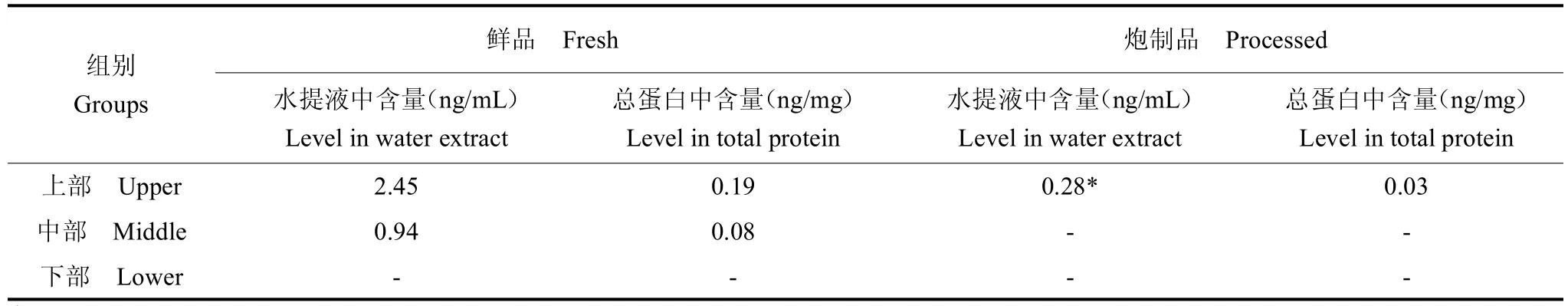
表2 炮制前、后鹿茸不同部位EGF含量Table 2 The content of the EGF in the velvet antler before and after processing.
3.3 炮制前、后鹿茸不同部位IGF-1含量
不同部位鲜鹿茸中均检测到IGF-1,上部含量是中部的2.27倍,中部含量是下部的6.57倍。炮制后只有上部能检测到IGF-1,其含量只有未炮制的5.7%。见表3。

表3 炮制前、后鹿茸不同部位IGF-1含量Table 3 The content of the IGF-1 in the velvet antler before and after processing (ng/mL)
3.4 炮制前、后鹿茸不同部位NGF含量
鲜鹿茸中NGF含量从上到下依次降低,上部是下部的5.9倍。炮制后只有上部和中部可以检测到含量较低的NGF,上部含量只有炮制前的27.35%。见表4。
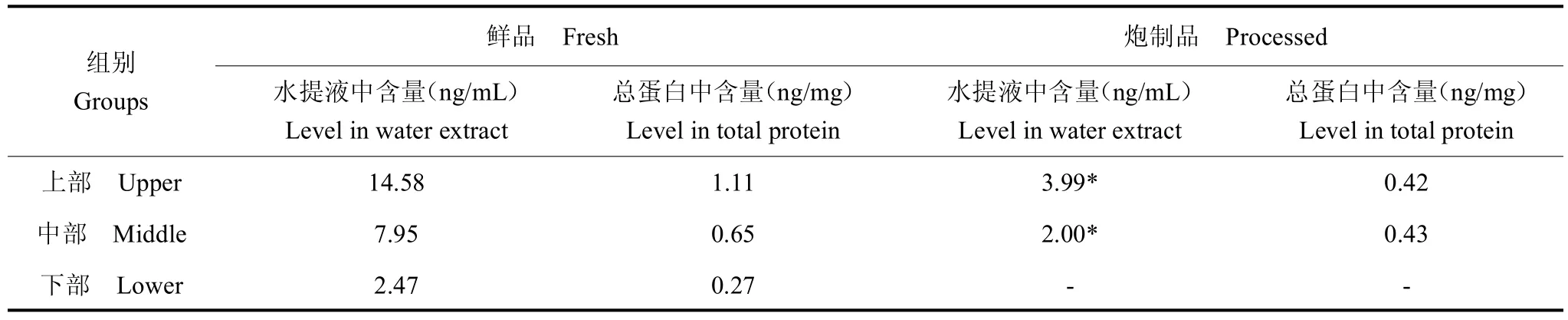
表4 炮制前、后鹿茸不同部位NGF含量Table 4 The content of the NGF in the velvet antler before and after processing.
4 讨论
鹿茸被认为是一个天然的细胞因子库,鹿茸生长因子在鹿茸的药用功能中占有极其重要的地位,是鹿茸的主要药效成分之一[4]。其中,认为比较重要、研究较多的生长因子有EGF、NGF、IGF-1等。EGF是强有力的促细胞分裂因子;NGF具有神经元营养和促突起生长双重生物学功能,促进鹿茸组织神经的快速生长;IGF-1是胰岛素样生长因子家族中的重要成员,也是活性最强的成员,它与鹿茸的生长发育直接相关。因此,本研究选这3种比较重要的细胞因子进行研究。对梅花鹿鹿茸不同部位细胞因子的含量的研究目前未见报道,本研究提供的数据为梅花鹿鹿茸细胞因子的深入研究和利用奠定了基础。
鹿茸的质量控制一直是企业和市场比较关注的问题。传统临床经验已经证明,鹿茸从上到下功效依次降低,作为商品的上部腊片和下部骨片差价很大[7]。结合鹿茸的组织结构特点,本研究将鹿茸横切为上、中、下3部分,分别对应鹿茸增生区、成熟区和肥大区以及钙化区,3种生长因子从上到下含量急剧降低,尖部含量最高。也有文献报道,马鹿茸中IGF-1含量具有相似的变化趋势[13]。这些数据也进一步证明鹿茸中生长因子是鹿茸活性的重要物质基础。反过来,鹿茸样品中生长因子含量也可以作为质量评价的依据之一。本研究中所用ELISA试剂盒中的一抗是根据人的EGF、NGF和IGF-1制备的。由于没有鹿的相关因子的ELISA试剂盒,而人与鹿的这3个因子氨基酸序列存在较高的同源性,郝琳琳等[14]通过人的EFG、IGF-1、NGF抗体对鹿茸醇提、酸提多肽进行Western实验,结果,这3个因子都可以检测到。因此,选取人的相关生长因子的ELISA试剂盒是可行的。ELISA的检测方法简单、灵敏、易操作,用此法检测鹿茸中生长因子的含量做为鹿茸质量控制的方法有很大的开发潜力。
鹿茸作为动物角类,用白酒润透切片的方式也是其传统炮制方法之一。但目前,市售的鹿茸片大多还是采用相对简便的沸水煮炸与风干相结合的方法[15]。为尽可能保证初始样品成分的一致性、减小实验误差,研究中将同一根鹿茸对称纵切成2份,分别作为鲜品和用于炮制。本研究数据显示,热炸法炮制后鹿茸中可溶性蛋白含量降低,3种细胞因子含量明显降低,由此可见,传统热炸法炮制工艺可能部分破坏鹿茸活性,有待改进。温度对包括生长因子在内的蛋白类活性成分影响较大,针对鹿茸活性成分中蛋白多肽类占较大比重(鹿茸中蛋白质含量为50%~60%)的特点,已经有多种鹿茸加工工艺的改进方法研究[6]。有报道认为,低温冻干工艺能较好地保存鹿茸的活性,因此,建议生产上采用低温加工工艺。
[1]姜亦飞,李峰,张世栋,等.我国梅花鹿产业的发展现状及前景展望[J].山东农业科学,2012,44(9):109-111.
[2]刘振,赵海平,杨春,等.鹿茸再生及其分子调节机理研究进展[J].中国畜牧兽医,2013,40(2):50-53.
[3]吉静娴,钱璟,黄凤杰,等.鹿茸的活性物质及药理作用的研究进展[J].中国生化药物杂志,2009,30(2):141-143.
[4]何忠梅,王铁成,赵文杰,等.鹿茸多肽生长因子研究进展[J].经济动物学报,2011,l5(3):179-183.
[5]Kuz mova E,Bartos L,Kotrba R,et al.Effect of Different Factors on Proliferation of Antler Cells,Cultured In Vitro[J/OL].(2011-3-28)[2017-10-10].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3065459/.
[6]李秀娟,武晓东,郑彬,等.鹿茸加工方法与工艺[J].内蒙古农业大学学报,2008,29(3):201-204.
[7]宋纪伟,宗颖,时坤,等.鹿茸质量控制体系研究进展[J].中药材,2012,35(9):1534-1537.
[8]李春义,赵世臻,宋健华,等.梅花鹿茸组织结构研究[J].特产研究,1989,(2):1-4
[9]冯汉鸽,王喜云,张亚志.鹿茸不同部位的药理作用比较[J].时珍国药研究,1996,7(5):277-278.
[10]张荣,李园.鹿茸的炮制工艺[J].光明中医,2012,27(4):822-823.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:42.
[12]Reen DJ.Enzyme-linked immunosorbent assay(ELISA)[J].Methods Mol Biol,1994,32(1):816-819
[13]郝林琳,刘松财,任晓慧,等.马鹿茸不同部位IGF-1含量的比较分析[J].经济动物学报,2005,9(4):201-203.
[14]郝林琳,刘松财,张明军.鲜马鹿茸不同部位多肽的提取及含量比较[J].吉林农业大学学报,2007,29(4):378-380.
[15]朱阳春,张南方,张义生.介绍几种鹿茸传统炮制方法[J].时珍国医国药,2013,24(12):2907.
