青光眼睫状体炎综合征患者房水病毒情况分析△
2018-03-21许欢翟如仪孔祥梅王朱健王晓蕾
许欢 翟如仪 孔祥梅 王朱健 王晓蕾
青光眼睫状体炎综合征(Posner-Schlossman syndrome,PSS)又称Posner-Schlossman综合征,是Posner和Schlossman于1948年首先描述的一类疾病,以复发性、单眼的前葡萄膜炎伴有显著眼压升高为特征,临床治疗以控制炎症、降低眼压为主,但病情容易反复发作,且发作渐趋频繁,每次发作时间增长,甚至有些患者通过药物无法控制眼压,需要滤过性手术治疗[1]。关于其确切病因尚不清楚。有几项研究[2-3]显示,在部分PSS患者的房水中检测到巨细胞病毒(cytomegalovirus,CMV),并表明CMV在PSS的发病过程中起到一定作用。临床上将受到CMV感染及未受CMV感染的PSS患者区分开来是极为重要的,因为对于CMV感染患者而言,如果单纯使用糖皮质激素(简称激素)而不结合抗病毒药物会加重病情或者增加疾病发作率。然而,目前对于判断PSS患者是否伴有CMV感染的常用方法是使用聚合酶链反应(transcriptional polymerase chain reaction, PCR)检测眼内抗体含量,但此方法较为昂贵并且不一定对所有的患者都适用,阳性率也不高。故本试验的研究目的在于,结合PCR及CMV抗体眼内生成2种方法来比较CMV阳性及阴性PSS患者临床特点的差异,旨在探究在取样诊断之前获取有助于鉴别的临床体征。
1 资料与方法
1.1 资料 选取在本科就诊的PSS患者。诊断依据:眼压反复升高,每次均>21 mmHg(1 mmHg=0.133 kPa), 发作间期眼压正常;伴有较轻微的前房炎症,裂隙灯下可见细小的角膜后沉着物(keratic precipiates, KP),房角开放,未发作眼的眼压、视野和视盘均正常[4]。所有患者均有既往发作史,且本次发作之前已接受局部激素、降眼压药物治疗,但未接受全身或局部抗病毒治疗。对患者进行详细的眼部检查,包括视力、眼压、裂隙灯检查、眼底、视野检查、角膜内皮细胞计数等,询问病史尤其是总病程和本次发作时间,记录一般资料,征得患者同意后抽取部分前房水进行病毒检测。
1.2 房水取材方法 有坐位和卧位取材2种方法。坐位取材:患者表面麻醉后,开睑器开睑,将下颌置于裂隙灯的颌托,前额贴紧固定带,弥散光直接照明角膜区域;一手拿棉签固定眼球,一手拿1 mL空针从角膜缘穿刺进入前房,抽取约0.1 mL房水;拔出针头,抗生素滴眼液冲洗结膜囊。卧位取材:患者平卧于手术床,在手术显微镜下进行操作,用1 mL空针前房穿刺抽取房水,方法同坐位。
1.3 房水病毒检测方法
1) 房水和血清CMV IgG抗体的测定。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒(Virion/Serion,德国)检测受检者房水及血清中CMV IgG抗体。检测步骤根据试剂盒说明书进行操作。酶标仪型号为Tecan Sunrise(TECAN贸易有限公司,瑞士)。房水检测的吸光度(optical density, OD)值大于年龄相关性白内障对照组样本的基准值,即平均OD值加2倍标准差(95%可信限)为检出,小于或与其相等时为未检出。同时采用散射免疫比浊法测定(Nephstar, Goldsite Diagnostics,中国)房水及血清中的白蛋白浓度。房水中检出的CMV IgG抗体以房水/血清白蛋白比值进行校正。校正比值的计算公式:(房水CMV IgG/血清CMV IgG)/(房水白蛋白浓度/血清白蛋白浓度)。当房水中检出CMV IgG,且房水/血清校正比值大于受试者工作特征曲线(ROC曲线)计算出的最佳界值时,可认为有眼内CMV IgG抗体生成。
2)房水病毒DNA的检测。采用DNA抽提试剂盒(FlexiGene DNA试剂盒,QIAGEN)从房水中提取病毒DNA,检测步骤根据试剂盒说明书进行。采用PG biotech 人巨细胞病毒(human CMV, HCMV)核酸扩增荧光检测试剂盒,使用实时PCR进行CMV DNA检测。
3)PSS患者CMV阳性及阴性组定义。DNA结果及眼内CMV IgG抗体生成任一阳性则归为CMV阳性组,两者均阴性归为CMV阴性组。
1.4 统计学处理 应用SPSS 20.0软件对所有数据进行处理分析。对CMV阳性组和阴性组之间性别、眼别、是否合并视野损害、合并虹膜损害、合并白内障、KP的比较用Fisher精确检验;对2组间年龄、视力、眼压、杯盘比大小、病程、发作时间、角膜内皮计数的比较用独立样本t检验;P<0.05为差异有统计学意义。
2 结果
2.1 受试者临床资料 病例资料的收集时间为2014年1月~2015年12月,期间共有26例PSS患者入选本试验。其中男∶女=18∶8,平均年龄为(44.9±14.5)岁,右眼∶左眼=13∶13,最佳矫正视力为0.3±0.2,平均眼压为(32.9±14.7)mmHg,杯盘比为0.7±0.2。在入选患者中,76.9%合并视野损害,34.6%合并虹膜损害,80.8%表现KP阳性,38.5%合并白内障。平均总病程为(6.1±10.6)年,本次发作的持续时间为(2.8±1.8)个月,其中发作眼角膜内皮细胞数为(2 095±394)个/mm2,对侧眼角膜内皮细胞数为(2 643±295)个/mm2。57.7%(15/26)患者CMV检测阳性,其中房水抗体阳性的患者血清抗体均同时阳性,房水抗体阴性的患者血清抗体均同时阴性。单纯疱疹病毒、带状疱疹病毒等其他病毒检测结果均阴性。
2.2 CMV阳性和阴性患者临床特征分析 比较CMV阳性组及阴性组的临床特点发现,CMV阳性组的平均眼压为(39.5±12.6)mmHg,高于CMV阴性组的平均眼压(23.9±12.7)mmHg,差异有统计学意义(P=0.005)。另外,CMV阳性组发作眼与对侧眼的角膜内皮细胞数差明显高于CMV阴性组,差异有统计学意义(P=0.006)。其他各项临床指标在2组间差异均无统计学意义(表1)。
2.3 CMV阳性患者临床资料 15例CMV阳性患者的详细临床资料包括年龄、性别、眼别、视力、眼压、杯盘比、是否合并视野损害、合并虹膜损害、是否有KP表现、是否并发白内障、总病程及本次发作持续时间、发作眼及对侧眼的角膜内皮细胞数,以及发作眼与对侧眼角膜内皮细胞数差(表2)。
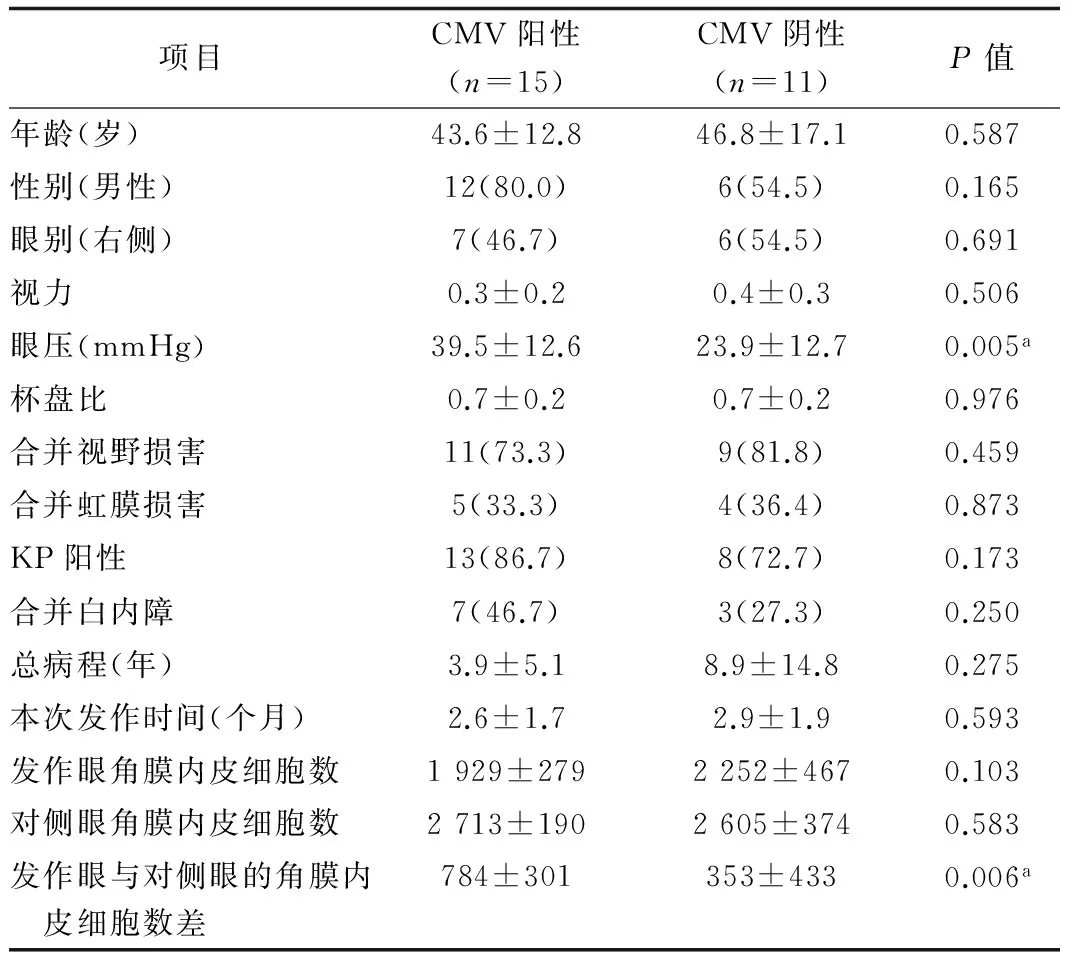
表1 CMV阳性和阴性患者临床特征分析[n(%)]
注:a示P<0.01,2组间差异具有统计学意义
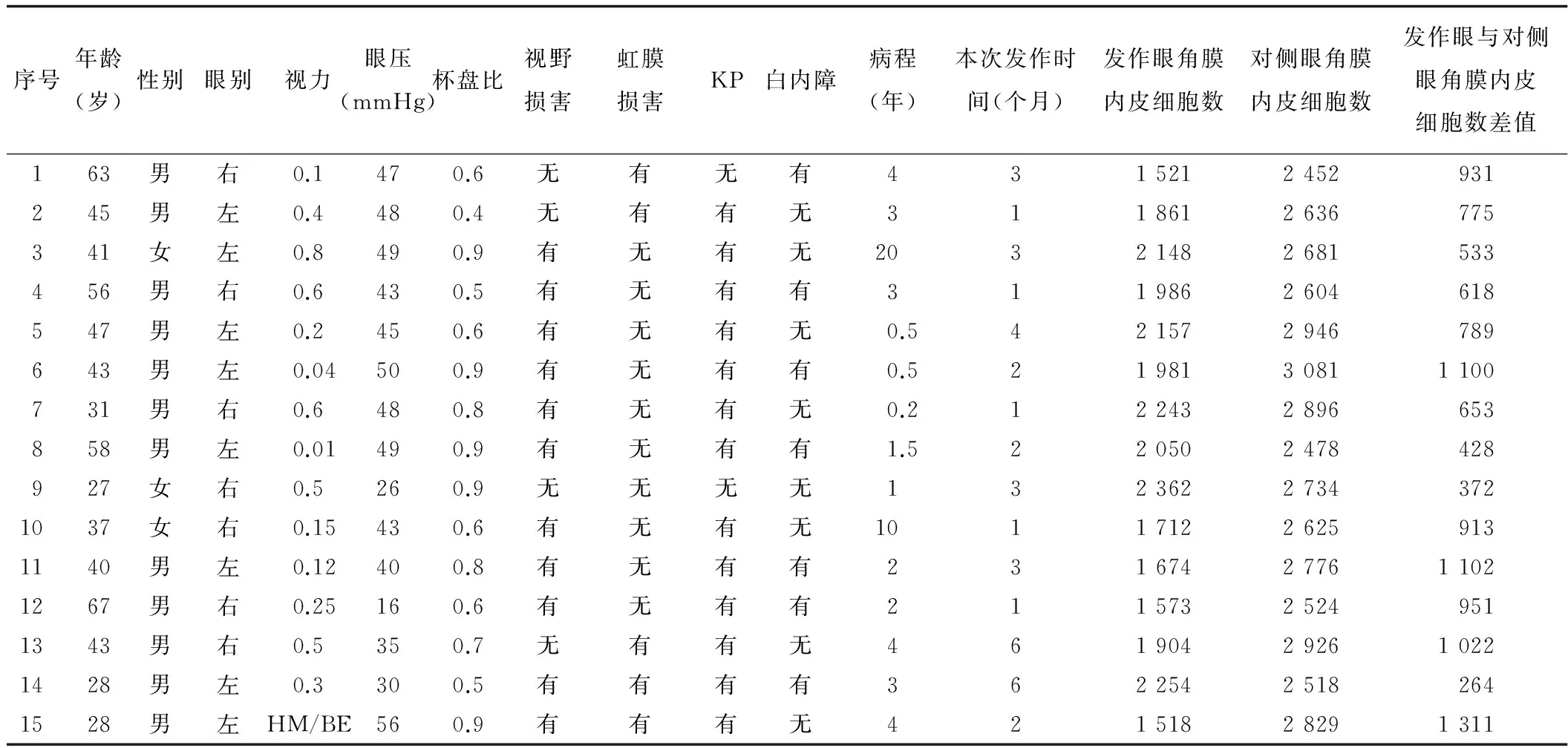
表2 CMV阳性患者临床特征分析
注:HM/BE为眼前手动
3 讨论
CMV为一种β疱疹病毒,是人群中非EB病毒感染性单核细胞增多症的主要原因[5]。在免疫缺陷人群中,尤其是CD4细胞少的人可以导致严重的视网膜炎;在免疫功能正常的人群中,其受累部位主要为眼前节,可表现为反复发作的虹膜炎伴有眼压升高,类似PSS[2,6]。多项研究表明,CMV在PSS的发生中起到重要作用。本试验主要探讨了CMV阳性及阴性PSS患者临床特征的差异性,以利于临床医师更好地鉴别及诊治此类疾病。
本研究中PSS患者按照临床诊断标准严格准入,其中首次诊断时均进行了裂隙灯下KP检查和角膜内皮细胞检查。入选患者首诊角膜内皮细胞检查均为阴性,基本可排除Fuchs综合征或角膜内皮炎继发的青光眼。另外,由于本次研究选取的多为病情迁延不愈或眼压难以控制需要滤过性手术的患者,均为多次就诊,因此病情相对较重。已有研究[4,7]证明,随着病程延长,病情加重,PSS患者视野损害、晶状体混浊的发生率也会增加。
本试验收集的所有PSS患者中,房水CMV的阳性率为57.7%, 这与Chee等[8]报道的阳性率相近。比较2类PSS患者的临床特点发现,CMV阳性组的平均眼压显著高于CMV阴性组的平均眼压。在本试验中,2组患者均有既往发作史,且本次发作均已接受局部激素及降眼压药物治疗,未接受过局部或全身抗病毒治疗。Sobolewska等[9]研究发现,服用缬更昔洛韦对CMV阳性的PSS患者进行治疗,1周后平均眼压从(45±9)mmHg下降至(16±10)mmHg,并且在为期14个月的抗病毒治疗中,63.6%的患者眼前节炎症得到一定的控制并且眼压保持相对稳定状态。这在一定程度上同本试验的研究结果相对应,说明对于PSS患者单纯使用激素及降眼压药物不能控制疾病的发展,甚至会加重感染,眼压也不能得到良好的控制,并提示临床医师对于此类用药效果不佳且反复发作的PSS患者应高度怀疑是否合并CMV感染,应做相关检测并考虑联合抗病毒感染治疗。
另外,本研究发现CMV阳性组发作眼的内皮细胞数为(1 929±279)个/mm2, 且与对侧眼角膜内皮细胞数差值显著高于CMV阴性组,说明在CMV感染的PSS患者中出现了较为严重的角膜内皮细胞损伤和丢失,故角膜内皮细胞的丢失数目有可能成为PSS患者是否合并CMV感染潜在的诊断因子。2006年Koizumi等[10]首次报道了由CMV引起的角膜内皮炎,并提出了CMV性角膜内皮炎的诊断标准。目前,有关此类疾病有越来越多的临床证据在不断积累,诊断依据包括房水PCR检测有CMV感染,临床特点包括80.2%的患者为男性,角膜内皮钱币样损伤,内皮细胞密度显著减小,角膜表现为从局灶性角膜水肿到弥漫性大泡性角膜病变不等,且患者在发生角膜内皮炎之前首先出现了高眼压性眼前节葡萄膜炎。如Fuchs虹膜异色性睫状体炎或者PSS, 表现为呈丝状或中等大小的色素性KP,前房有轻度炎症反应,75%的患眼发生了晶状体混浊,且平均眼压为40.85 mmHg,并且对更昔洛韦的治疗呈现较好的反应,用药一段时间后房水病毒检测为阴性[7,10-12]。本试验收集的PSS患者总病程较长,发作次数较多,且CMV阳性的PSS 患者80%为男性,平均眼压为(39.5±12.6)mmHg,伴发有反复发作的慢性眼前节葡萄膜炎,并未使用抗病毒药物治疗,故此组患者多并发CMV性角膜内皮炎,引起内皮细胞的损伤和丢失。然而,本试验存在一定的局限性,包括未能对CMV阳性PSS患者的角膜表现、虹膜及KP特点做详细的记录和分析。在后续研究中将对CMV阳性PSS患者使用抗病毒药物治疗之后的情况进行进一步的随访分析,探究用药效果。
综上所述,CMV阳性与阴性的PSS患者在眼部临床表现上有所差异,在使用激素及降眼压药物局部治疗之后,CMV阳性组患者的眼压未能得到有效控制,并且反复发作后可并发CMV性角膜内皮炎,引起角膜内皮细胞数目的减少和特征性的损害,成为与CMV阴性PSS患者重要的鉴别要点。这2组患者的鉴别对临床医师找到该病的病因,做出相应的检测并考虑是否联合使用抗病毒药物治疗尤为重要,可避免对于CMV感染患者单纯应用激素反而加重发作频次和疾病进展的风险。
[1] Posner A, Schlossman A. Syndrome of unilateral recurrent attacks of glaucoma with cyclitic symptoms[J]. Arch Ophthal, 1948, 39(4): 517-535.
[2] Teoh SB, Thean L, Koay E. Cytomegalovirus in aetiology of Posner-Schlossman syndrome: evidence from quantitative polymerase chain reaction[J]. Eye (Lond), 2005, 19(12): 1338-1340.
[3] Bloch-Michel E, Dussaix E, Cerqueti P, et al. Possible role of cytomegalovirus infection in the etiology of the Posner-Schlossmann syndrome[J]. Int Ophthalmol, 1987, 11(2): 95-96.
[4] Jap A, Sivakumar M, Chee SP. Is Posner-Schlossman syndrome benign?[J]. Ophthalmology, 2001, 108(5): 913-918.
[5] Sinclair J, Sissons P. Latent and persistent infections of monocytes and macrophages[J]. Intervirology, 1996, 39(5-6): 293-301.
[6] Chee SP, Bacsal K, Jap A, et al. Clinical features of cytomegalovirus anterior uveitis in immunocompetent patients[J]. Am J Ophthalmol, 2008, 145(5): 834-840.
[7] Shiraishi A, Hara Y, Takahashi M, et al. Demonstration of "owl’s eye" morphology by confocal microscopy in a patient with presumed cytomegalovirus corneal endotheliitis[J]. Am J Ophthalmol, 2007, 143(4): 715-717.
[8] Chee SP, Jap A. Presumed fuchs heterochromic iridocyclitis and Posner-Schlossman syndrome: comparison of cytomegalovirus-positive and negative eyes[J]. Am J Ophthalmol, 2008, 146(6): 883-889.e1.
[9] Sobolewska B, Deuter C, Doycheva D, et al. Long-term oral therapy with valganciclovir in patients with Posner-Schlossman syndrome[J]. Graefes Arch Clin Exp Ophthalmol, 2014, 252(1): 117-124.
[10] Koizumi N, Yamasaki K, Kawasaki S, et al. Cytomegalovirus in aqueous humor from an eye with corneal endotheliitis[J]. Am J Ophthalmol, 2006, 141(3): 564-565.
[11] Koizumi N, Suzuki T, Uno T, et al. Cytomegalovirus as an etiologic factor in corneal endotheliitis[J]. Ophthalmology, 2008, 115(2): 292-297.e3.
[12] Suzuki T, Hara Y, Uno T, et al. DNA of cytomegalovirus detected by PCR in aqueous of patient with corneal endotheliitis after penetrating keratoplasty[J]. Cornea, 2007, 26(3): 370-372.
