东北山核桃壳黄酮对小鼠氧化损伤的防御作用
2018-03-20张金堂夏广军徐红艳
张金堂,沙 迪,夏广军,徐红艳*
(延边大学农学院,吉林 延吉 133002)
山核桃(Juglans mandshurica),别名核桃楸、胡桃楸,其叶、树皮、根及果实均可入药[1-2],具有抗肿瘤、抑菌、抗氧化等作用[3-4],在传统中药方面应用广泛。黄酮类化合物广泛分布于各种植物[5],具有良好的生物活性[6-7],能清除生物体内的自由基,同时具有氧化损伤保护作用,又具有很多重要的药理作用,流行病学调查也显示,日常餐饮中黄酮类化合物的摄入有益健康并可降低慢性疾病的发生[8]。
在正常情况下,机体自由基能维持在损伤阈值以下的平衡态,但很多因素都能造成机体的氧化损伤,如乙醇、H2O2、辐射等,使机体产生过量的自由基,引起氧化应激[9]。尽管有研究表明,哺乳动物的机体具有某些抵抗和减少氧化损伤的防御机制,但活性氧自由基高度活化,能够破坏脂类、蛋白质和DNA、RNA等生物分子[10],从而导致癌症、动脉粥样硬化、组织器官老化、炎性疾病等的发生[11],给人类健康带来很大的潜在危害。
东北山核桃仁营养价值很高,近年来成为研究和关注的热点。山核桃壳是加工核桃仁过程中产生的副产物,部分用于加工工艺品或制备活性碳,关于其中活性成分研究报道较少,而有关东北山核桃壳黄酮(flavonoids from seed shells of Juglans mandshurica,FSSJM)氧化损伤防御作用的研究鲜见报道。本课题组前期研究发现,FSSJM具有显著的清除2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和羟自由基作用[12],基于其显著的体外抗氧化效果,本研究以东北山核桃壳为原料,提取总黄酮,经分级萃取和柱层析纯化提高纯度,采用X射线制造氧化损伤模型,并通过小鼠体内实验,采用分光光度法、形态学法和免疫组化法,进一步探索其体内氧化损伤防御作用,旨在为东北山核桃壳生理活性物质的深入挖掘和坚果加工副产物的应用和产品开发提供参考及新思路。
1 材料与方法
1.1 动物、材料与试剂
健康雄性SPF级昆明小鼠,体质量(20±2)g,购于延边大学实验动物中心。
FSSJM(纯度54%)按本课题组前期研究方法制备[12]。
盐酸小檗胺片(批号:151101) 四川中方制药有限公司;还原型谷胱甘肽(glutathione,GSH)标准品上海源叶生物科技有限公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)和丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所;兔抗Bax、Bcl-2美国Cell Signaling Technology公司;链霉亲和素-生物素复合物(streptavidin-biotin complex,SABC)免疫组化染色试剂盒、二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色试剂盒 美国博士德生物工程有限公司。
1.2 仪器与设备
Z400K型速冻离心机 德国Hermle公司;U-3900型紫外-可见分光光度计 日本日立公司;Elekta CompactTM医用直线加速器 医科达北研(北京)医疗器械有限公司。
1.3 方法
1.3.1 小鼠辐射诱导氧化损伤模型的建立
将60 只雄性的昆明小鼠随机分为6 组,正常组和模型组(0.125%羧甲基纤维素),FSSJM低、中、高剂量组(X射线+100、200、400 mg/(kg·d)),阳性对照组(X射线+盐酸小檗胺片56 mg/(kg·d))。每3 d测体质量,连续灌胃14 d后,采用医用直线加速器一次性全身X射线照射,源皮距95 cm,剂量吸收率1 Gy/min,照射总剂量4 Gy。
1.3.2 血清及肝匀浆的制备
小鼠X射线照射24 h后,眼球采血,4℃、4 000 r/min离心10 min,上清液4 ℃保存。小鼠处死后迅速取肝脏制成质量分数10%匀浆,4 ℃、3 500 r/min离心10 min,取上清液,-80 ℃冰箱保存。
1.3.3 抗氧化酶活力的测定
小鼠肝脏和血清中SOD、GSH-Px、CAT活力的测定均按照试剂盒说明书进行操作。
1.3.4 MDA含量的测定
采用硫代巴比妥酸显色法,按照试剂盒说明书进行操作。
1.3.5 GSH标准曲线绘制及含量测定
采用5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)法[13],分别取1 mmol/L的GSH标准品溶液0.00、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40 mL,加三蒸水至0.5 mL,再分别加4.0 mL磷酸盐缓冲液(phosphate buffered saline,PBS)、0.5 mL DTNB试剂,充分混匀,5 min内于412 nm波长处测定吸光度,以三蒸水调零,以GSH含量为x轴,吸光度为y轴,绘制标准曲线,方程为y=0.013 4x-0.002 8,R2=0.998 3。将制备好的肝匀浆与20%三氯乙酸溶液2∶1(V/V)混匀,4 000×g离心10 min,收集上清液,按标准曲线方法测定,并计算样品中GSH的含量。
1.3.6 形态学观察
X射线照射14 d后处死小鼠,迅速取肝脏,体积分数10%甲醛固定,经脱水、透明,石蜡包埋,制为5 μm切片,苏木精-伊红(hematoxylin-eosin,HE)染色后镜检。
1.3.7 免疫组化检测
X射线照射14 d后处死小鼠,迅速取肝脏和脾脏,体积分数4%多聚甲醛溶液固定,经脱水、透明、浸蜡、包埋,制为4 μm切片,烤片过夜,脱蜡。然后滴加体积分数3% H2O2溶液,室温孵育10 min,PBS清洗;滴加5%牛血清白蛋白封闭液,37℃下孵育20 min,甩干;滴加一抗,4 ℃下孵育过夜,PBS清洗;滴加二抗,37 ℃孵育30 min,PBS清洗;滴加SABC,37 ℃孵育30 min,PBS清洗;滴加DAB显色,苏木精复染2 min,脱水,中性树胶封片,镜检。
1.4 数据统计分析
2 结果与分析
2.1 FSSJM对小鼠血清中SOD、GSH-Px、CAT活力及MDA含量的影响
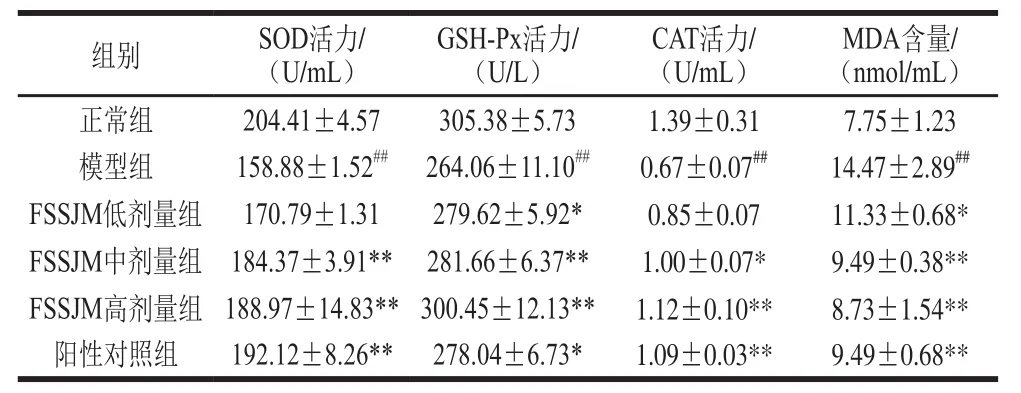
表1 FSSJM对小鼠血清中SOD、GSH-Px、CAT活力及MDA含量的影响Table1 Effect of FSSJM on SOD, GSH-Px and CAT activity and MDA content in serum of mice
由表1可知,与正常组相比,模型组小鼠血清中SOD、GSH-Px、CAT活力极显著降低(P<0.01),MDA含量极显著升高(P<0.01),表明辐射诱导的氧化损伤造模成功。与模型组相比,FSSJM中、高剂量组和阳性对照组SOD活力极显著升高(P<0.01);低剂量组和阳性对照组GSH-Px活力显著升高(P<0.05),中、高剂量组GSH-Px活力极显著升高(P<0.01);中剂量组CAT活力显著升高(P<0.05),高剂量组和阳性对照组CAT活力极显著升高(P<0.01);低剂量组MDA含量显著降低(P<0.05),中、高剂量组和阳性对照组MDA含量极显著降低(P<0.01)。表明FSSJM能够调节氧化损伤小鼠血清中抗氧化酶活力,并下调脂质过氧化产物MDA的含量。
2.2 FSSJM对小鼠肝脏SOD、GSH-Px、CAT活力及MDA、GSH含量的影响

表2 FSSJM对小鼠肝脏SOD、GSH-Px、CAT活力及MDA、GSH含量的影响Table2 Effect of FSSJM on SOD, GSH-Px and CAT activity and MDA and GSH contents in liver of mice
由表2可知,与正常组相比,照射后小鼠肝脏中SOD、GSH-Px、CAT活力和GSH含量极显著降低(P<0.01),MDA含量极显著升高(P<0.01),表明辐射诱导的氧化损伤造模成功。与模型组相比,FSSJM中、高剂量组和阳性对照组的SOD和CAT活力显著升高(P<0.05),MDA含量显著降低(P<0.05);低剂量组GSH-Px活力显著升高(P<0.05),中、高剂量组和阳性对照组GSH-Px活力极显著升高(P<0.01);低剂量组GSH含量显著升高(P<0.05),高剂量组和阳性对照组GSH含量极显著升高(P<0.01)。表明FSSJM能够调节氧化损伤小鼠肝脏中抗氧化酶活性,上调内源性抗氧化物质GSH的含量,并下调脂质过氧化产物MDA的含量。
2.3 FSSJM对小鼠肝脏组织形态的影响
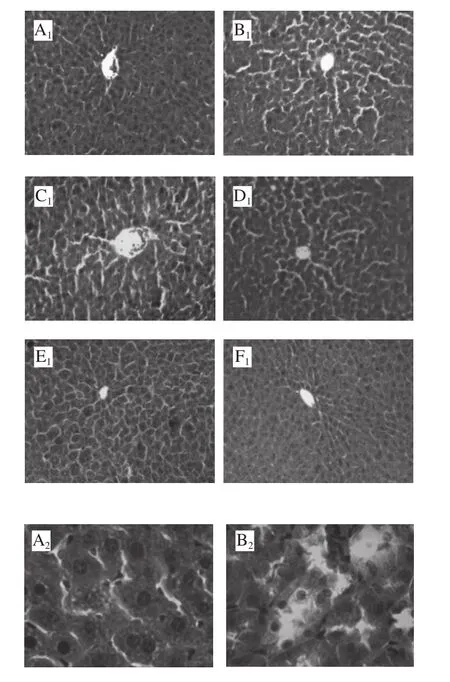

图1 FSSJM对小鼠肝脏组织形态学变化的影响Fig.1 Effect of FSSJM on morphological changes in liver tissues of mice
如图1A1~F1所示,与正常组比较,模型组细胞索排列紊乱,细胞受损严重,肝细胞大小不一致,出现浓缩坏死现象,导致窦周间隙变大;FSSJM各剂量组均不同程度优于模型组,窦周间隙逐渐变小,阳性对照组接近正常组水平。
如图1A2~F2所示,正常组小鼠肝细胞大小一致,核结构清晰,无明显病变;模型组肝脏组织细胞损伤严重,部分细胞浓缩坏死,界限不清,出现颗粒变性;FSSJM低、中、高剂量组及阳性对照组出现双核现象,表明细胞再生,导致细胞肿胀,窦周间隙变窄;与模型组相比,中、高剂量组和阳性对照组细胞索排列整齐,核结构清晰,细胞损伤减少。表明FSSJM能够明显改善辐照小鼠肝脏组织的损伤。
2.4 FSSJM对小鼠肝脏Bax和Bcl-2蛋白表达的影响
如图2所示,正常组肝脏切片未见棕黄色区域(图中未能显示,下同),为Bax蛋白阴性表达。模型组可见大量棕黄色区域,且着色较深,为Bax蛋白强阳性表达。与模型组相比,FSSJM低、中剂量组Bax蛋白阳性细胞明显减少,高剂量组和阳性对照组Bax阳性细胞进一步减少,且着色较浅、分布均匀,为Bax蛋白阴性表达。表明FSSJM可下调辐射诱导的氧化损伤小鼠肝细胞Bax蛋白的表达。

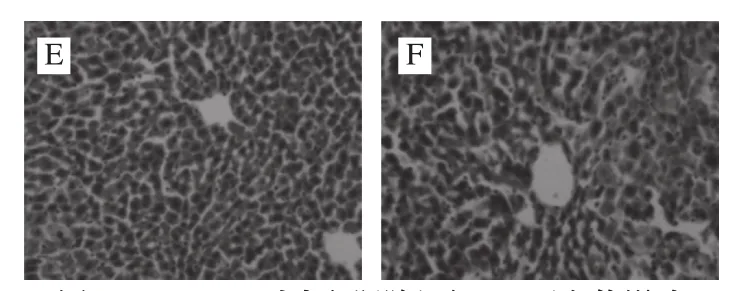
图2 FSSJM对小鼠肝脏组织Bax蛋白的影响Fig.2 Effect of FSSJM on Bax protein expression in liver tissues of mice

图3 FSSJM对小鼠肝脏组织Bcl-2蛋白的影响Fig.3 Effect of FSSJM on Bcl-2 protein expression in liver tissues of mice
如图3所示,正常组小鼠肝脏组织可见大量棕黄色的Bcl-2阳性细胞,且着色较深,为强阳性表达;模型组肝脏组织棕黄色明显变淡,为Bcl-2蛋白弱阳性表达;与模型组相比,FSSJM中、高剂量组和阳性对照组可见较大面积棕黄色颗粒,为Bcl-2蛋白阳性表达。表明FSSJM可上调辐射诱导的氧化损伤小鼠的肝细胞Bcl-2蛋白的表达。
2.5 FSSJM对小鼠脾脏Bax和Bcl-2蛋白表达的影响
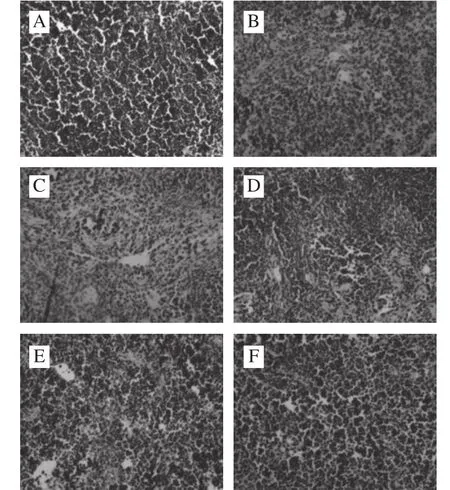
图4 FSSJM对小鼠脾脏组织Bax蛋白的影响Fig.4 Effect of FSSJM on Bax protein expression in spleen tissues of mice
如图4所示,正常组脾脏组织未见棕黄色区域,是Bax蛋白阴性表达。模型组可见大量棕黄色区域,且着色较深,为Bax蛋白强阳性表达。与模型组比较,FSSJM低、中、高剂量组和阳性对照组Bax蛋白阳性细胞不同程度地减少。表明FSSJM可下调辐射诱导的氧化损伤小鼠脾脏细胞Bax蛋白的表达。

图5 FSSJM对小鼠脾脏组织Bcl-2蛋白的影响Fig.5 Effect of FSSJM on Bcl-2 protein expression in spleen tissues of mice
如图5所示,正常组小鼠脾脏组织可见大量棕黄色区域,为Bcl-2蛋白强阳性表达;模型组肝脏组织仅有少数棕黄色细胞,为弱阳性表达;与模型组相比,FSSJM低、中、高剂量组和阳性对照组均可见不同面积的棕黄色区域。表明FSSJM可上调辐射诱导的小鼠脾脏细胞Bcl-2蛋白表达。
3 讨 论
X射线照射可电离机体内的水分子,产生过量自由基,使细胞发生氧化损伤[14],导致机体发生不同程度的病理和生化方面的改变[15],近几年成为氧化损伤研究中的造模方法之一[16],照射后,机体中抗氧化酶活力降低,脂质过所化产物含量升高[17]。SOD、GSH-Px和CAT是机体抗氧化酶系统清除氧自由基重要的酶[18]。GSH是反映非酶类抗氧化防御系统状态的一种多能防护物质[19];MDA是脂质过氧化作用的最终产物[20]。本研究中,模型组血清和肝脏中SOD、GSH-Px、CAT活力和GSH含量均显著低于正常组,MDA含量极显著高于正常组,与Bansal等[21]报道的小鼠照射后模型组CAT、SOD活力显著低于正常组、模型组MDA含量高于正常组的结果一致,表明小鼠氧化损伤模型构建成功。
医学研究证实,心血管疾病、肿瘤和衰老均与氧化损伤及自由基代谢失调有关。近几年天然植物活性物质在氧化应激的防护中逐步得到重视,植物黄酮作为具有强抗氧化作用的多酚类物质,显现出良好的效果。研究表明,黄酮类化合物对X射线、60Co γ射线诱导的氧化损伤都表现出显著的保护作用[16,22],可提高辐射后机体内源性抗氧化酶SOD、CAT及GSH-Px的活力、减少DNA损伤和对辐射敏感细胞的凋亡、降低细胞微核率,并调节机体氧化还原作用敏感通路[23],发挥良好的氧化损伤保护作用。本研究中,FSSJM可减缓X射线照射小鼠体质量的下降,不同程度地提高X射线照射小鼠体内的SOD、GSH-Px、CAT活力,降低MDA含量,增加内源抗氧化物质GSH的含量,从而使小鼠体内抗氧化能力得到增强,这与王文君等[24]的芦荟黄酮体内抗氧化活性的研究结果一致。表明FSSJM对辐射诱导的氧化损伤小鼠的抗氧化酶系统和非酶抗氧化系统都具有一定的保护作用。
研究发现,辐射会导致肝脏组织的退行性变化[25]。本研究显示FSSJM各剂量组的肝脏组织与模型组相比均得到不同程度的修复,与陈纯琦[26]研究的芸豆芽菜多酚修复过氧化损伤小鼠肝脏的结果基本一致。Bax是促凋亡因子,Bcl-2能够与自身或Bax分别形成同二聚体和异二聚体,从而对细胞的凋亡过程进行抑制[27]。研究显示,X射线照射会上调Bax蛋白表达、下调Bcl-2蛋白表达,促使细胞凋亡,而植物黄酮具有下调Bax蛋白和上调Bcl-2蛋白表达的作用[28]。本研究中模型组肝脏、脾脏细胞Bax蛋白高表达,Bcl-2蛋白低表达,FSSJM各剂量组肝脏、脾脏细胞Bax蛋白表达明显低于模型组,Bcl-2蛋白表达明显高于模型组,表明FSSJM通过下调Bax和上调Bcl-2蛋白表达,抑制细胞凋亡,从而有效保护小鼠肝脏和脾脏细胞遭受氧化损伤。
以上结果表明,FSSJM通过调节抗氧化酶系统和非酶抗氧化系统的机能、抑制细胞凋亡、修复受损的肝脏和脾脏组织而发挥氧化损伤的防御作用。
[1] GRAHAM J G, QUINN M L, FABRICANT D S, et al. Plants used against cancer: an extension of the work of Jonathan Hartwell[J].Journal of Ethnopharmacology, 2000, 73(3): 347-377. DOI:10.1016/S0378-8741(00)00341-X.
[2] MACHIDA K, YOGIASHI Y, MATSUDA S, et al. A new phenolic glycoside syringate from the bark of Juglans mandshurica MAXIM.var. sieboldiana MAKINO[J]. Journal of Natural Medicines, 2009,63(2): 220-222. DOI:10.1007/s11418-009-0312-1.
[3] 崔哲. 胡桃楸的研究进展[J]. 现代医药卫生, 2008, 24(20): 3061-3062.
[4] 房立君. 山核桃树皮治疗晚期消化道肿瘤的临床观察[J]. 中国民康医学, 2014, 26(4): 113-115. DOI:10.3969/j.issn.1672-0369.2014.04.053.
[5] 赵雪巍, 刘培玉, 刘丹, 等. 黄酮类化合物的构效关系研究进展[J]. 中草药, 2015, 46(21): 3264-3271. DOI:10.7501/j.issn.0253-2670.2015.21.025.
[6] SINGH M, KAUR M, SILAKARI O. Flavones: an important scaffold for medicinal chemistry[J]. European Journal of Medicinal Chemistry,2014, 84(18): 206-239. DOI:10.1016/j.ejmech.2014.07.013.
[7] 罗春丽, 王林, 李杏, 等. 紫薯花青素体外抗氧化及对H2O2诱导HepG2细胞氧化损伤的保护作用[J]. 食品科学, 2015, 36(17): 225-230. DOI:10.7506/spkx1002-6630-201517042.
[8] ERLUND I. Review of the flavonoids quercetin, hesperetin, and naringenin. dietary sources, bioactivities, bioavailability, and epidemiology[J]. Nutrition Research, 2004, 24(10): 851-874.DOI:10.1016/j.nutres.2004.07.005.
[9] ZHOU B H, ZHAO J, LIU J, et al. Fluoride-induced oxidative stress is involved in the morphological damage and dysfunction of liver in female mice[J]. Chemosphere, 2015, 139(11): 504-511. DOI:10.1016/j.chemosphere.2015.08.030.
[10] ZHAO H T, WANG Z Y, MA F M, et al. Protective effect of anthocyanin from Lonicera Caerulea var. Edulis on radiation-induced damage in mice[J]. International Journal of Molecular Sciences, 2012,13(9): 11773-11782. DOI:10.3390/ijms130911773.
[11] MARCIO C, ISABEL C F R F. A review on antioxidants, prooxidants and related controversy: natural and synthetic compounds,screening and analysis methodologies and future perspectives[J].Food and Chemical Toxicology, 2013, 51(1): 15-25. DOI:10.1016/j.fct.2012.09.021.
[12] 徐红艳, 褚凤艳, 包怡红. 胡桃楸种仁壳黄酮的纯化及抗氧化性研究[J]. 食品工业科技, 2012, 33(22): 113-118; 122. DOI:10.13386/j.issn1002-0306.2012.22.026.
[13] 陆文蔚, 闫军, 唐立伟. 保健品中谷胱甘肽的快速测定[J]. 食品与发酵工业, 2012, 38(2): 186-189. DOI:10.13995/j.cnki.11-1802/ts.2012.02.006.
[14] HOSSEINIMEHR S J. Trends in the development of radioprotective agents[J]. Drug Discovery Today, 2007, 12(19/20): 794-805.DOI:10.1016/j.drudis.2007.07.017.
[15] HU B, ZHANG X, OUYANG Q, et al. A prototype system to measure X-ray absorption spectra for diagnosis in vivo[J]. Measurement, 2016,93(11): 252-257. DOI:10.1016/j.measurement.2016.07.038.
[16] MATERSKA M, KONOPACKA M, JACEK R, et al. Antioxidant activity and protective effects against oxidative damage of human cells induced by X-radiation of phenolic glycosides isolated from pepper fruits Capsicum annuum L.[J]. Food Chemistry, 2015, 168(1): 546-553. DOI:10.1016/j.foodchem.2014.07.023.
[17] QI L, LIU C Y, WU W Q, et al. Protective effect of fl avonoids from Astragalus complanatus on radiation induced damages in mice[J].Fitoterapia, 2011, 82(3): 383-392. DOI:10.1016/j.f i tote.2010.11.015.
[18] HOSSEINIMEHR S J. Flavonoids and genomic instability induced by ionizing radiation[J]. Drug Discovery Today, 2010, 15(21/22): 907-918. DOI:10.1016/j.drudis.2010.09.005.
[19] SRINIVASAN M, KALPANA K B, DEVIPRIYA N, et al.Protective effect of lycopene on whole body irradiation induced liver damage of Swiss albino mice: pathological evaluation[J].Biomedicine & Preventive Nutrition, 2014, 4(2): 87-94. DOI:10.1016/j.bionut.2013.06.007.
[20] 高璐, 王滢, 饶胜其, 等. 葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J]. 食品科学, 2014, 35(23): 253-256. DOI:10.7506/spkx1002-6630-201423049.
[21] BANSAL P, PAUL P, KUNWAR A, et al. Radioprotection by quercetin-3-O-rutinoside, a flavonoid glycoside: a cellular and mechanistic approach[J]. Journal of Functional Foods, 2012, 4(4):924-932. DOI:10.1016/j.jff.2012.06.010.
[22] BANSAL P, PAUL P, NAYAK P G, et al. Phenolic compound isolated from Pilea microphylla prevent radiation-induced cellular DNA damage[J]. Acta Pharmaceutica Sinica B, 2011, 1(4): 226-235.DOI:10.1016/j.apsb.2011.10.006.
[23] PATWARDHAN R S, SHARMA D, CHECKER R, et al. Mitigation of radiation-induced hematopoietic injury via regulation of cellular MAPK/phosphatase levels and increasing hematopoietic stem cells[J].Free Radical Biology and Medicine, 2014, 68(3): 52-64. DOI:10.1016/j.freeradbiomed.2013.11.004.
[24] 王文君, 蔡教英, 蒋艳, 等. 芦荟黄酮体内抗氧化活性及对CAT mRNA表达的影响[J]. 中国食品学报, 2013, 13(10): 13-18.DOI:10.16429/j.1009-7848.2013.10.003.
[25] 李小雨. 元蘑多糖活性部位分析及对60Co-γ辐射损伤的防护作用[D].哈尔滨: 哈尔滨工业大学, 2013: 93-95.
[26] 陈纯琦. 芸豆芽菜多酚的提取纯化及抗氧化活性研究[D]. 大庆: 黑龙江八一农垦大学, 2016: 35-46.
[27] POLJICANIN A, VUKUSIC P T, VUKOJEVIC K, et al. The expression patterns of proapoptotic and anti-apoptotic factors in human fetal and adult ovary[J]. Acta Histochemica, 2013, 115(6): 533-540.DOI:10.1016/j.acthis.2012.11.009.
[28] CHUSATTAYANOND A D, BOONSILP S, KASISIT J, et al. Thai Acanthamoeba isolate (T4) induced apoptotic death in neuroblastoma cells via the Baxmediated pathway[J]. Parasitology International,2010, 59(4): 512-516. DOI:10.1016/j.parint.2010.06.007.
