T-2毒素对凡纳滨对虾DNA黏度损伤效应
2018-03-20宁守强王雅玲王小博孙力军郭俊豪潘晓梅励建荣
宁守强,王雅玲,*,王小博,邱 妹,孙力军,郭俊豪,潘晓梅,励建荣*
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,广东 湛江 524088;2.渤海大学 辽宁省食品安全重点实验室,辽宁 锦州 121013)
T-2毒素是单端孢霉烯族毒素之一。该毒素毒性强烈,在自然界中广泛存在,严重危害人畜健康[1]。T-2毒素的化学性质稳定,有研究报道T-2毒素常温放置6~7 年或高温至200 ℃,毒力仍无减弱[2]。T-2毒素可通过污染动植物性食品而进入食物链,主要危害动物的造血组织和免疫器官,引起出血性综合征,出现白细胞减少、贫血,使胃肠道功能受损等[3-4]。
目前研究发现T-2毒素可以通过诱导DNA链的断裂,破坏其完整性,抑制蛋白质合成,进而抑制DNA合成[5]。DNA作为大多数有毒有害小分子的作用靶分子,其分子结构及空间结构能否保持稳定和完整,对机体细胞活性和生理功能的正常发挥具有重要意义[6]。有研究表明多数小分子毒物可通过与DNA高度结合影响其空间结构[7]。李瑜等[8]发现农药西玛津可以使小牛胸腺DNA紫外光谱发生减色作用,并且还使得DNA的熔点和黏度增大。但是有关T-2毒素对DNA的互作信息鲜有报道。特别是本课题组前期研究发现T-2毒素染毒的对虾饲料可以抑制对虾生长[9],导致品质劣化[10],但是有关T-2毒素对凡纳滨对虾DNA黏度损伤效应鲜见报道。
T-2毒素的暴露剂量和DNA质量浓度及其二者互作的时间是揭示T-2对DNA黏度损伤效应的重要参数。科学的实验设计是揭示其作用规律的前提。响应面分析是一种应用较为广泛的试验优化方法,通过合理的试验设计,采用多元二次回归方程拟合,能以最为简单有效的方式对试验进行全面研究,是解决多因子问题的一种统计手段,从而确定最佳条件[11]。因此,本研究首先通过响应面法分析T-2毒素对小牛胸腺DNA的最适作用条件,再通过体外T-2毒素与对虾DNA作用验证,最后通过喂食对虾T-2毒素进行蓄积染毒后,进而揭示T-2毒素对对虾DNA黏度的影响。为阐明T-2毒素对对虾DNA的危害提供理论参考,并且对探讨T-2毒素的毒理作用具有一定的研究意义。
1 材料与方法
1.1 材料与试剂
鲜活凡纳滨对虾购自湛江东风市场。
海洋动物组织基因组DNA提取试剂盒 北京康为世纪生物科技有限公司;Tris 北京鼎国生物技术有限责任公司;氢氧化钠 西陇化工股份有限公司;T-2毒素(纯度≥99%) 美国Enzo公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
Centrifuge 5417R冷冻离心机 德国Eppendorf公司;TU-1901双光束紫外-可见分光光度计、乌氏黏度计 北京普析通用仪器有限责任公司;GelDoc 2000凝胶成像系统美国Bio-Rad公司;LS-B50L立式压力蒸汽灭菌器 上海华线医用核子仪器有限公司。
1.3 方法
1.3.1 单因素试验
取1.3 ng/mL T-2毒素4 μL和60 μg/mL小牛胸腺DNA 30 μL混合,用TE缓冲液定容至3 mL,反应时间为:1、5、10、20、30、40、50 min和60 min,考察反应时间对DNA黏度的影响;反应时间设为40 min,小牛胸腺DNA质量浓度60 μg/mL,T-2毒素质量浓度分别为0.15、0.70、1.30、2.70、3.50 ng/mL,考察T-2毒素质量浓度对DNA黏度的影响;反应时间40 min,T-2毒素质量浓度为2.70 ng/mL,小牛胸腺DNA质量浓度分别为30、40、50、60、70、80 μg/mL,考察DNA质量浓度对黏度的影响。
1.3.2 响应曲面试验
在单因素试验基础上,选取T-2毒素质量浓度(A)、DNA质量浓度(B)、反应时间(C)共3 个因子,以DNA的A260nm为响应值,采用三因素三水平的响应面分析法,得到二次回归方程,并找出最佳的试验条件。
1.3.3 T-2毒素经口染毒对虾实验
采用微胶囊毒饵料制备技术[12]分别配制T-2毒素的含量为12.2、4.8、2.4、1.2 mg/kg和0.5 mg/kg的对虾毒饵料;设置未染毒对虾为空白对照组,对凡纳滨对虾进行饲喂,周期为20 d。
1.3.4 对虾肌肉和肝胰腺DNA提取和检测
海洋动物组织基因组DNA提取试剂盒法提取对虾肌肉和肝胰腺的DNA:其中要求无水乙醇在-20 ℃中预冷后使用,提取后的DNA于-20 ℃中保存。
凝胶电泳法检测提取的DNA质量浓度,采用1%琼脂糖,凝胶厚度3~5 mm,80 V电泳40 min。
吸光度法测定对虾肌肉和肝胰腺的DNA质量浓度:取30 μL DNA提取物,用TE缓冲液稀释10 倍,分别测定其在260 nm和280 nm波长处的吸光度。A260nm/A280nm在1.8~2.0之间说明基本不含蛋白质,其纯度满足实验要求。按下式计算DNA质量浓度。
DNA质量浓度/(ng/μL)=50×A260nm×稀释倍数
1.3.5 DNA黏度的测定
根据响应面试验优化的条件,将50 μg/mL对虾肝胰腺DNA以及稀释10 倍的肝胰腺和肌肉原DNA提取液,体外分别与3.50、2.70、1.30、0.70、0.15 ng/mL T-2毒素反应,反应时间为43 min,乌氏黏度计法检测DNA黏度。
第21天分别提取染毒对虾肝胰腺的DNA,调整DNA质量浓度50 μg/mL,乌氏黏度计法检测DNA黏度。分析对虾DNA黏度变化与T-2毒素暴露剂量之间的相关性。
将乌氏黏度计置于25 ℃恒温水浴锅中,分别测定TE缓冲液、DNA溶液和T-2毒素-DNA混合液流经毛细管达到热平衡点所用时间。以(η/η0)1/3分别对反应时间、T-2毒素质量浓度、DNA质量浓度作图,得到DNA黏度变化趋势(η为T-2毒素-DNA混合液黏度;η0为溶剂黏度)。
1.4 数据统计分析
采用SPSS 19.0软件进行单因素方差分析,P<0.05时认为组间差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 反应时间对DNA黏度的影响
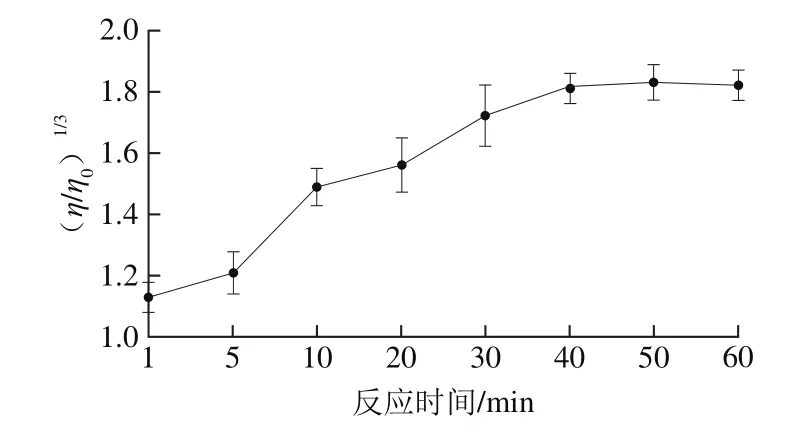
图1 反应时间对DNA黏度的影响Fig.1 Effect of incubation time on the viscosity of DNA
由图1可以看出,随着反应时间的延长DNA黏度增加,反应40 min时,DNA黏度趋于最大值,此后随时间延长DNA黏度几乎无变化。DNA黏度与反应时间成正比,在一定时间范围内,反应时间越长DNA黏度升高越明显,最终随着反应的完成,DNA黏度几乎不再发生变化,并且随着反应时间的延长还可能引起DNA分解,因此本实验选择反应时间为40 min。
2.1.2 T-2毒素质量浓度对DNA黏度的影响
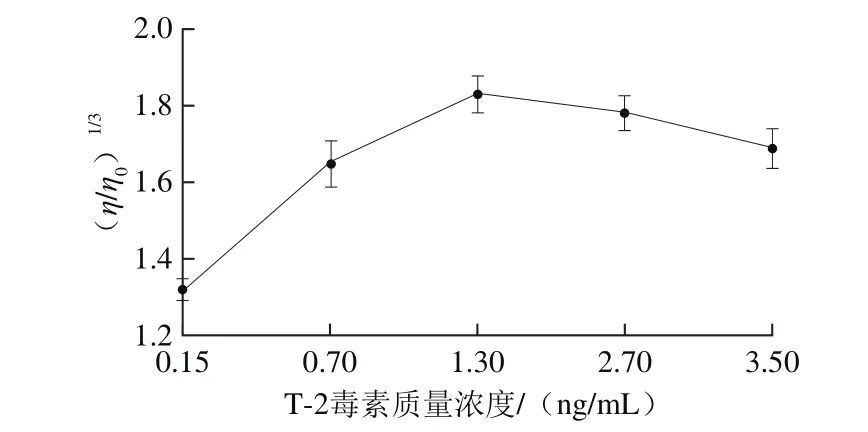
图2 T-2毒素质量浓度对DNA黏度的影响Fig.2 Effect of T-2 toxin concentration on the viscosity of DNA
由图2可知,当DNA质量浓度为60 μg/mL时,DNA黏度随着T-2质量浓度升高明显增加,在1.30 ng/mL时,DNA黏度趋近于最大值,此后,随着T-2毒素质量浓度的升高DNA黏度下降。在此反应中,当T-2毒素为1.30 ng/mL时,其与DNA反应完全,DNA黏度达到最大值,因此本实验选择的T-2毒素质量浓度为1.30 ng/mL。
2.1.3 DNA质量浓度对DNA黏度的影响
由图3可知,在0~50 μg/mL范围内随着DNA质量浓度增加黏度升高,在50 μg/mL时DNA黏度达到最大值,此后随着质量浓度增加黏度降低。这可能是由于在50 μg/mL时T-2毒素对DNA的损伤作用最大,反应最完全,而随着DNA质量浓度的增大,T-2毒素完全反应,而未受损伤的DNA比例增加,故而造成黏度的下降;因此本实验选择的DNA质量浓度为50 μg/mL。
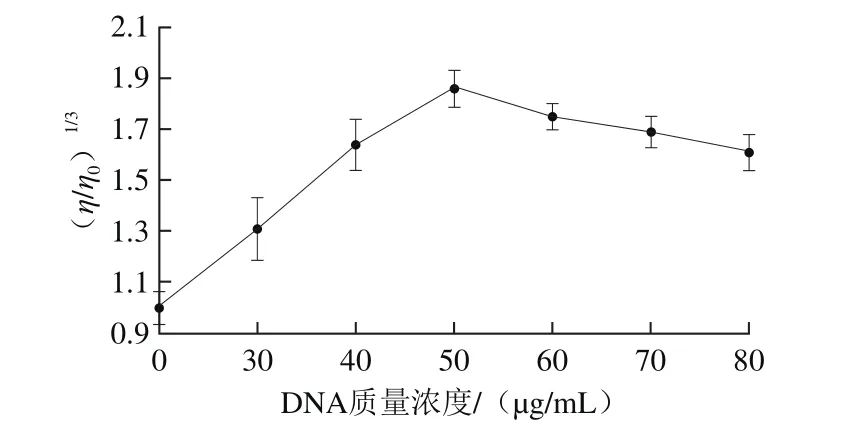
图3 DNA质量浓度对DNA黏度的影响Fig.3 Effect of DNA concentration on the viscosity of DNA
2.2 响应面试验结果
2.2.1 二次响应面回归方程的建立与分析

表1 响应面试验设计与结果Table1 Experimental design with results for response surface analysis
由表1可知,应用Design-Expert软件进行回归拟合分析,可得到T-2毒素质量浓度(A)、DNA质量浓度(B)、反应时间(C)与DNA黏度(Y)之间的二次多项式模型为:Y=1.96+0.069A-0.044B+0.030C+0.038AB+0.045AC+0.040BC-0.12A2-0.15B2-0.14C2。
由表2可知,回归模型具有高度显著性(P<0.000 1),失拟项不显著(P=0.654 3>0.05),R2=0.981 6,=0.957 9。说明方程对实验拟合较好[13-14]。变异系数(CV)反映模型的置信度,CV值越低,模型的置信度越高。本实验CV值为1.71%,说明其置信度较高,模型方程可以较好地反映真实的实验值,可用此模型分析相应值的变化。回归方程各项方差分析表明,因素A、B、A2、B2、C2对DNA黏度有极显著影响(P<0.01),因素C、AB、AC、BC对DNA黏度有显著影响(P<0.05)。
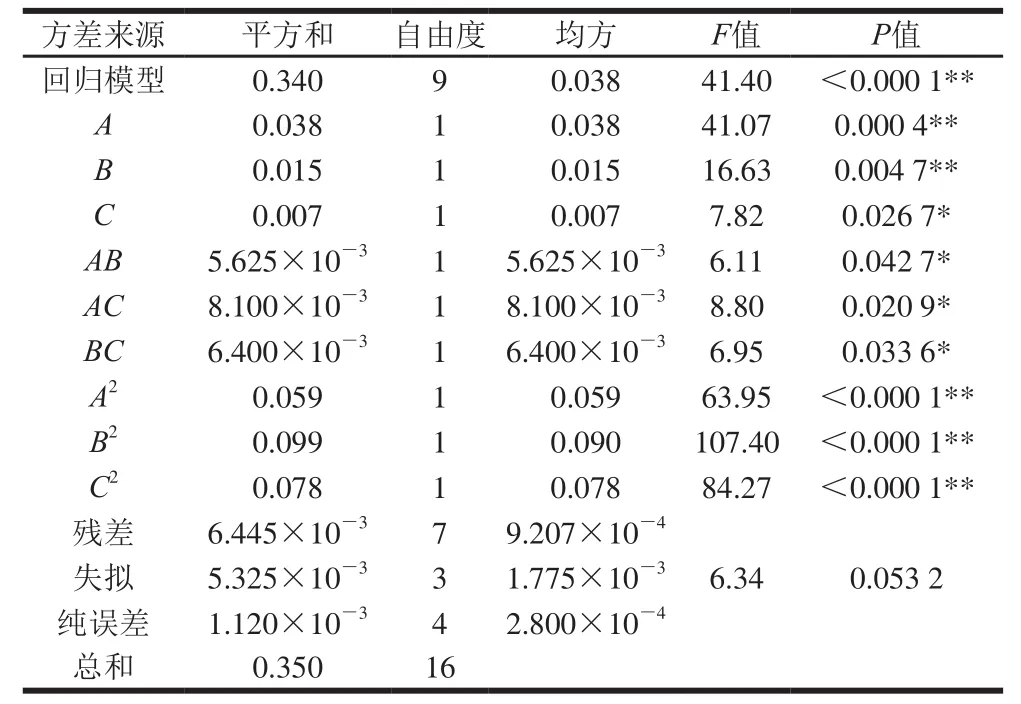
表2 回归方程系数显著性检验Table2 Significance test of regression equation coefficients
2.2.2 两因子交互作用分析
通过Design-Expert软件对各因素之间的交互作用进行响应面分析,绘制响应面曲线,显示了T-2毒素质量浓度、DNA质量浓度、反应时间中任意一个变量取零水平时,其余两个变量对DNA黏度的影响。其中等高线为椭圆形表示两因素交互作用显著[15]。由图4可知,T-2毒素质量浓度与DNA质量浓度、T-2毒素质量浓度与反应时间、DNA质量浓度与反应时间的交互作用对DNA黏度均有显著影响。
图4A为反应时间40 min时,T-2毒素质量浓度与DNA质量浓度对DNA黏度的交互作用。当DNA质量浓度一定时,在T-2毒素低质量浓度范围内,随着质量浓度增加DNA黏度先增加,当T-2毒素质量浓度超过一定值时,DNA黏度随之开始降低。T-2毒素质量浓度一定时,随着DNA质量浓度的增加,DNA黏度先增大,但当DNA质量浓度超过一定值时,DNA黏度呈下降趋势。图4B中当反应时间一定时,随着T-2毒素质量浓度增加,DNA黏度升高,当T-2毒素质量浓度超过一定值时,DNA黏度随之降低。图4C中,当反应时间一定时,随DNA质量浓度的增加,同样DNA黏度先升高后下降。
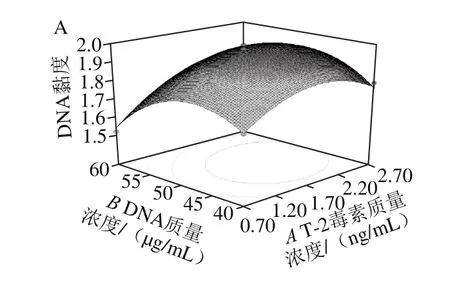
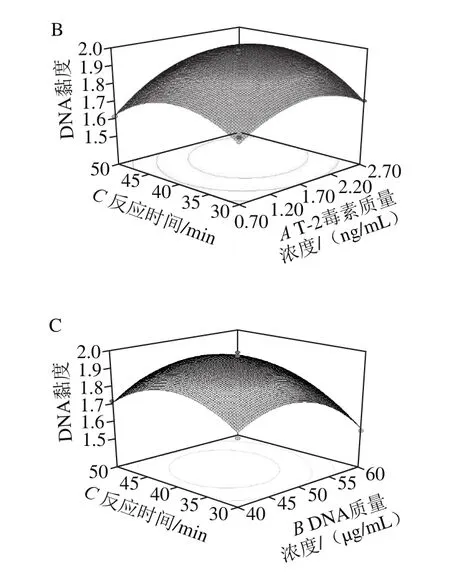
图4 任意两变量对DNA黏度影响的响应曲面图Fig.4 Response surface plots showing the interactive effects of variables on DNA viscosity
2.2.3 最佳条件的预测与验证
通过回归模型的预测,得到T-2毒素对DNA黏度影响最明显的条件为:T-2毒素质量浓度2.70 ng/mL、DNA质量浓度50.15 μg/mL、反应时间42.78 min。此时理论上最高的DNA黏度为1.924 9,结合实际调整实验条件为T-2毒素质量浓度2.70 ng/mL、DNA质量浓度50 μg/mL、反应时间43 min。在此条件下进行3 次重复实验,平均DNA黏度为1.850 0,实际值与预测值相差0.074 9,证实了模型的有效性。
2.3 T-2毒素体外作用对对虾DNA黏度的影响
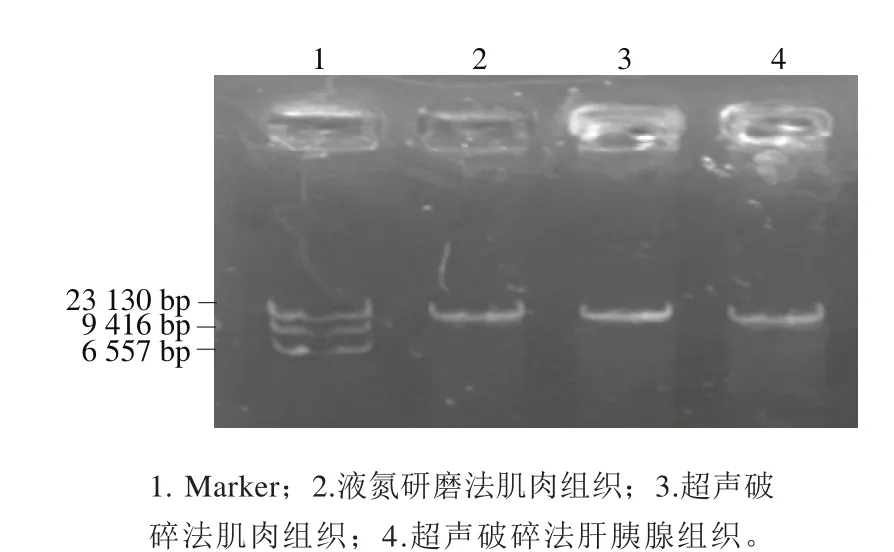
图5 空白组DNA琼脂糖凝胶电泳图Fig.5 Electrophoresis of DNA in the blank group
从图5中可以看到条带明亮,说明提取的肝胰腺DNA和肌肉DNA纯度高,肝胰腺DNA的A260nm/A280nm为1.891,肌肉DNA的A260nm/A280nm为1.854,提取的对虾肝胰腺DNA质量浓度为872 μg/mL,肌肉DNA质量浓度为393 μg/mL。对虾肝胰腺内DNA的提取质量浓度远大于肌肉的,表明同质量肝胰腺组织内的DNA质量浓度明显高于肌肉组织。

图6 体外加入不同质量浓度T-2毒素对对虾DNA黏度的影响Fig.6 Effect of T-2 toxin concentration in vitro on viscosity of shrimp DNA
由图6可知,50 μg/mL肝胰腺DNA的黏度的变化趋势随着T-2质量浓度的增加而增大,当T-2毒素质量浓度为2.70 ng/mL时,DNA黏度达到最大值,T-2毒素小分子中具有强电负性的羟基与羰基,会被DNA两侧的带电磷酸基团吸附,紧密包围在核酸表面,这种包裹作用可能增加了T-2毒素上O—H与嘧啶和嘌呤的N原子和O原子的接触,增加了形成氢键的可能[16-17]。碱基对之间的氢键对维持DNA双链结构的稳定起主要作用。同时T-2毒素作为一种脂溶性分子,具有一定的疏水作用[18],所有氢键的形成和疏水作用都对DNA双链产生拉伸作用,从而使DNA双链的间距增大,引起DNA黏度的增加[19]。同时外源化合物以嵌插结合的方式与DNA作用,可以引起DNA相邻碱基对之间的距离增大,使双螺旋延长,从而致使DNA黏度增大[20-22]。这也说明T-2毒素与DNA通过嵌插的方式结合。此后随T-2毒素质量浓度的增加呈下降趋势。这可能是因为随着T-2毒素的增加,两者的作用更加充分,DNA骨架磷酸负电荷被中和,此时DNA会弯曲凝聚而沉淀出来,随着DNA的凝聚不断分离,引起DNA黏度的下降[16,23-24]。还可能是由于随着DNA质量浓度的增加,T-2毒素完全反应,相对未反应的DNA比例增加,因此造成黏度的下降。汪学德等[25]发现小分子化合物芝麻素及其衍生物能够促使DNA黏度的升高,当达到一定之后,DNA黏度变化趋于稳定。这与本研究的实验结果相似,在一定量的小分子化合物T-2毒素范围内,T-2毒素能够促使DNA黏度的升高,而超过一定值后,DNA黏度呈下降趋势,可能因为过量芝麻素及其衍生物与DNA不再发生反应,而过量的T-2毒素因含有电荷可继续与DNA反应造成的。T-2毒素质量浓度的变化对稀释10 倍的原肝胰腺DNA提取液的黏度的影响较稀释10 倍的原肌肉DNA提取液的明显。因肝胰腺内DNA的含量更高,并且肝胰腺是对虾对外源化合物的主要解毒器官和储藏器官,因此推测对虾的肝胰腺为T-2毒素进攻的靶器官。
2.4 T-2毒素经口对对虾DNA黏度的影响
由图7可知,空白组的条带亮度明显高于剂量组,同时测定空白组和剂量组对虾提取的肝胰腺DNA的A260nm/A280nm,分别为1.947、1.506、1.259、1.249、1.363、1.379。DNA质量浓度分别为858、651、662、638、597、684 μg/mL,剂量组DNA的A260nm/A280nm均小于1.6,而空白组DNA的A260nm/A280nm为1.947,并且提取的剂量组DNA质量浓度也明显低于空白组的,因相同的提取条件故可以排除提取过程中DNA的污染,可以推测是样品本身中存在对DNA有作用的物质。有研究表明T-2毒素引起机体氧化应激而产生醛类物质,由于醛类物质的吸收峰覆盖了DNA的吸收峰[26-27]。覆盖DNA原本的吸光度,从而引起A260nm和A280nm的变化,造成A260nm/A280nm降低。

图7 各T-2毒素剂量组DNA琼脂糖凝胶电泳图Fig.7 Electrophoresis of DNA from shrimps exposed to different doses of T-2 toxin
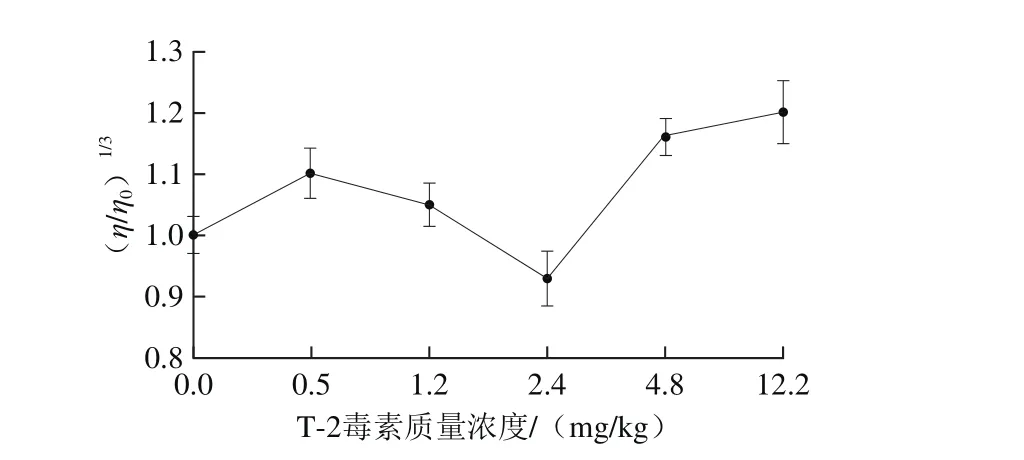
图8 各T-2毒素剂量组对虾肝胰腺DNA黏度的变化Fig.8 Changes in DNA viscosity in liver and pancrea tissues from all dose groups
由图8可知,不同剂量组对虾体内DNA黏度有着明显的差异,剂量组对虾DNA黏度整体较空白组高,实验结果与小牛胸腺DNA实验和体外实验具有大致相似的影响,T-2毒素不管在体内或者体外几乎都会引起对虾DNA黏度整体上升。但是DNA黏度的变化趋势存在差异,比如0.5 mg/kg剂量组的DNA黏度较1.2 mg/kg剂量组的高,在2.4 mg/kg剂量组对虾DNA黏度低于空白组。推测可能为:剂量组利用T-2毒素喂养对虾20 d,对虾机体内含有DNA修复酶会对损伤的DNA进行一定自我修复[28];另外有研究表明,当T-2毒素进入体内后,在肝脏等一些解毒器官内发生代谢转化,如脱乙酰作用、羟基化作用、脱环氧化作用等,变成其他形式的T-2毒素,如mT-2s(隐蔽态T-2毒素)、HT-2、T-2醇等[29-30]。所以当T-2毒素进入对虾体内后,可能一部分被各种转化反应代谢成其他物质,其中某些物质以更多样的方式与DNA作用,从而对剂量组对虾体内DNA黏度的变化造成干扰。
3 结 论
采用Design-Expert软件的中心组合设计方法设计响应面试验,建立二次多项式数学模型,优化出对DNA黏度影响最明显的反应条件:T-2毒素质量浓度为2.70 ng/mL、DNA质量浓度为50 μg/mL、反应时间为43 min。
因为T-2毒素小分子中具有强电负性的羟基与羰基可能会被DNA两侧的带电磷酸基团吸附;T-2毒素上O—H可能与嘧啶和嘌呤的N原子和O原子接触形成氢键;同时T-2毒素还可能通过嵌插的方式与DNA结合。
体外实验中,体外T-2毒素与对虾DNA作用,随着T-2毒素质量浓度的增加,DNA黏度随之增大,在T-2毒素质量浓度为2.70 ng/mL时达到最大值,此后降低;在体内实验中,喂食对虾T-2毒素进行蓄积染毒对对虾DNA黏度的影响无明确规律,与体外对虾DNA实验结果并不相似。可能是由于T-2毒素经过体内复杂的反应,与其他物质加合后作用于DNA引起的,这还需要进一步研究。
[1] 杨建英, 李元晓. T-2毒素对机体的毒性作用研究进展[J]. 环境与健康杂志, 2012, 29(10): 987-959. DOI:10.16241/j.cnki.1001-5914.2012.10.020.
[2] LI M X, CUFF C F, PESTKA J J. T-2 toxin impairment of enteric reovirus clearance in the mouse associated with suppressed immunoglobulin and IFN-γ-responses[J]. Toxicology and Applied Pharmacology, 2006, 214(3): 318-325. DOI:10.1016/j.taap.2006.01.007.
[3] 王雅玲. 养殖环境真菌气溶胶及相关真菌毒素的检测[D]. 泰安: 山东农业大学, 2006: 22-36.
[4] 卜黎明, 刘宁, 程绍辉, 等. T-2毒素对大鼠心肝肾及外周血淋巴细胞DNA损伤的实验观察[J]. 中国地方病学杂志, 2001, 20(5): 45-51.
[5] LAFARGE-FRAYSSINET C, DECLOITRE F, MOUSSET S, et al.Induction of DNA single-strand breaks by T-2 toxin, a trichothecene metabolite of fusarium, effect on lymphoid organs and liver[J].Mutation Research, 1981, 88(2): 115-123. DOI:10.1016/0165-1218(81)90010-0.
[6] BARZILAY G, WALKER L J, ROTHWELL D G, et al. Role of the HAP1 protein in repair of oxidative DNA damage and regulation of transcription factors[J]. The British Journal of Cancer, 1996, 74: 145-150. DOI:10.1038/sj.bjc.6690447.
[7] SHIFRIN V I, ANDERSON P. Trichothecene mycotoxins trigger a ribotoxie stress response that activese c-Jun N-terminal kinase and p38 mitogen-activated protien kinase and induces apoptosis[J]. Journal of Biological Chemistry, 1999, 274(20): 13985-13992. DOI:10.1074/jbc.274.20.13985.
[8] 李瑜, 张国文, 潘军辉. 农药西玛津与小牛胸腺DNA的相互作用[J].南昌大学学报(理科版), 2012, 36(3): 223-227. DOI:10.16742/j.issn.1004.2012.10.020.
[9] QIU M, WANG Y L, WANG X B, et al. Effects of T-2 toxin on growth, immune function and hepatopancreas microstructure of shrimp (Litopenaeus vannamei)[J]. Aquaticulture, 2016, 462: 35-39.DOI:10.1016/j.aquaculture.
[10] 叶日英, 王雅玲, 孙力军, 等. T-2毒素对凡纳滨对虾肌肉氨基酸含量的影响及其灰色关联分析[J]. 广东农业科学, 2015, 42(17): 118-123.DOI:10.16768/j.issn.1004-874x.2015.17.028.
[11] 肖卫华, 韩鲁佳, 杨增玲, 等. 响应面法优化黄芪黄酮提取工艺的研究[J]. 中国农业大学学报, 2007, 12(5): 52-56. DOI:10.1642/j.issn.1004.2007.
[12] 代喆. T-2毒素诱导凡纳滨对虾肌肉品质典型性状的变化规律[D].湛江: 广东海洋大学, 2013: 28-35.
[13] 邹建国, 刘飞, 刘燕燕, 等. 响应面法优化微波辅助提取枳壳中总黄酮工艺[J]. 食品科学, 2012, 33(12): 24-28. DOI:10.1002/j.issn.1008-275x.2012.01.020.
[14] 吴晖, 赖富饶, 胡筱波. 响应面分析法优化油菜花粉多糖提取工艺的研究[J]. 食品与机械, 2007, 23(5): 66-69; 73. DOI:10.13652/j.issn.1003-5788.2007.05.007.
[15] 杨文鸽, 谢果凰, 颜伟华, 等. 利用响应面分析法优化海鳗的湿淹工艺[J]. 中国食品学报, 2010, 10(1): 133-139. DOI:10.16429/j.1009-7848.2010.
[16] PAN H, ZHANG J, ZHANG G Y. Phase diagram on interaction between polyamine and DNA[J]. Chinese Journal of Applied Chemistry, 2007, 24(11): 1250. DOI:10.1004/jbc.274.2007.
[17] 张婧, 胡林, 刘艳辉, 等. DNA凝聚性质的紫外光谱研究[J].光谱学与光谱分析, 2012, 32(5): 1306-1309. DOI:10.3964/j.issn.1000-0593(2012)05-1306-04.
[18] 王敏辉, 李吕木, 丁小玲, 等. T-2毒素研究进展[J]. 动物营养学报,2011, 23(11): 20-24. DOI:10.3969/j.issn.1006-267x.2011.01.005.
[19] 童裳伦, 胡洲, 刘维屏. 光谱法研究百草枯与小牛胸腺DNA的相互作用[J]. 化学学报, 2010, 68(14): 1404-1410. DOI:10.12469/j.issn.1006-256x.2010.
[20] STAYANARAYANA S, DABROWIAK J C, CHAIRES J B. Tirs(phenanthroline) ruthenium (Ⅱ) enantiomer interaction with DNA:mode and specif i city of binding[J]. Biochemistry, 1993, 32(10): 2573-2584. DOI:10.1021/jp993369n.
[21] 蔡志强, 韩金多, 李亮, 等. 茶多酚与DNA相互作用的初步探讨[J].江苏石油化工学院学报, 2002, 14(3): 25-27. DOI:10.1004/j.cnki.2002.04.010.
[22] 张国文, 汪佳蓉, 杨佳, 等. 荧光光谱法研究三唑磷对DNA的损伤作用[J]. 南昌大学学报(理科版), 2009, 33(5): 452-455. DOI:10.1024/j.issn.1001-2414.2009.
[23] 夏世均, 吴中亮. 分子毒理学基础[M]. 武汉: 湖北科学技术出版社,2001: 614-618.
[24] 张霞, 倪永年. 荧光光谱法研究罗丹明B与DNA的相互作用[J]. 南昌大学学报(理科版), 2007, 31(3): 268-270; 275. DOI:10.16245/j.cnki.1001-5969.2007.03.004.
[25] 汪学德, 刘帅, 程威威, 等. 芝麻素及其衍生物与DNA相互作用的研究[J]. 现代食品科技, 2015, 31(12): 93-97. DOI:10.13982/j.mfst.1673-9078.2015.12.014.
[26] CHAUDHARI M, JAYARAJ R, BHASKAR A S B, et al. Oxidative stress induction by T-2 toxin causes DNA damage and triggers apoptosis via caspase pathway in human cervical cancer cells[J].Toxicology, 2009, 262: 153-161. DOI:10.1016/j.tcx.2009/06.002.
[27] 杨丹凤, 袭著革, 张华山, 等. 用紫外光谱法检测三种醛类化合物与DNA的结合[J]. 环境与健康杂志, 1999, 16(4): 103-110.DOI:10.1624/j.cnki.1001-5914.1999.04.002.
[28] 殷蓓蓓, 裴可, 梁婧. DNA修复酶基因多态性与食管癌易感性的关系[J]. 现代肿瘤医学, 2016, 24(15): 2491-2495. DOI:10.3969/j.issn.1672-4992,2016.15.042.
[29] SOKOLOVIC M, GARAJ-VRHOVAC V, LIMPRAGA B. T-2 toxin:incidence and toxicity in poultry[J]. Archivesof Industrial Hygiene and Toxicology, 2008, 59(1): 43-52. DOI:10.2478/100041254-59-20081843.
[30] KÊIGS M, MULAC D, SCHWERDT G, et al. Metabolism and cytotoxic effects of T-2 toxin and itsmetabolites on humans cells in primary culture[J]. Toxicology, 2009, 258(2/3): 106-115.DOI:10.1016/j.tcx.2009.01.012.
