土壤链霉菌Streptomyces sp.的抑菌成分
2018-03-20郭志凯盖翠娟蔡彩虹陈亮亮戴好富梅文莉
郭志凯,盖翠娟,蔡彩虹,陈亮亮,戴好富,梅文莉
中国热带农业科学院热带生物技术研究所,农业部热带作物生物学与遗传资源利用重点实验室,海南海口571101
放线菌是一类重要的药源微生物,能产生大量活性天然产物,如抗菌、抗肿瘤活性的大环内酯类,生物碱类,萜类等,是新药研发和天然活性产物的重要来源. 许多临床上使用的抗生素,如氨基糖苷类、大环内酯类、四环素类和内酰胺类等均由放线菌产生,其中直接或间接来源于链霉菌的抗生素占市场和临床实验的一半以上[1]. MA等[2-7]对一些昆虫肠道放线菌的代谢产物进行了研究,从中发现了一系列结构新颖、活性多样的天然产物. 在前期广泛收集源自海南海洋、昆虫肠道和热带雨林植物及土壤放线菌资源的基础上,本课题组在寻找结构新颖的抗菌活性化合物筛选实验中,发现一株土壤链霉菌Streptomycessp.发酵产物的乙酸乙酯提取物对金黄色葡萄球菌具有体外抗菌活性,其抑菌圈直径为10 mm.因此本研究对该发酵产物中的化学成分进行了分离鉴定和活性评价,希望从中发现具有抗菌活性的分子,为后续结构改造与活性研究提供依据.
1 材料与方法
1.1 实验材料
高分辨电喷雾质谱(high resolution electrospray ionization mass spectroscopy, HRESIMS)数据在Agilent公司生产的6210 TOF LC-MS质谱仪(Agilent,美国)上测定;化合物的氢(1H)核磁共振谱(hydrogen nuclear magnetic resonance spectroscopy,1HNMR)、 核磁共振碳谱(13CNMR)、异核单量子相关(heteronuclear single quantum correlation, HSQC)、异核多键相关(heteronuclear multiple bond correlation, HMBC)和氢氢质子同核相关谱(1H-1H correlated spectroscopy, 1H-1HCOSY)数据在德国Bruker公司生产的Bruker Avance III 700 MHz核磁共振波谱仪上测定,以四甲基硅烷(tetramethylsilane,TMS)为内标,化学位移以δ表示;分析型薄层层析硅胶(GF254)和层析柱硅胶(200~300 μm)均购自青岛海洋化工厂;Sephadex LH-20和十八烷基硅烷键含硅胶填料(octadecylsilyl,ODS)反相硅胶分别购自瑞典Pharmacia Biotech和日本京都Nacalai Tesque公司;半制备高效液相色谱(semi-preparative high performance liquid chromatography,HPLC)为Varian半制备HPLC系统,配备Alltima C18反相柱(250.0 mm × 10.0 mm,5 mm);实验中使用的试剂均为分析纯.
1.2 实验方法
1.2.1 菌株的发酵
土壤链霉菌菌株Streptomycessp.经高氏I号培养基平板(1.0 g/L KNO3、 0.5 g/L MgSO4、 0.5 g/L K2HPO4、 0.5 g/L NaCl、 0.01 g/L FeSO4·7H2O、 20 g/L可溶性淀粉、 20 g/L 琼脂)活化,28 ℃培养7 d,之后直接将菌块接种至装有400 mL液体麦芽培养基(20 g/L麦芽提取物、20 g/L 蔗糖、1 g/L 蛋白胨)的1 L Erlenmeyer烧瓶中,共接种25瓶,摇床上发酵13 d(120 rpm,28 ℃).
1.2.2 化合物的分离和纯化
发酵结束后,将发酵液用4层纱布过滤除去菌丝体,得到约10 L发酵液,在室温下,经等体积的乙酸乙酯萃取3遍,减压浓缩得到4.3 g乙酸乙酯粗提物.该粗提物经减压硅胶柱色谱,以二氯甲烷-甲醇梯度洗脱得7个流份,体积比分别为100∶0、 100∶1、 100∶2、 100∶4、 100∶8、100∶16和0∶100.流份2(氯仿和甲醇,体积比为100∶1)经ODS反相硅胶柱层析、Sepha/dex LH-20凝胶柱层析和高效液相层析得到化合物1(2.4 mg,保留时间为19.6 min)、化合物3(1.0 mg,保留时间为27.7 min)和化合物4(0.9 mg,保留时间为28.9 min).凝胶柱层析和高效液相层析流动相为甲醇水,以线性梯度洗脱,具体步骤为:0~35 min, 体积分数为0~100%的甲醇; 35~50 min, 体积分数为100%的甲醇; 50~51 min, 体积分数为100%~0的甲醇; 51~56 min, 体积分数为0的甲醇.流份3(氯仿和甲醇,体积比为100∶2)经ODS反相硅胶柱层析、Sephadex LH-20凝胶柱层析和高效液相层析(半制备方法同上)得到化合物2(8.9 mg,保留时间为14.6 min)、化合物6(5.1 mg,保留时间为21.7 min)、化合物8(1.3 mg,保留时间为35.8 min)和化合物10(6.3 mg,保留时间为22.6 min).流份4(氯仿和甲醇体积比为100∶4)经ODS反相硅胶柱层析、Sephadex LH-20凝胶柱层析和高效液相层析(半制备方法同上)得到化合物5(3.2 mg,保留时间为18.0 min)和7(1.9 mg,保留时间为21.9 min).流份5(氯仿和甲醇体积比为100∶8)经ODS反相硅胶柱层析、Sephadex LH-20凝胶柱层析和高效液相层析(半制备方法同上)得到化合物9(9.7 mg,保留时间为25.2 min)和11(2.5 mg,保留时间为14.0 min).
1.2.3 体外抗菌活性测定
体外抗菌活性测定所采用的方法与先前报道的方法一致[3].本研究对化合物2—4、6、8和9抗3种革兰氏阳性菌(枯草芽孢杆菌、金黄色葡萄球菌和耻垢分支杆菌)的活性进行了测定.
2 结果与讨论

图1 化合物1—11的结构Fig.1 Structures of compounds 1-11
本研究从一株土壤链霉菌Streptomycessp.发酵液的乙酸乙酯提取物中分离纯化得到11个化合物(1—11),如图1,分别为(E)-3-甲硫基丙烯酸(1)、 (E)-3-甲硫基丙烯酰胺(2)、 反式肉桂酸(3)、 (E)-4-苯基-3-丁烯酸(4)、3-羟基-4-甲氧基肉桂酰胺(5)、 3-indoleketol(6)、N-乙酰基-β-氧色胺(7)、 2-乙酰基大黄素(8)、 7-羟基-2-(2-羟丙基)-5-甲基色酮(9)、 环(苯丙-脯) (10)、 环(3-羟基酪-脯) (11).其中化合物4—6、8、9和11是首次从链霉菌中发现,并首次报道了化合物2的13C核磁数据.
2.1 结构鉴定
化合物1为无色片状结晶,正源高分辨质谱给出其准分子离子峰质荷比m/z为119.016 2[M+H]+,推出其分子式为C4H6O2S (C4H7O2S计算值为119.016 1);该化合物的1HNMR数据 (二甲基亚砜(dimethyl sulfoxid,DMSO)-d6, 700 MHz)δ分别为 7.71 (1H, d, 耦合常数J= 15.0 Hz)、 5.63 (1H, d,J=15.0 Hz)、 2.34 (3H, s)和12.07 (1H, br s, COOH);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为166.2 (s, C-1)、 114.4 (d, C-2)、 147.2 (d, C-3)和14.2 (q, C-4).分析以上波谱数据,其与文献[8]报道一致,故将化合物1鉴定为(E)-3-甲硫基丙烯酸.
化合物2为无色片状结晶,正源高分辨质谱给出其准分子离子峰m/z为118.032 0[M+H]+,推出其分子式为C4H7NOS (C4H8NOS计算值为118.049 9);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为7.41 (1H, d,J= 14.9 Hz)、 5.80 (1H, d,J= 14.9 Hz)、 2.31 (3H, s), 7.26和6.83 (2H, br s, NH2);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为165.7 (s, C-1)、 117.7 (d, C-2、 141.0 (d, C-3)和14.2 (q, C-4).分析以上波谱数据,其与文献[9-10]报道一致,故将化合物2鉴定为(E)-3-甲硫基丙烯酰胺.
化合物3为白色晶体,正源高分辨质谱给出其准分子离子峰m/z为149.059 9[M+H]+,推出其分子式为C9H8O2(C9H9O2计算值为149.059 7 );该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为7.68 (2H, m)、 7.58 (1H, d,J=16.1 Hz)、 7.42 (3H, m)、 6.53 (1H, d,J= 16.1 Hz)和12.42 (1H, br s, COOH).分析以上波谱数据,其与文献[11]报道一致,故将化合物3鉴定为反式肉桂酸.
化合物4为白色晶体,正源高分辨质谱给出其准分子离子峰m/z为163.075 2[M+H]+,推出其分子式为C10H10O2(C10H11O2计算值为163.075 4);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为7.41 (2H, t,J=7.0 Hz)、 7.33 (2H, t,J=7.7 Hz)、 7.24 (1H, t,J=7.0 Hz)、 6.48 (1H, d,J=15.4 Hz)、 6.32 (1H, dd,J=15.4, 7.0 Hz)和3.17 (2H, d,J=7.0 Hz).分析以上波谱数据,其与文献[12]报道一致,故将化合物4鉴定为(E)-4-苯基-3-丁烯酸.
化合物5为白色粉末,正源高分辨质谱给出其准分子离子峰m/z为194.081 1[M+H]+,推出其分子式为C10H11NO3(C10H12NO3计算值为194.081 2);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为7.12 (1H, d,J=2.1 Hz)、 6.98 (1H, dd,J=7.7, 2.1 Hz)、 6.80 (1H, d,J=7.7 Hz)、 7.32 (1H, d,J=16.1 Hz)、 6.43 (1H, d,J=16.1 Hz)、 3.81 (3H, s), 9.43 (1H, s, OH), 7.40和6.95 (2H, br s, NH2);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为167.6 (s, C-1)、 119.5 (d, C-2)、 140.1 (d, C-3)、 126.8 (s, C-4)、 111.2 (d, C-5)、 148.3 (s, C-6)、 148.7(s,C-7)、 116.1(d,C-8)、 122.1(d,C-9)和56.0(q,7-OCH3).分析以上波谱数据,其与文献[13]报道一致,故将化合物5鉴定为3-羟基-4-甲氧基肉桂酰胺e.
化合物6为无定形粉末,正源高分辨质谱给出其准分子离子峰m/z为176.070 7[M+H]+,推出其分子式为C10H9NO2(C10H10NO2计算值为176.070 6);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为8.18 (1H, dd,J=7.2, 1.0 Hz)、 7.49 (1H, d,J=7.6 Hz)、 7.22 (1H, ddd,J=7.6, 7.0, 1.0 Hz)、 7.20 (1H, ddd,J=7.6, 7.2, 1.0 Hz)、 8.35 (1H, s)、 4.59 (2H, s)、 4.94 (1H, br s, OH)和12.00 (1H, br s, NH);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为133.7 (d, C-2)、 113.7 (s, C-3)、 133.8 (s, C-3a)、 122.1 (d, C-4)、 123.1 (d, C-5)、 121.5 (d, C-6)、 112.6 (d, C-7)、 136.8 (s, C-7a)、 194.9 (s, C-8)和65.6 (t, C-9).分析以上波谱数据,其与文献[14-16]报道一致,故将化合物6鉴定为3-indoleketol.
化合物7为无定形粉末,正源高分辨质谱给出其准分子离子峰m/z为217.097 4[M+H]+,推出其分子式为C12H12N2O2(C12H13N2O2计算值为217.097 2);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为8.16 (1H, d,J=7.6 Hz)、 7.49 (1H, d,J=7.8 Hz)、 7.22 (1H, td,J=7.7, 1.4 Hz)、 7.20 (1H, td,J=7.7, 1.1 Hz)、 8.41(1H, d,J=2.3 Hz)、 4.45(2H, d,J=5.7 Hz)、 1.92(3H, s)、 12.00(1H, br s, NH)和8.26(1H, m, NH);其13CNMR 数据(DMSO-d6, 175 MHz)δ分别为134.0(d, C-2)、 114.5(s, C-3)、 125.9(s, C-3a)、 121.6(d, C-4)、 122.3(d, C-5)、 123.3(d, C-6)、 112.6(d, C-7)、 136.9(s, C-7a)、 190.8(s, C-8), 46.2(t, C-9)、 169.9(s, C-10)和23.0(q, C-11).分析以上波谱数据,其与文献[17]报道一致,故将化合物7鉴定为N-乙酰基-β-氧色胺.
化合物8为黄色固体,正源高分辨质谱给出其准分子离子峰m/z为313.071 2[M+H]+,推出其分子式为C17H12O6(C17H13O6计算值为313.070 7);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为7.55 (1H, s)、 7.10 (1H, d,J=2.3 Hz)、 6.55 (1H, d,J=2.3 Hz)、 2.55 (3H, s)、 2.32 (3H, s)、 12.50 (1H, br s, OH)和12.00 (1H, br s, OH);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为32.1 (q, C-1)、 203.6 (s, C-2)、 136.5 (s, C-3)、 158.2 (s, C-4)、 114.6 (s, C-5)、 189.3 (s, C-6)、 108.9 (s, C-7)、 165.1 (s, C-8)、 108.5 (d, C-9)、 167.5 (s, C-10)、 110.3 (d, C-11)、 135.5 (s, C-12)、 181.7 (s, C-13)、 133.1 (s, C-14)、 121.5 (d, C-15)、 143.6 (s, C-16)和19.8 (q, C-17).分析以上波谱数据,其与文献[18-19]报道一致,故将化合物8鉴定为2-乙酰基大黄素.
化合物9为无色晶体,正源高分辨质谱给出其准分子离子峰m/z为235.096 3[M+H]+,推出其分子式为C13H14O4(C13H15O4计算值为235.096 5);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为6.63 (1H, d,J=2.1 Hz)、 6.60 (1H, br s)、 5.96 (1H, s)、 4.03 (1H, m)、 2.65 (3H, s)、 2.60 (1H, dd,J=14.0, 4.9 Hz)、 2.55 (1H, dd,J=14.0, 7.7 Hz)和1.15 (3H, d,J=6.3 Hz);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为43.3 (t, C-1′)、 64.5 (d, C-2′)、 23.9 (q, C-3′)、 165.2 (s, C-2)、 112.0 (d, C-3)、 178.8 (s, C-4)、 141.8 (s, C-5)、 117.0 (d, C-6)、 161.5 (s, C-7)、 101.1 (d, C-8)、 159.7 (s, C-9)、 114.8 (s, C-10)和22.9 (q, 5-CH3).分析以上波谱数据,其与文献[20]报道一致,故将化合物9鉴定为7-羟基-2-(2-羟丙基)-5-甲基色酮.
化合物10为白色粉末,正源高分辨质谱给出其准分子离子峰m/z为245.128 1[M+H]+,推出其分子式为C14H16N2O2(C14H17N2O2计算值为245.128 5);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为7.27 (2H, d,J=7.7 Hz)、 7.25 (2H, t,J=7.3 Hz)、 7.18 (1H, t,J=7.3 Hz)、 4.34 (1H, t-like,J=4.8 Hz)、 4.05 (1H, t,J=8.7 Hz)、 3.10 (1H, dd,J=14.3, 5.2 Hz)、 3.05 (1H, dd,J=14.3, 5.2 Hz)、 3.41 (1H, m)、 3.27 (1H, m), 2.01 (1H, m)、 1.71 (2H, m)、 1.39 (1H, m)和7.94 (1H, s, NH);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为169.4 (s, C-1′)、 58.8 (d, C-2′)、 28.2 (t, C-3′)、 22.2 (t, C-4′)、 45.0 (t, C-5′)、 165.4 (s, C-1)、 56.1 (d, C-2)、 35.9 (t, C-3)、 137.5 (s, C-4)、 130.2 (d, C-5, C-9)、128.3 (d, C-6, C-8)和126.7 (d, C-7).分析以上波谱数据,其与文献[21]报道一致,故将化合物10鉴定为环二肽化合物环(苯丙-脯).
化合物11为白色粉末,正源高分辨质谱给出其准分子离子峰m/z为277.118 6[M+H]+,推出其分子式为C14H16N2O4(C14H17N2O4计算值为277.118 3);该化合物的1HNMR数据 (DMSO-d6, 700 MHz)δ分别为6.66 (1H, d,J=2.1 Hz)、 6.60 (1H, d,J=8.4 Hz)、 6.51 (1H, dd,J=8.4, 2.1 Hz)、 4.21 (1H, t,J=5.1 Hz)、 4.06 (1H, dd,J=9.3, 7.3 Hz)、 3.44 (1H,m)、 3.27 (1H, m)、 2.90 (1H, dd,J=14.2, 5.1 Hz)、 2.84 (1H, dd,J=14.2, 5.1 Hz)、 2.02 (1H, m)、 1.74 (1H, m)、 1.45 (1H, m)、 8.72 (1H, br s, OH)和7.74 (1H, s, NH);其13CNMR 数据 (DMSO-d6, 175 MHz)δ分别为169.3 (s, C-1′)、 58.9 (d, C-2′)、 28.3 (t, C-3′)、 22.3 (t, C-4′)、 45.0 (t, C-5′)、 165.6 (s, C-1)、 56.4 (d, C-2)、 35.4 (t, C-3)、 128.2 (s, C-4)、 117.7 (d, C-5)、 145.3 (d, C-6)、 144.2 (d, C-7)、 115.6 (d, C-8)和121.0 (d, C-9).分析以上波谱数据,其与文献[22]报道一致,故将化合物11鉴定为环(3-羟基酪-脯).
2.2 体外抗菌活性评价
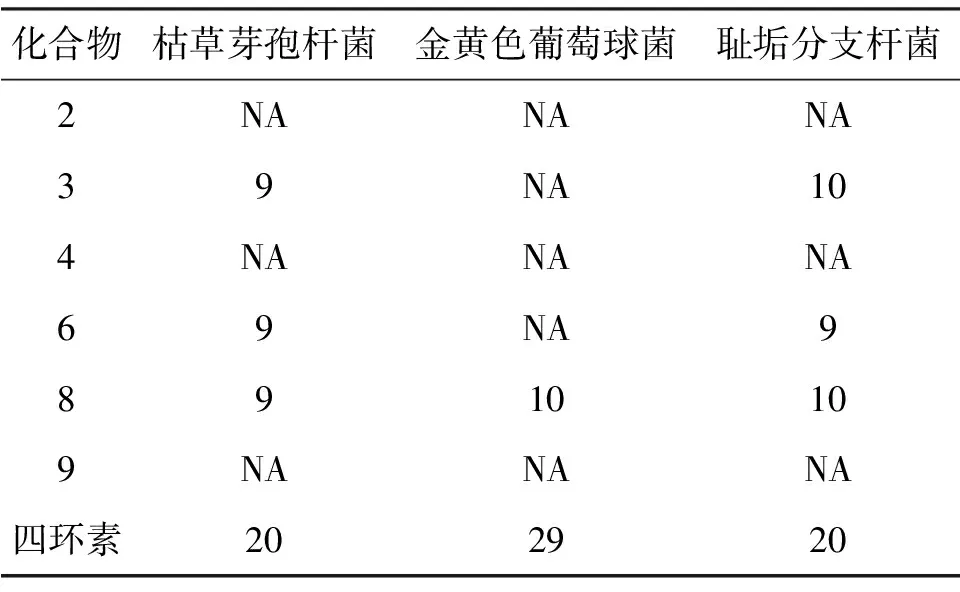
表1 化合物1—11的体外抗菌活性(抑菌圈直径 mm)1)
1)NA表示无活性
体外对化合物2—4、6、8和9进行了抗菌活性评价(表1),结果显示化合物3和6对2株供试菌枯草芽孢杆菌和耻垢分支杆菌具有弱抑制活性,而化合物8对3株供试菌枯草芽孢杆菌、金黄色葡萄球菌和耻垢分支杆菌具有抑菌活性.
3 结 论
放线菌是一类非常重要的药源微生物,能产结构多样的活性天然产物,可为临床用抗生素和新药研发提供重要先导分子.本研究从一株土壤链霉菌Streptomycessp.发酵液的乙酸乙酯提取物中分离纯化得到11个化合物(1—11),化合物1于1969年首次从链霉菌Streptomyceslincolnensis发酵产物中分离得到[23].体外合成实验证明,该化合物是多种植物来源的含硫化合物entadamide C、 penangin、 sinharine、 methylsinharine、 penimide A、 illukubin B和methylillukubin A等合成前体[8,24].化合物2仅分别于1972和1973年从链霉菌Streptomycessioyaensis和Streptomycesalboniger分离得到[9-10],未其可能来源于蛋氨酸,本研究亦首次报道了其13C核磁数据.化合物4—6、8、9和11是首次从链霉菌中发现.化合物6曾被报道来源于红海海绵Hyrtioserectus和红树林稀有放线菌Jishengellaendophytica, 亦在荧光假单胞菌PseudomonasfluorescensATCC29574的色氨酸代谢途径中得到鉴定[14-16].据报道该化合物对枯草芽孢杆菌和酵母菌具有一定程度的体外抑制活性.化合物8最先是从昆虫Eriococcuscoriaceus中发现[18-19],而化合物9最先是从药用植物马蹄大黄中发现[20],随后亦从一株红树植物内生真菌Pestalotiopsissp.中分离得到[25].化合物10对斑点矢车菊具有强的植物毒活性[22]以及具有弱的钙拮抗效应[21],而其结构类似物11对斑点矢车菊无植物毒活性[22].本研究利用已有的活性评价模型对分离得到的化合物2—4、6、8和9进行了抗菌活性评价,结果发现化合物3和6对2株革兰氏阳性菌-枯草芽孢杆菌和耻垢分支杆菌具有弱抑制活性,而化合物8对供试的3株革兰氏阳性菌-枯草芽孢杆菌、金黄色葡萄球菌和耻垢分支杆菌均具有抑菌活性,为抗菌分子的发现提供了新线索.
/
[1] SCHINKE C, MARTINS T, QUEIROZ S C, et al. Antibacterial compounds from marine bacteria, 2010-2015[J]. Journal of Natural Products, 2017, 80(4): 1215-1228.
[2] MA Shiying, XIAO Yongsheng, ZHANG Bo, et al. Amycolamycins A and B, two enediyne-derived compounds from a locust-associated actinomycete[J]. Organic Letters, 2017, 19(22): 6208-6211.
[3] XIAO Yongsheng, ZHANG Bo, ZHANG Mei, et al. Rifamorpholines A-E,potential antibiotics from locust-associated actinobacteriaAmycolatopsissp. Hca4[J]. Organic & Biomolecular Chemistry, 2017, 15(18): 3909-3916.
[4] GUO Zhikai, YAN Wei, TAN Renxiang, et al. Actinotetraose L, a new tetrasaccharide derivative isolated from the mycelia ofAmycolatopsissp. HCa1[J]. Journal of Asian Natural Products Research, 2015, 17(11): 1109-1113.
[5] GUO Zhikai, JIAO Ruihua, DAI Haofu, et al. Actinotetraoses I-K: tetrasaccharide metabolites produced by an insect-derived actinobacteria,Amycolatopsissp. HCa1[J]. Chemistry & Biodiversity, 2013, 10(2): 296-302.
[6] GUO Zhikai, LIU Shoubai, JIAO Ruihua, et al. Angucyclines from an insect-derived actinobacteriumAmycolatopsissp. HCa1 and their cytotoxic activity[J]. Bioorganic & Medicinal Chemistry Letters, 2012, 22(24): 7490-7493.
[7] GUO Zhikai, ZHANG Gaofei, JIAO Ruihua, et al. Actinotetraoses A-H: tetrasaccharide derivatives from a grasshopper-associatedAmycolatopsissp. HCa1[J]. Planta Medica, 2012, 78(10): 988-994.
[8] HINTERBERGER S, HOFER O, GREGER H, Synthesis and corrected structures of sulphur-containing amides fromGlycosmisspecies: sinharines, penimides, and illukumbins[J]. Tetrahedron, 1994, 50(21): 6279-6286.
[9] YAGI S, KITAI S, KIMURA T. Trans-3-methylthioacry-lamide, a new metabolic product fromStreptomycessioyaensis[J]. Agricultural and Biological Chemistry, 1972, 36(2): 336-338.
[10] FROHWEIN Y Z, DAFNI Z, FRIEDMAN M, et al. New metabolites ofStreptomycesalboniger[J]. Agricultural and Biological Chemistry, 1973, 37(3): 679-680.
[11] WANG Y, YANG M, YUAN C S, et al. Sesquiterpenes and other constituents fromCacaliadeltophylla[J]. Pharmazie, 2003, 58(8): 596-598.
[12] BROWNE D M, NIYOMURA O, WIRTH T. Catalytic use of Selenium electrophiles in cyclizations[J]. Organic Letters, 2007, 9(16): 3169-3171.
[13] LINDER J, MOODY C J. The total synthesis of sipho-nazole, a structurally unusual bis-oxazole natural product[J]. Chemical Communication, 2007, 15: 1508-1509.
[14] NARUMIYA S, TAKAI K, TOKUYAMA T, et al. A new metabolic pathway of tryptophan initiated by tryptophan side chain oxidase[J]. Journal of Biological Chemistry, 1979, 254(15): 7007-7015.
[15] ASHOUR M A, ELKHAYAT E S, EBEL R, et al. Indole alkaloid from the red sea spongeHyrtioserectus[J]. Arkivoc, 2007, 15: 225-231.
[16] WANG Pei, KONG Fandong, WEI Jingjing, et al. Alkaloids from the mangrove-derived actinomyceteJishengellaendophytica161111[J]. Marine Drugs, 2014, 12(1): 477-490.
[17] CHEN Yongle, ZEECK A, CHEN Zengxiang, et al. Metabolic products of microorganisms. 222:β-oxotryptamine derivatives isolated fromStreptomycesramulosus[J]. Journal of Antibiotics, 1983, 36(7): 913-915.
[18] BANKS H J, CAMERON D W, CROSSLEY M J. Chemistry of the Coccoidea. Ⅳ: polyhydroxyanthraquinones and their glucosides fromEriococcuscoriaceus(Hemiptera: Insecta)[J]. Australian Journal of Chemistry, 1976, 29(10): 2231-2245.
[19] CAMERON D W, CROSSLEY M J, FEUTRILL G I, et al. Chemistry of the Coccoidea. Ⅴ: synthesis of 2-acetylemodin and of deoxyerythrolaccin[J]. Australian Journal of Chemistry, 1978, 31(6): 1363-1370.
[20] KASHIWADA Y, NONAKA G I, NISHIOKA I. Studies on rhubarb (Rheirhizoma). Ⅴ: isolation and characterization of chromone and chromanone derivatives[J]. Chemical & Pharmaceutical Bulletin, 1984, 32(9): 3493-3500.
[21] WANG Youchu, ZHOU Jun, TAN Ninghua, et al. Cyclic dipeptides fromSchizandraChinensisand their syntheses[J]. Acta Pharmaceutica Sinica, 1999, 34(1): 19-22.
[22] BOBYLEV M M, BOBYLEVA L I, STROBEL G A. Synthesis and bioactivity of analogs of maculosin, a host-specific phytotoxin produced byAlternariaalternataon spotted knapweed (Centaureamaculosa)[J]. Journal of Agricultural and Food Chemistry, 1996, 44: 3960-3964.
[23] VISSER J, MEYER H F. Trans-3-(methylthio)acrylic acid, a new metabolic product fromStreptomyceslincolnensis[J]. Journal of Antibiotics, 1969, 22(10): 510.
[24] IKEGAMI F, SEKINE T, DUANGTERAPRECHA S, et al. Entadamide C, a sulphur-containing amide fromEntadaphaseoloides[J]. Phytochemistry, 1989, 28(3): 881-882.
[25] XU Jing, KJER J, SENDKER J, et al. Chromones from the endophytic fungusPestalotiopsissp. isolated from the Chinese mangrove plantRhizophoramucronata[J]. Journal of Natural Products, 2009, 72(4): 662-665.
