复方地黄方对阴虚动风证帕金森病异动症模型大鼠神经行为学及纹状体内多巴胺受体变化的干预作用*
2018-03-20洪芳滕龙何建成
洪芳滕龙何建成#
1 上海中医药大学 上海 201203
2 浙江医院 浙江 杭州 310013
帕金森病(PD)是中老年人常见的神经系统变性疾病,左旋多巴(L-dopa)是治疗PD最有效的药物,但长期应用可引起诸多运动并发症[1],其中最突出的是左旋多巴诱导异动症(LID)。复方地黄方是我们挖掘中医药理论并经临床证明治疗PD及LID有效的中药复方。帕金森病异动症的发生发展与多巴胺D1、D2受体密切相关,而复方地黄方对LID有明显的缓解作用[2-3]。本次实验运用Western Blot方法研究了各组大鼠纹状体多巴胺D1、D2受体的表达,并观察了神经行为学变化,以深入探讨它们在LID状态中的变化以及复方地黄方的影响。
1 材料和方法
1.1 动物:SD大鼠,100只,SPF级,雄性,体重180~200g,来源并饲养于上海中医药大学实验动物中心[SCXK(沪)2012-0002],许可证号:[SYXK(沪)2014-0008],自动光-暗控制(LD12∶12,即07:00~19:00光照,19:00~07:00暗置),相对湿度60%~65%,恒温23±2℃,动物摄食饮水自由。
1.2 试剂:左旋多巴干粉(批号:192K1885),苄丝肼(批号:BCBB8323),6-羟基多巴胺(6-OHDA),阿扑吗啡(APO),抗坏血酸,均为美国Sigma公司产品;兔源性D1抗体,兔源性D2抗体,均为美国Abcam公司产品;β-Actin,为美国CST公司产品;Marker,为美国Thermo公司产品;山羊抗兔二抗,Western及IP细胞裂解液,SDSPAGE凝胶配制试剂盒,SDS-PAGE蛋白上样缓冲液(5X),均为碧云天公司产品。
1.3 药物:复方地黄方的组成包括熟地黄、白芍、珍珠母、丹参、全蝎等。汤药按既定工艺煎煮,由上海雷允上药材有限公司代加工,浓度为5.18g/ml。用量根据孙瑞元[4]标准体重大鼠每日用量方法计算。标准体重大鼠每日用量计算公式为DB=DA×KB/KA[DA:标准体重成人每日用量;KB:大鼠剂量折算系数(7);KA:成人剂量折算系数(388)]。即大鼠每日用量DB=DA×7/388。
1.4 仪器:大鼠脑立体定位仪(RWD-68003型),为深圳瑞沃德生命科技有限公司;WesternBlot电泳及转膜装置,为美国Bio-Rad公司;超速离心机(LE80K型),为Beckman公司产品。
1.5 LID大鼠模型制备:PD模型采用Ungerstedt[5]等所创立的经典、公认的方法。术前SD大鼠进行常规行为测试,确认无旋转行为。3%戊巴比妥钠(0.15ml/kg)腹腔注射麻醉大鼠,固定于脑立体定位仪,头部去毛,消毒后沿正中线切开颅顶皮肤,露出前囟。根据包新民[6]所著《大鼠脑立体定位图谱》,定位右侧黑质二坐标:①前囟后5.2mm,正中线右侧1.0mm,硬膜下9.0mm;②前囟后5.2mm,正中线右侧2.5mm,硬膜下8.5mm。颅骨钻钻孔后用5μl微量进样器将6-OHDA(浓度为2g/L,溶于含0.2%维生素C的生理盐水)注入右侧黑质部,每孔3μl,注射速度为1μl/min,注射后留针5min,然后以1.0mm/min速度缓慢退针。术后缝合切口,肌肉注射庆大霉素,放回饲养笼中饲养。正常对照组仅固定动物。假手术组仅注射等量的含0.2%维生素C生理盐水。10d后,大鼠腹腔注射阿扑吗啡(0.5mg/kg),记录开始旋转至30min内旋转圈数,旋转频率每分钟平均超过7次者为合格的PD模型[7]。将造模成功的PD模型大鼠,进一步腹腔注射L-dopa/苄丝肼治疗(10mg/ml L-dopa和2.5mg/ml苄丝肼溶于含0.05%的乙醇和0.1%的抗坏血酸的生理盐水中),L-dopa的注射剂量为50mg/kg加12.5mg/kg苄丝肼,每天2次进行腹腔注射(9:00Am和5:00Pm),持续2周。正常对照组、假手术组腹腔注射等量的生理盐水(含0.05%的乙醇和0.1%的抗坏血酸),每日2次,连续2周。2周后,APO诱导动物,具有典型异常不自主动作(AIM)表现(AIM评分大于20分),且对侧旋转圈数增加者,为阴虚动风证LID模型大鼠[7]。
1.6 分组及给药:分述如下。
1.6.1 分组方法:采用区层随机法,将阴虚动风证LID模型大鼠随机分为4组:阴虚动风证LID模型4周、6周组,复方地黄方4周、6周组,每组6只。另取正常对照4周、6周组,假手术4周、6周组,每组6只。
1.6.2 给药方法:阴虚动风证LID模型组大鼠继续腹腔注射左旋多巴/苄丝肼(50mg/kg L-dopa和12.5mg/ml苄丝肼),生理盐水灌胃;复方地黄方组大鼠腹腔注射L-dopa/苄丝肼,复方地黄方灌胃;正常对照组、假手术组腹腔注射等量的生理盐水(含0.05%的乙醇和0.1%的抗坏血酸),生理盐水灌胃。每鼠每次灌胃量为2ml,每日1次,分别连续用药4周、6周。
1.6.3 样本处理:①取大鼠纹状体:在4周、6周不同时间点,每组大鼠进行最后一次行为学检测后,将各组大鼠以3%戊巴比妥(0.15ml/kg)腹腔注射麻醉,断头处死,快速开颅取脑,于冰上分离双侧纹状体,置-80℃冻存。②实验步骤:提取总蛋白,配制分离胶和堆积胶,加样,电泳,转膜,封闭,加入抗体,显影,分析。
1.7 观察指标:LID大鼠模型的行为学观察,包括AIM评分、旋转启动时间、旋转持续时间、剂峰旋转圈数;大鼠纹状体多巴胺D1、D2受体的表达情况。
1.8 统计学方法:采用SPSS16.0版软件进行齐性检验并作t检验和单因素方差分析,以均数±标准差(-x±s)表示。P<0.05认为差异具有统计学意义。
2 结果
2.1 复方地黄方干预后阴虚动风证LID大鼠AIM评分的变化:见表1。
表1 复方地黄方干预后阴虚动风证LID大鼠AIM评分的变化(±s,Scores/140min)
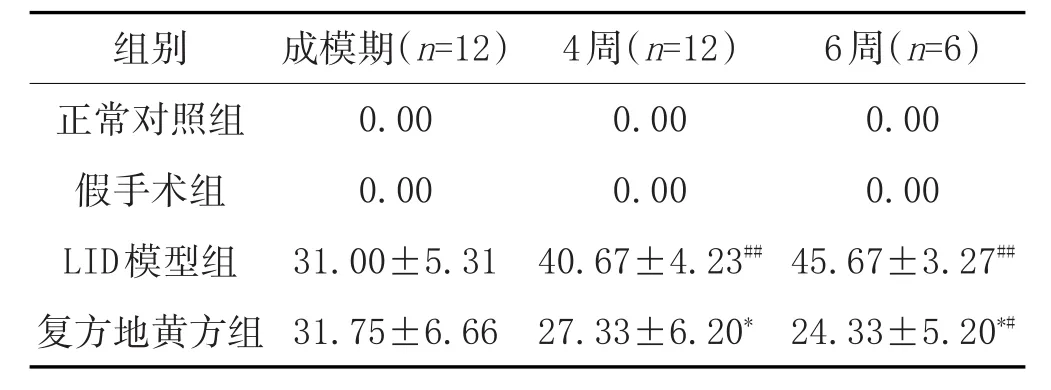
表1 复方地黄方干预后阴虚动风证LID大鼠AIM评分的变化(±s,Scores/140min)
注:与LID模型组比较,*P<0.001;与成模期比较,#P<0.01,##P<0.001。
6周(n=6)0.00 0.00 45.67±3.27##24.33±5.20*#组别正常对照组假手术组LID模型组复方地黄方组成模期(n=12)0.00 0.00 31.00±5.31 31.75±6.66 4周(n=12)0.00 0.00 40.67±4.23##27.33±6.20*
2.2 复方地黄方干预后阴虚动风证LID大鼠旋转启动时间和持续时间的变化:见表2。
2.3 复方地黄方干预后阴虚动风证LID大鼠剂峰旋转圈数及APO诱导后对侧旋转圈数变化:见表3。
表2 复方地黄方干预后阴虚动风证LID大鼠旋转启动时间和持续时间的变化(±s,s)
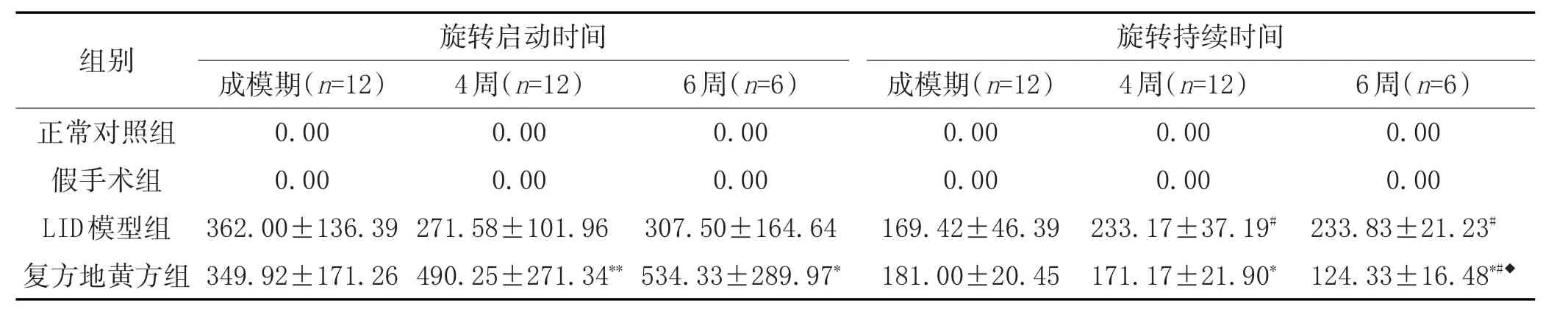
表2 复方地黄方干预后阴虚动风证LID大鼠旋转启动时间和持续时间的变化(±s,s)
注:与LID模型组比较,*P<0.05,**P<0.01;与成模期比较,#P<0.001;与4周组比较,◆P<0.01。
正常对照组假手术组LID模型组复方地黄方组0.00 0.00 233.83±21.23#124.33±16.48*#◆0.00 0.00 362.00±136.39 349.92±171.26 0.00 0.00 271.58±101.96 490.25±271.34**0.00 0.00 307.50±164.64 534.33±289.97*0.00 0.00 169.42±46.39 181.00±20.45 0.00 0.00 233.17±37.19#171.17±21.90*
表3 复方地黄方干预后阴虚动风证LID大鼠剂峰旋转圈数及APO诱导后对侧旋转圈数变化(±s)
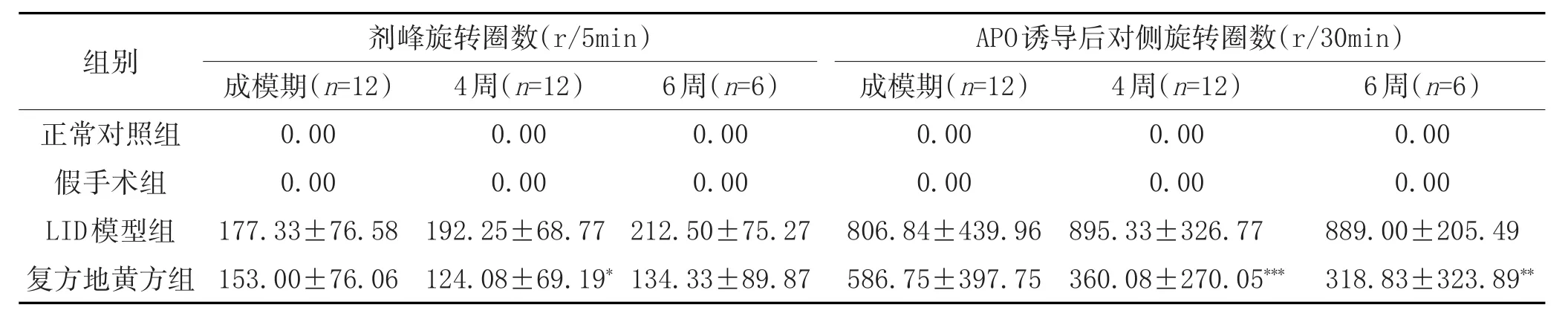
表3 复方地黄方干预后阴虚动风证LID大鼠剂峰旋转圈数及APO诱导后对侧旋转圈数变化(±s)
注:与LID模型组比较,*P<0.05,**P<0.01,***P<0.001。
正常对照组假手术组LID模型组复方地黄方组0.00 0.00 889.00±205.49 318.83±323.89**0.00 0.00 177.33±76.58 153.00±76.06 0.00 0.00 192.25±68.77 124.08±69.19*0.00 0.00 212.50±75.27 134.33±89.87 0.00 0.00 806.84±439.96 586.75±397.75 0.00 0.00 895.33±326.77 360.08±270.05***
2.4 各组大鼠纹状体D1受体表达比较:LID模型组与正常对照组及假手术组比较,D1受体的表达上升,差异均有统计学意义(P<0.001);LID模型6周组与4周组比较,D1受体的表达上升,差异有统计学意义(P<0.001)。复方地黄方干预后,4周、6周组D1受体的表达均有下降趋势,与LID组比较,差异均有统计学意义(P<0.001或P<0.05);复方地黄方6周与4周比较,D1受体的表达有下降趋势,差异有统计学意义(P<0.001)。见表4、图1。
表4 各组大鼠纹状体D1受体表达比较(±s)
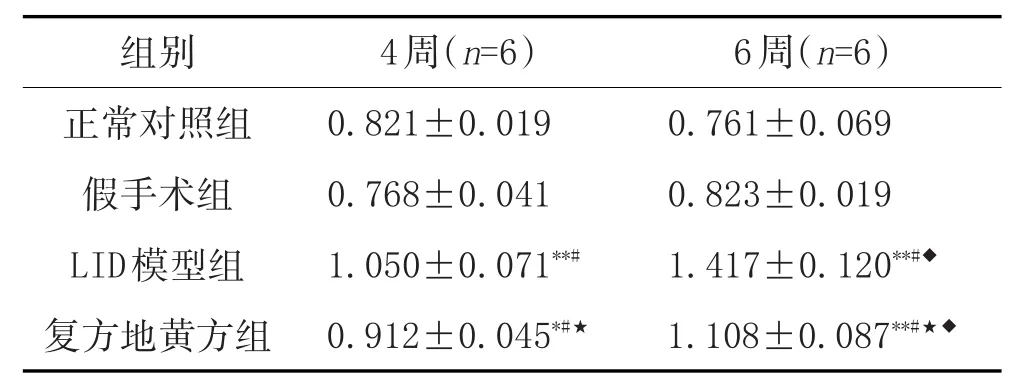
表4 各组大鼠纹状体D1受体表达比较(±s)
注:与正常对照组比较,*P<0.05,**P<0.001;与假手术组比较,#P<0.001;与LID模型组比较,★P<0.001;与4周组比较,◆P<0.001。
0.761±0.069 0.823±0.019 1.417±0.120**#◆1.108±0.087**#★◆正常对照组假手术组LID模型组复方地黄方组0.821±0.019 0.768±0.041 1.050±0.071**#0.912±0.045*#★
2.5 各组大鼠纹状体D2受体表达比较:LID模型组与正常对照组、假手术组比较,D2受体的表达呈上升趋势,差异均有统计学意义(P<0.001);LID模型组6周与4周比较,D2受体的表达有下降趋势,但差异无统计学意义。经复方地黄方干预后,4周、6周组D2受体的表达均有下降趋势,与LID模型组比较,差异均有统计学意义(P<0.05或P<0.001)。见表5、图1。
表5 各组大鼠纹状体D受体表达比较(±s)2

表5 各组大鼠纹状体D受体表达比较(±s)2
注:与正常对照组比较,*P<0.05,**P<0.01,***P<0.001;与假手术组比较,#P<0.001;与LID模型组比较,★P<0.001。
0.860±0.041 0.968±0.086 1.257±0.123***#1.020±0.141**★正常对照组假手术组LID模型组复方地黄汤组0.893±0.022 0.983±0.040 1.347±0.187***#1.027±0.041*★

图1 各组大鼠纹状体内D1、D2受体表达量的变化
3 讨论
本实验运用WesternBlot方法研究了各组大鼠纹状体多巴胺D1、D2受体的含量。实验结果显示,LID大鼠纹状体中D1、D2受体的含量均增加。目前的研究证实,LID的发生与L-dopa的波动性刺激有关,半衰期仅为1.5h的外源性L-dopa引起一系列突触后受体改变[8]。多巴胺D1受体的活化可使腺苷酸环化酶活力增强,催化ATP形成cAMP,激活了多种cAMP依赖的蛋白激酶。D2受体的生化机制与D1受体差异较大,激活D2受体可抑制或不影响腺苷酸环化酶的活力。虽然二者在生物化学活动方面具有较大差异,但在整体效应中,却表现出协同作用。本实验中,D2受体在LID中含量增高,但6周组相较4周组呈下降趋势,不排除随着用药时间的增加,D2受体含量继续下降的可能。同时,笔者前期的研究显示,D2受体在LID中亲和力下降[9]。可见,使用L-dopa后,间接通路的活动增强不明显,同时不排除逐渐下降的可能。
复方地黄方是笔者通过对大量中医文献和临床经验的总结,并在临床应用治疗LID取得满意疗效的中药复方。其对帕金森病异动症模型大鼠有明显的抗氧化应激、调控兴奋性氨基酸、调控PPE、PDYN的作用。本实验证明,LID大鼠经复方地黄方干预后,神经行为学有所改善,纹状体D1、D2受体含量出现下调,AIM评分下降,剂峰旋转圈数减少,可见复方地黄方通过对D1、D2受体的调节,对直接通路和间接通路的失衡有一定的改善作用。综上所述,笔者推测在LID的发生发展过程中,以直接通路的活动增强为主,直接通路的过度激活可致自主运动过多及动作过度。复方地黄方与L-dopa类药物(美多巴)合用,有明显的增效减毒作用。
[1]Zhang ZX,Roman GC,Hong Z,et al.Parkinson’s diseasein China:prevalence in Beijing,Xian,and Shanghai[J].Lancet,2005,365(9459):595-597.
[2]滕龙,洪芳,何建成.中药复方地黄方对帕金森异动症模型大鼠神经行为学动态变化的研究[J].浙江中医杂志,2016,51(6):411-413.
[3]张晨光,何建成.阴虚动风证帕金森病LID大鼠氨基酸变化的动态研究及复方地黄方的干预作用[J].西安交通大学学报(医学版),2012,33(4):501-506.
[4]孙瑞元.定量药理学[M].北京:人民卫生出版社,1987:247.
[5]Ungerstedt U.6-Hydroxy-dopamine induced degeneration of central monoamine neurons[J].Eur J Pharmacol,1968,5(1):107-110.
[6]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:49-58.
[7]Carman LS,GagaFH,Shults CW.Partial lesion of the substantianigra:relation between extent of lesion and rotational behavior[J].Brain Res,1991,553(2):275-283.
[8]Cenci MA,Ohlin KE,Rylander D.Plastic effects of L-DOPA treatment in the basal ganglia and their relevance to the development of dyskinesia[J].Parkinsonism Relat Disord,2009,15(3):59-63.
[9]曹丽双,何建成,庄燕鸿,等.不同中医治法对帕金森病LD大鼠D2受体变化影响的研究[J].时珍国医国药,2011,22(12):3006-3008.
