西松烷型二萜三氮唑衍生物的合成及其细胞毒活性
2018-03-20成伟华王文倩张宏武邹忠梅
成伟华,王文倩,尚 海,张宏武,郭 强,陈 虹,邹忠梅*
(1中国医学科学院北京协和医学院药用植物研究所,北京 100193;2原子高科股份有限公司,北京 102413;3天津药物研究院,天津 300193;4北京市计量检测科学研究院,北京 100029;5武警后勤学院生药学教研室,天津 300309)
西松烷型二萜为十四元大环二萜,结构中大都有氧取代,结构变化多样,多存在于低等海洋生物中,如腔肠动物柳珊瑚科和软珊瑚科,在陆生植物中比较少见,是一类结构新颖、特殊且具有重要生物活性的天然产物,具有显著的抗炎[1]、抗菌[2-3]、抗HIV[4-6]等活性。近年来随着加大对海洋生物的开发和利用,很多新结构的西松烷型二萜化合物被发现,这些化合物具有良好抗肿瘤活性[7-8],受到广泛关注。例如:Wen等[9]发现中国南海软珊瑚乙醇提取物中的乙酸乙酯部分对肿瘤细胞HL-60、HeLa、BGC-823、Bel-7402、PC-3MIE8和Hep-2的抑制率均超过50%(100 μg/mL),并从中分离得到两个新的西松烷二萜Sinulaflexiolides D和Sinulaflexiolide E,其对人胃癌细胞BGC-823的IC50分别为8.5和0.12 μmol/L。
本课题组前期从光叶巴豆中首次分离得到了一系列的西松烷型二萜型化合物。其中CL-8(图1)在光叶巴豆中含量很高,在生药中质量分数达到0.70%,且具有一定的抗肿瘤活性(对HeLa 细胞IC50=45.4 μmol/L)。
三氮唑类化合物具有多种生物活性,包括抗真菌、抗病毒、抗过敏和抗肿瘤活性。其中含三氮唑片段结构的化合物作为新型的抗肿瘤药物,已经广泛应用于临床。目前用于临床的含三氮唑抗肿瘤药物有来曲唑、阿那曲唑、氟氯唑和二溴苯基三唑[10-11](图2),此外一些新的三氮唑类抗肿瘤化合物(如血管生成抑制剂E4896,图2)目前正开展临床Ⅲ期试验[12]。
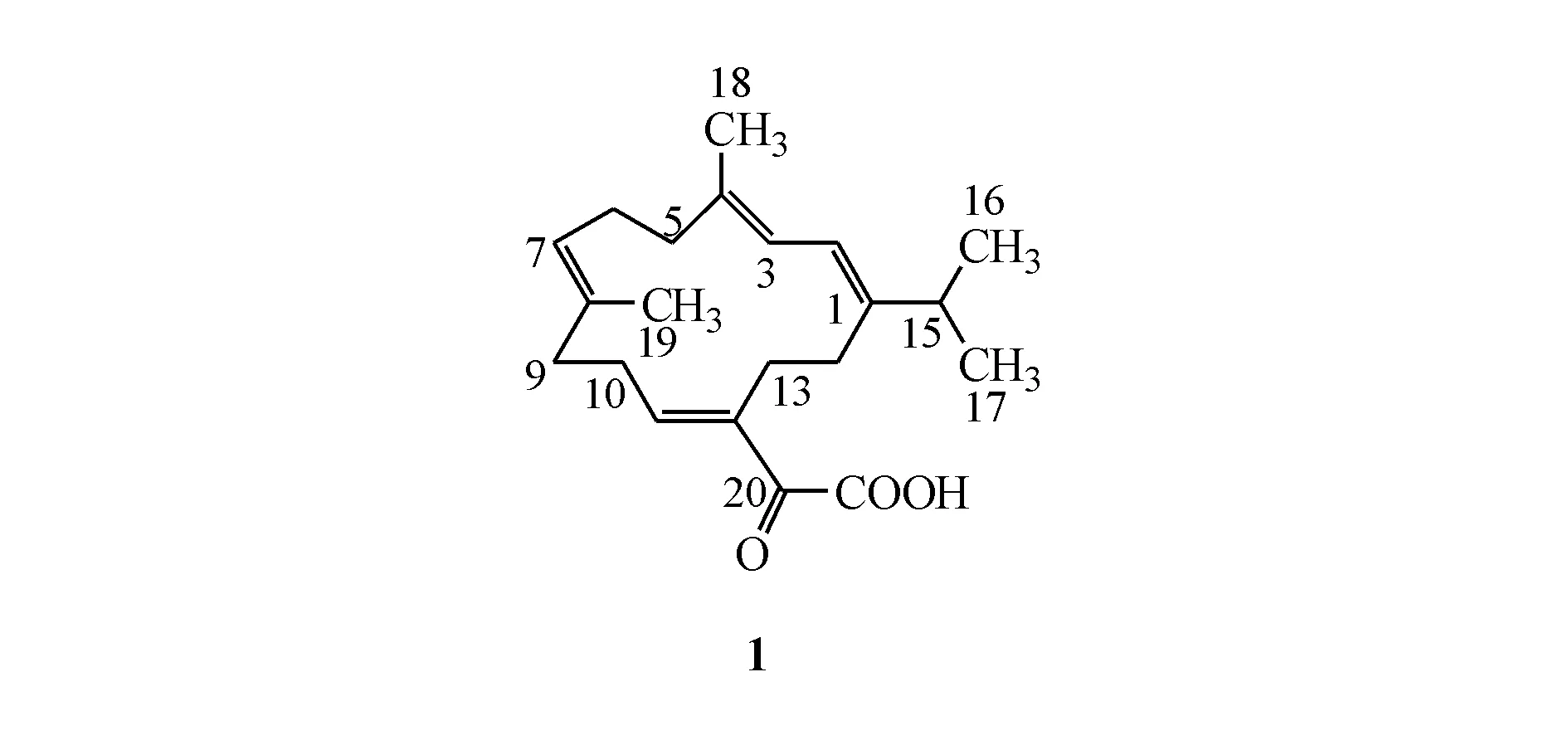
Figure1 Structure of cembrane CL-8

Figure2 Structures of antitumor drugs conjugated with 1,2,3-triazole
基于三氮唑在抗肿瘤药物中所起到的作用,运用药物设计的拼合原理,在西松烷型二萜CL-8中引入三氮唑基团,通过改变三氮唑上不同的取代基,合成三氮唑系列西松烷型二萜衍生物,其结构经1H NMR,13C NMR和HRMS的确证,并经MTT法筛选了该类衍生物的细胞毒性和抗耐药活性。
1 合成路线
目标化合物8a~8l的合成过程见路线1~2。首先以取代的溴苄、肉桂基溴以及烷基溴代物2为原料,通过与叠氮化钠反应得到叠氮中间体3a~3k(路线1)。接着,以西松烷二萜(1)为起始原料,用LiAlH4对其C-20位羧基进行还原得到羟基化合物4,接着经Dess-Martin氧化得到醛基中间体5,再运用Corey-Fuchs反应,得到末端炔烃化合物7。最后将末端炔烃化合物7与叠氮中间体3a~3k经点击化学合成得到1,2,3三氮唑取代的西松烷二萜衍生物8a~8k。衍生物8l的合成则是化合物7直接与可市售的对甲基苯磺酰基叠氮反应得到(路线2)。
2 实验部分
2.1 材 料
Bruker AM600型核磁共振光谱仪,采用CDCl3为溶剂,四甲基硅烷(TMS)为内标,偶合常数(J)以赫兹(Hz)为记录单位。高分辨质谱(ESI-HRMS)在Quattro MicroTMAPI(Waters,Milford,MA)质谱仪。薄层色谱硅胶:GF254(青岛海洋化工厂)。MQX-200酶标仪(美国Bio-Tek仪器公司)。无水乙醚为用无水Na2SO4预干燥后加入钠丝回流后重蒸得到,无水甲苯用无水Na2SO4预干燥后加入氢化钙回流后重蒸得到,无水THF用无水Na2SO4预干燥后加入钠丝回流后重蒸得到。西松烷型二萜(CL-8)原料来自实验室前期分离得到。其余试剂均为市售分析纯试剂。活性测试所用细胞为天津武警后勤学院生药学系提供。

Scheme1Synthetic route of azides intermediates3a-3k
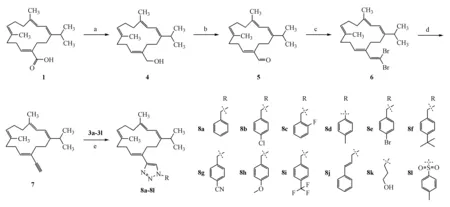
Scheme2Synthetic route of the target compounds8a-8l
Reagents and condition:(a) LiAlH4,Dry Et2O;(b) Dess-Martin,CH2Cl2;(c) PPh3,CBr4,CH2Cl2;(d) LDA,THF;(e) CuTc,toluene
2.2 化学合成
2.2.1 叠氮中间体的合成 将取代的苄基溴(2a~2i,1 mmol)加入丙酮-水(4∶1)混合溶剂5 mL中,加入叠氮钠(96 mg,1.5 mmol),室温反应24 h,TLC检测反应完全,CH2Cl2萃取,无水Na2SO4干燥,减压蒸干,得到取代的苄基叠氮(3a~3i),产率75%~85%。
将肉桂基溴(2j,195 mg,1 mmol)加入丙酮-水(4∶1)混合溶剂5 mL中,加入叠氮钠(96 mg,1.5 mmol),室温反应24 h,TLC检测反应完全,CH2Cl2萃取,无水Na2SO4干燥,减压蒸干,得到肉桂基叠氮(3j)130 mg,产率82%。
将3-溴-1-丙醇(2k,137 mg,1 mmol)加入丙酮-水(4∶1)混合溶剂5 mL中,加入叠氮钠(96 mg,1.5 mmol),室温反应24 h,TLC检测反应完全,CH2Cl2进行萃取,无水Na2SO4干燥,减压蒸干,得到3-叠氮-1-丙醇(3k)81 mg,产率80%。
2.2.2 西松烷二萜中间体的合成
新巴豆瑞士松醇(4) 将LiAlH4(760 mg,20 mmol)搅拌使其溶解于干燥乙醚15 mL中,然后加入恒压滴液漏斗中,将西松烷型二萜(1,3.02 g,10 mmol)溶于干燥乙醚150 mL中,0 ℃下将溶解于干燥乙醚的LiAlH4缓慢滴加到西松烷型二萜反应液中,滴加完毕后,室温反应4 h。TLC检测反应完成,0 ℃下,加入少量水淬灭反应,而后加入2 mol/L H2SO4溶液直至白色沉淀完全溶解,再加入等体积的CH2Cl2,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱分离得到白色固体新巴豆瑞士松醇(4),2.16 g,产率75%。
新巴豆瑞士松醛(5) 将新巴豆瑞士松醇(4,1.44 g,5 mmol)溶解于无水CH2Cl2100 mL中,缓慢加入Dess-Martin氧化剂(4.24 g,10 mmol),室温反应2 h,TLC检测反应完成,加入饱和Na2S2O3溶液,搅拌10 min,再加入饱和NaHCO3溶液搅拌直至溶液澄清,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱分离得到无色油状物新巴豆瑞士松醛(5)858 mg,产率60%。
新巴豆瑞士松炔(7) 将CBr4(1.08 g,3.3 mmol)溶解于10 mL无水CH2Cl2中,将PPh3(1.57 g,6 mmol)溶解于25 mL无水CH2Cl2中,0 ℃加入CBr4的 CH2Cl2溶液,室温反应30 min后,0 ℃加入新巴豆瑞士松醛(5,852 mg,3 mmol),室温反应3 h,TLC检测反应完成,加入30 mL水淬灭反应,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱的得无色油状物二溴新巴豆瑞士松烯(6)792 mg,产率60%。
将二异丙胺(420 μL,3 mmol)溶解于无水THF10 mL中,0 ℃加入n-BuLi(1.25 mL,3 mmol),反应20 min,制备得到LDA试剂。在-78 ℃下,将二溴新巴豆瑞士松烯6(440 mg,1 mmol)溶解于无水THF 20 mL中,缓慢加入LDA试剂,反应1 h后加入饱和NH4Cl溶液淬灭反应,石油醚萃取,有机相用无水Na2SO4干燥,减压蒸干,柱色谱分离得到无色油状物新巴豆瑞士松炔(7)140 mg,产率50%。
2.2.3 目标化合物8a~8l的合成 新巴豆瑞士松炔(7,70 mg,0.25 mmol)溶解于无水甲苯5 mL中,加入取代的叠氮化合物3a~3i(0.3 mmol),噻吩-2-甲酸亚铜(2 mg,0.01 mmol),室温搅拌反应2~4 h,TLC检测反应完全,饱和NH4Cl淬灭反应,乙酸乙酯萃取,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱分离得到目标产物8a~8i,产率60%~70%。
1-苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8a) 无色油状物,产率:62%;1H NMR(600 MHz,CDCl3)δ:7.43~7.36(3H,m,3,4,5-ArH),7.32~7.30(2H,m,2,6-ArH),7.28(1H,s,5-triazole-H),6.08(1H,t,J=7.9 Hz,11-H),6.06~6.00(1H,m,2-H),5.94(1H,d,J=11.1 Hz,3-H),5.53(2H,s,-CH2-Ar),5.22~5.15(1H,m,7-H),2.62~2.57(2H,m,10-H),2.43~2.39(2H,m,13-H),2.38~2.34(1H,m,15-H),2.31~2.27(2H,m,14-H),2.27~2.24(2H,m,6-H),2.19~2.18(2H,m,9-H),2.18~2.16(2H,m,5-H),1.75(3H,s,18-H),1.68(3H,s,19-H),1.02(3H,s,16-H),1.01(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.4,146.6,135.6,135.3,134.9,130.2,129.8,129.0,128.5,127.9,127.0,120.2,118.6,118.5,53.9,39.3,37.9,34.6,29.8,29.2,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C28H38N3[M+H]+,416.306 6;Found 416.3264[M+H]+。
1-对氯苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8b) 无色油状物,产率:66%;1H NMR(600 MHz,CDCl3)δ:7.33(2H,d,J=8.5 Hz,3,5-ArH),7.23(1H,s,5-triazole-H),7.20(2H,d,J=8.5 Hz,2,6-ArH),6.03(1H,t,J=7.9 Hz,11-H),5.98(1H,d,J=11.0 Hz,2-H),5.89(1H,d,J=11.0 Hz,3-H),5.45(2H,s,-CH2-Ar),5.17~5.11(1H,m,7-H),2.59~2.51(2H,m,10-H),2.38~2.34(2H,m,13-H),2.34~2.31(1H,m,15-H),2.26~2.23(2H,m,14-H),2.23~2.20(2H,m,6-H),2.16~2.14(2H,m,9-H),2.14~2.12(2H,m,5-H),1.70(3H,s,18-H),1.64(3H,s,19-H),0.98(3H,s,16-H),0.97(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.6,146.5,135.5,135.3,134.6,133.4,130.1,130.1,129.2,129.2,127.1,120.2,118.6,118.6,53.2,39.3,37.8,34.5,29.7,29.2,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C28H37ClN3[M+H]+,450.267 6;Found 450.287 6[M+H]+。
1-邻氟苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8c) 无色油状物,产率:63%;1H NMR(600 MHz,CDCl3)δ:7.39~7.31(1H,m,4-ArH),7.34(1H,s,5-triazole-H),7.28~7.23(1H,m,3-ArH),7.16~7.08(2H,m,5,6-ArH),6.06(1H,t,J=7.9 Hz,11-H),5.99(1H,d,J=11.1 Hz,2-H),5.90(1H,d,J=11.1 Hz,3-H),5.55(2H,s,-CH2-Ar),5.15(1H,t,J=6.9 Hz,7-H),2.58~2.53(2H,m,10-H),2.38~2.35(2H,m,13-H),2.35~2.32 1H,(m,15-H),2.27~2.24(2H,m,14-H),2.23~2.20(2H,m,6-H),2.17~2.14(2H,m,9-H),2.14~2.12(2H,m,5-H),1.71(3H,s,18-H),1.65(3H,s,19-H),0.99(3H,s,16-H),0.98(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:161.2,150.4,146.6,135.6,135.3,130.7,130.5,130.1,129.9,127.0,124.7,120.2,118.8,118.5,115.,115.6,47.4,47.3,39.3,37.9,34.6,29.8,29.2,29.1,24.7,22.0,17.8,17.5。ESI-HRMSm/z:Calcd.for C28H37FN3[M+H]+,434.297 2;Found 434.318 0[M+H]+。
1-对甲基苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8d) 无色油状物,产率:63%;1H NMR(600 MHz,CDCl3)δ:7.21(1H,s,5-triazole-H),7.17(2H,s,2,6-ArH),7.17(2H,s,3,5-ArH),6.04(1H,t,J=7.9 Hz,11-H),5.99(1H,d,J=11.0 Hz,2-H),5.90(1H,d,J=11.0 Hz,3-H),5.44(2H,s,-CH2-Ar),5.15(1H,t,J=6.9 Hz,7-H),2.58~2.51(2H,m,10-H),2.38~2.35(2H,m,13-H),2.34(3H,s,Ar-CH3),2.34~2.31(1H,m,15-H),2.26~2.23(2H,m,14-H),2.23~2.20(2H,m,6-H),2.16 ~2.14(2H,m,9-H),2.14~2.12(2H,m,5-H),1.70(3H,s,18-H),1.65(3H,s,19-H),0.98(3H,s,16-H),0.97(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.3,146.7,138.5,135.7,135.3,131.9,130.2,129.7,129.6,128.0,127.0,120.3,118.5,118.5,53.7,39.3,37.9,34.6,29.8,29.3,29.1,24.7,22.1,21.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C29H40N3[M+H]+,430.322 2;Found 430.342 7[M+H]+。
1-对溴苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8e) 无色油状物,产率:68%;1H NMR(600 MHz,CDCl3)δ:7.49(2H,d,J=8.0 Hz,3,5-ArH),7.23(1H,s,5-triazole-H),7.14(2H,d,J=8.0 Hz,2,6-ArH),6.03(1H,t,J=7.9 Hz,11-H),5.99(1H,d,J=11.0 Hz,2-H),5.89(1H,d,J=11.0 Hz,3-H),5.44(2H,s,-CH2-Ar),5.15(1H,t,J=7.0 Hz,7-H),2.60~2.52(2H,m,10-H),2.39~2.35(2H,m,13-H),2.34~ 2.31(1H,m,15-H),2.27~2.24(2H,m,14-H),2.24~2.20(2H,m,6-H),2.16~2.14(2H,m,9-H),2.14~2.12(2H,m,5-H),1.71(3H,s,18-H),1.64(3H,s,19-H),0.99(3H,s,16-H),0.98(2H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.6,146.5,135.5,135.3,133.9,132.2,130.1,130.1,129.5,127.1,122.7,120.2,118.5,53.2,39.3,37.8,34.5,29.7,29.2,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C28H37BrN3[M+H]+,494.217 1;Found 494.215 4[M+H]+。
1-对叔丁基苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8f) 无色油状物,产率:61%;1H NMR(600 MHz,CDCl3)δ:7.38(2H,d,J=8.2 Hz,3,5-ArH),7.23(1H,s,5-triazole-H),7.21(2H,d,J=8.2 Hz,2,6-ArH),6.05(1H,t,J=7.9 Hz,11-H),6.01~5.96(1H,m,2-H),5.89(1H,d,J=11.1 Hz,3-H),5.45(2H,s,-CH2-Ar),5.17 ~5.13(1H,m,7-H),2.59~2.51(2H,m,10-H),2.39~2.34(2H,m,13-H),2.34~2.31(1H,m,15-H),2.27~2.24(2H,m,14-H),2.24~2.20(2H,m,6-H),2.16~2.14(2H,m,9-H),2.14~2.12(2H,m,5-H),1.71(3H,s,18-H),1.64(3H,s,19-H),1.30(9H,s,-C(CH3)3),0.98(3H,s,16-H),0.97(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:151.7,150.3,146.6,135.6,135.3,131.9,130.2,129.7,127.7,127.0,125.9,120.3,118.6,118.5,53.6,39.3,37.9,34.6,31.2,29.8,29.3,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C32H46N3[M+H]+,472.369 2;Found 472.392 8[M+H]+。
1-对氰基苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8g) 无色油状物,产率:60%;1H NMR(600 MHz,CDCl3)δ:7.66(2H,d,J=8.1 Hz,3,5-ArH),7.34(2H,d,J=8.1 Hz,2,6-ArH),7.29(1H,s,5-triazole-H),6.04(1H,t,J=7.9 Hz,11-H),5.99(1H,d,J=11.0 Hz,2-H),5.89(1H,d,J=11.0 Hz,3-H),5.55(2H,s,-CH2-Ar),5.15(1H,t,J=6.9 Hz,7-H),2.58(2H,t,J=7.9 Hz,10-H),2.40~2.35(2H,m,13-H),2.35~2.31(1H,m,15-H),2.28~2.25(2H,m,14-H),2.24~2.21(2H,m,6-H),2.17~ 2.15(2H,m,9-H),2.14~2.12(2H,m,5-H),1.71(3H,s,18-H),1.64(3H,s,19-H),0.99(3H,s,16-H),0.98(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.9,146.4,140.1,135.4,135.3,132.7,130.5,130.0,128.3,128.2,127.2,120.2,118.8,118.6,118.1,112.6,53.2,39.3,37.8,34.5,29.7,29.2,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C29H37N4[M+H]+,441.301 8;Found 441.321 0[M+H]+。
1-对甲氧基苄基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8h) 无色油状物,产率:70%;1H NMR(600 MHz,CDCl3)δ:7.23(2H,d,J=8.6 Hz,3,5-ArH),7.20(1H,s,5-triazole-H),6.89(2H,d,J=8.6 Hz,2,6-ArH),6.03(1H,t,J=7.9 Hz,11-H),5.99(1H,d,J=11.0 Hz,2-H),5.90(1H,d,J=11.0 Hz,3-H),5.42(2H,s,-CH2-Ar),5.19~5.11(1H,m,7-H),3.80(3H,s,-OCH3),2.60~2.49(2H,m,10-H),2.38~2.35(2H,m,13-H),2.34~2.31(1H,m,15-H),2.26~2.24(2H,m,14-H),2.23~2.20(2H,m,6-H),2.15~2.14(2H,m,9-H),2.14~2.12(2H,m,5-H),1.70(3H,s,18-H),1.66(3H,s,19-H),0.99(3H,s,16-H),0.97(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:159.8,150.3,146.7,135.7,135.3,130.2,129.7,129.5,127.0,126.9,120.3,118.5,118.4,114.3,55.3,53.5,39.3,37.9,34.6,29.8,29.3,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C29H40N3O[M+H]+,446.317 1;Found 446.328 5[M+H]+。
1-(4-三氟甲基苄基)-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8i) 无色油状物,产率:66%;1H NMR(600 MHz,CDCl3)δ:7.63(2H,d,J=8.1 Hz,3,5-ArH),7.37(2H,d,J=8.1 Hz,2,6-ArH),7.26(1H,s,5-triazole-H),6.05(1H,t,J=7.9 Hz,11-H),5.99(1H,d,J=11.0 Hz,2-H),5.89(1H,d,J=11.0 Hz,3-H),5.56(2H,s,-CH2-Ar),5.15(1H,dt,J=6.9,4.1 Hz,7-H),2.62~2.51(2H,m,10-H),2.40~2.35(2H,m,13-H),2.35~2.31(1H,m,15-H),2.28~2.24(2H,m,14-H),2.24~2.20(2H,m,6-H),2.17~2.15(2H,m,9-H),2.15~2.12(2H,m,5-H),1.71(3H,s,18-H),1.63(3H,s,19-H),0.98(3H,s,16-H),0.97(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.8,146.4,138.9,135.5,135.3,130.3,130.0,128.0,127.1,126.0,126.0,120.2,118.7,118.6,53.3,39.3,37.8,34.5,29.7,29.2,29.1,24.7,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C29H37F3N3[M+H]+,484.294 0;Found 484.317 9[M+H]+。
新巴豆瑞士松炔(7,70 mg,0.25 mmol)溶解于无水甲苯5 mL中,加入肉桂基叠氮(3j,48 mg,0.3 mmol),噻吩-2-甲酸亚铜(2 mg,0.01 mmol),室温搅拌反应3 h,TLC检测反应完全,饱和NH4Cl淬灭反应,乙酸乙酯进萃取,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱分离得到目标产物8j,产率58%。
1-肉桂基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8j) 无色油状物,产率:58%;1H NMR(600 MHz,CDCl3)δ:7.39(1H,s,5-triazole-H),7.40~7.37(2H,m,2,6-ArH),7.34(2H,t,J=7.5 Hz,3,5-ArH),7.29(1H,t,J=7.5 Hz,4-ArH),6.67(1H,d,J=15.8 Hz,-CH=CH-Ar),6.35(1H,dt,J=15.8,6.6 Hz,-CH=CH- Ar),6.06(1H,t,J=7.9 Hz,11-H),6.01(1H,d,J=11.1 Hz,2-H),5.93(1H,d,J=11.1 Hz,3-H),5.16(1H,t,J=7.9 Hz,7-H),5.10(2H,d,J=6.6 Hz,-CH2-CH=CH-),2.63~2.56(2H,m,10-H),2.41~2.37(2H,m,13-H),2.37~2.33(1H,m,15-H),2.31~2.26(2H,m,14-H),2.26~2.21(2H,m,6-H),2.18~2.16(2H,m,9-H),2.15~2.13(2H,m,5-H),1.72(3H,s,18-H),1.69(3H,s,19-H),1.01(3H,s,16-H),1.00(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.3,146.8,135.7,135.5,135.2,135.0,130.3,129.9,128.7,128.4,127.1,126.6,122.2,120.3,118.5,118.5,52.2,39.3,37.9,34.6,29.9,29.6,29.3,29.2,24.7,22.1,17.9,17.6。ESI-HRMSm/z:Calcd.for C30H40N3[M+H]+,442.322 2;Found 442.341 1[M+H]+。
新巴豆瑞士松炔(7,70 mg,0.25 mmol)溶解于无水甲苯5 mL中,加入3-叠氮-1-丙醇(3k,30 mg,0.3 mmol),噻吩-2-甲酸亚铜(2 mg,0.01 mmol),室温搅拌反应4 h后,TLC检测反应完全,饱和NH4Cl淬灭反应,乙酸乙酯进行萃取,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱得到目标产物8k,产率52%。
1-丙醇基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8k) 无色油状物,产率:52%;1H NMR(600 MHz,CDCl3)δ:7.38(1H,s,5-triazole-H),6.06(1H,t,J=7.9 Hz,11-H),6.02(1H,d,J=11.0 Hz,2-H),5.94(1H,d,J=11.0 Hz,3-H),5.16(1H,t,J=6.9 Hz,7-H),4.48(2H,t,J=6.7 Hz,Triazole-CH2-),3.66(2H,t,J=5.8 Hz,-CH2-OH),2.58(2H,t,J=7.9 Hz,10-H),2.41~2.37(2H,m,13-H),2.37~2.34(1H,m,15-H),2.30~2.26(2H,m,14-H),2.26~2.22(2H m,,6-H),2.18~2.16(2H,m,9-H),2.16~2.14(2H,m,5-H),2.14~2.10(2H,m,-CH2-CH2-CH2-OH),1.72(3H,s,18-H),1.70(3H,s,19-H),1.03(3H,s,16-H),1.02(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:150.0,146.7,135.7,135.3,130.2,129.9,127.1,120.3,119.2,118.5,58.8,46.7,39.3,37.9,34.6,32.6,29.9,29.3,29.2,24.7,22.1,22.1,17.8,17.5。ESI-HRMSm/z:Calcd.for C24H38N3O[M+H]+,384.301 5;Found 384.320 1[M+H]+。
将新巴豆瑞士松炔(7,70 mg,0.25 mmol)溶解于无水甲苯5 mL中,室温加入对甲苯磺酰叠氮(3l,59 mg,0.3 mmol),噻吩-2-甲酸亚铜(2 mg,0.01 mmol),室温搅拌反应2 h,TLC检测反应完全,饱和NH4Cl淬灭反应,乙酸乙酯萃取,分出有机层,无水Na2SO4干燥,减压蒸干,柱色谱分离得到目标产物8l,产率65%。
1-对甲基磺酰基-1,2,3-三氮唑-1-H-4-新巴豆瑞士松烷(8l) 无色油状物,产率:65%;1H NMR(600 MHz,CDCl3)δ:7.99(2H,d,J=8.1 Hz,2,6-ArH),7.79(1H,s,5-triazole-H),7.37(2H,d,J=8.1 Hz,3,5-ArH),6.06(1H,t,J=7.7 Hz,11-H),5.94(1H,d,J=11.0 Hz,2-H),5.79(1H,d,J=11.0 Hz,11-H,3-H),5.18~5.10(1H,m,7-H),2.57(2H,t,J=7.7 Hz,10-H),2.44(3H,s,Ar-CH3),2.40~2.34(2H,m,13-H),2.32~2.28(1H,m,15-H),2.26~2.24(2H,m,14-H),2.24~2.22(2H,m,6-H),2.19~2.16(2H,m,9-H),2.16~2.13(2H,m,5-H),1.72(3H,s,18-H),1.63(3H,s,19-H),0.93(3H,s,16-H),0.92(3H,s,17-H)。13C NMR(150 MHz,CDCl3)δ:149.8,147.0,145.8,135.7,134.7,133.3,132.7,130.2,128.9,128.6,127.5,119.8,118.9,117.7,39.2,37.5,34.0,29.2,29.0,28.5,24.7,21.9,21.7,17.9,17.3。ESI-HRMSm/z:Calcd.for C28H38N3O2S[M+H]+,480.268 5;Found 480.287 4[M+H]+。
2.3 MTT法检测体外抗肿瘤活性
对数生长期细胞培养于96孔培养板内,每孔100 μL(含5 000~6 000个肿瘤细胞),置37 ℃,5% CO2温箱中培养。次日,给药组加入含有不同浓度的化合物,每种细胞设4~5个剂量组,每组至少设3个平行孔。对照组加入与给药组等体积的溶剂。置37 ℃,5% CO2温箱中培养。48 h后弃培养液,每孔加5 mg/mL MTT溶液(培养基配制)20 μL。37 ℃孵育4 h,弃上清液,每孔加入DMSO 150 μL溶解甲臜颗粒,轻度振荡溶解。用酶标仪在参考波长450 nm、检测波长570 nm条件下测定吸收度(A),以溶剂对照处理的细胞为对照组,用对照组平均A减去给药组平均A除以对照组平均A,计算药物对细胞的抑制率,根据计算得到的各浓度的抑制率通过Logit方法计算得到半数抑制浓度(IC50),重复测试3次,取平均值为最终结果[13]。
测试12个新的西松烷二萜衍生物的细胞毒活性(表1)。结果显示所合成的新化合物中8b,8c,8e,8f,8h和8i具有细胞毒活性,对HeLa和K562细胞的细胞毒活性与阳性对照药依托泊苷(VP-16)相当,对耐药的K562/A02细胞的细胞毒活性与VP-16相比提高很多。初步构效关系显示,当所合成西松烷型二萜衍生物的取代基三氮唑上连接苯环上时,化合物活性较好,而连接脂肪链时无活性。苯环上连有甲基、叔丁基等给电子基团的化合物,和连有氰基、卤素等吸电子基团的化合物相比活性差异不大。
人类多药耐药基因1(MDR-1)[14]编码一种镶嵌于细胞膜上的泵蛋白P-gp,它在肿瘤多药耐药过程中起到重要的作用。该蛋白表达的增多可以导致药物从肿瘤细胞中外排增强,从而使细胞对于化疗药物表现出相当的抗性,K562/A02细胞株也正是通过上述机制从而产生耐药性。部分衍生物对K562/A02细胞株表现出良好的抗多药耐药作用,说明其很可能通过抑制MDR-1的表达从而提高抗耐药活性,目前,进一步的作用机制研究正在进行中。


CompdIC50/(×10-5mol/L)HeLaK562K562/A02CompdIC50/(×10-5mol/L)HeLaK562K562/A028a>100>100>1008h426±036165±021182±0228b526±042130±024143±0328i365±024183±015323±0208c854±087274±033326±0358j>100>100>1008d>100>100>1008k>100>100>1008e609±038119±022190±0158l>100>100>1008f454±031120±008129±0111454±321>100>1008g>100>100>100VP⁃16211±025082±006191±124
VP-16:etoposide
3 结果与讨论
在许多抗肿瘤药物中都存在三氮唑片段,说明三氮唑基团可能为发挥抗肿瘤作用的重要基团。本研究在西松烷型二萜(CL-8)中引入不同的取代基的三氮唑基团,合成一系列三氮唑系列西松烷型二萜衍生物,其结构经1H NMR,13C NMR和HRMS的确证。以依托泊苷为阳性对照,MTT法测试了所合成的12个不同取代基的三氮唑西松烷型二萜衍生物对HeLa,K562和K562/A02肿瘤细胞的细胞毒活性,结果表明西松烷型二萜引入三氮唑后,对HeLa和K562细胞有细胞毒性,对耐药的K562/A02细胞具有较强的活性,说明此类三氮唑西松烷型二萜衍生物值得进一步研究。
[1] Thao NP,Luyen BTT,Ngan NTT,etal.New anti-inflammatory cembranoid diterpenoids from the Vietnamese soft coralLobophytumcrassum[J].BioorgMedChemLett,2014,24(1):228-232.
[2] Peres MT,Delle Monache F,Cruz AB,etal.Chemical composition and antimicrobial activity ofCrotonurucuranaBaillon (Euphorbiaceae)[J].JEthnopharmacol,1997,56(3):223-226.
[3] Tsacheva I,Rostan J,Iossifova T,etal.Complement inhibiting properties of dragon′s blood fromCrotondraco[J].ZNaturforschC,2004,59(7/8):528-532.
[4] Su JH,Ahmed AF,Sung PJ,etal.Manaarenolides AI,diterpenoids from the soft coralSinulariamanaarensis[J].JNatProd,2006,69(8):1134-1139.
[5] Hassan HM,Sallam AA,Mohammed R,etal.Semisynthetic analogues of the marine cembranoid sarcophine as prostate and breast cancer migration inhibitors[J].BioorgMedChem,2011,19(16):4928-4934.
[6] Fahmy H,Zjawiony JK,Konoshima T,etal.Potent skin cancer chemopreventing activity of some novel semi-synthetic cembranoids from marine sources[J].MarDrugs,2006,4(2):28-36.
[7] Huang HC,Ahmed AF,Su JH,etal.Crassocolides A-F,cembranoids with a transfused lactone from the soft coralSarcophytoncrassocaule[J].JNatProd,2006,69(11):1554-1559.
[8] Sánchez MC,Ortega MJ,Zubía E,etal.Cembrane diterpenes from the gorgonianLophogorgiaperuana[J].JNatProd,2006,69(12):1749-1755.
[9] Wen T,Ding Y,Deng Z,etal.Sinulaflexiolides A-K,cembrane-type diterpenoids from the Chinese soft coralSinulariaflexibilis[J].JNatProd,2008,71(7):1133-1140.
[10] Cuzick J.Anastrozole[J].DrugsToday,2005:41(4):227-239.
[11] Ribatti D,Vacca A,Falco GD,etal.Angiogenesis and anti-angiogenesis in neuroblastoma[J].EurJCancer,2002,38(6):750-757.
[12] Guo L,Li ZS,Wang HL,etal.Carboxyamido-triazole inhibits proliferation of human breast cancer cell via G2/M cell cycle arrest and apoptosis[J].EurJPharmacol,2006,538(1/2/3):15-22.
[13] Cheng WH,Cao B,Shang H,etal.Synthesis and evaluation of novel podophyllotoxin derivatives as potential antitumor agents[J].EurJMedChem,2014,85:498-507.
[14] Mahadevan D.Will MDR-1/P-gp modulators provide clinical benefit in hematologic malignancies[J]?LeukRes,2006,30(9):1077-1078.
