蛋白酪氨酸磷酸酶1B及其抑制剂的研究进展
2018-03-20李乾斌胡高云
袁 仲,陈 卓,李乾斌,胡高云
(中南大学湘雅药学院,长沙 410013)
蛋白酪氨酸磷酸酶1B(PTP1B)广泛存在于体内各组织中,它通过催化磷酸酪氨酸(pTyr)的去磷酸化反应,与蛋白酪氨酸激酶(PTKs)共同维持蛋白酪氨酸的磷酸化水平。PTP1B在T2DM和肥胖症中扮演重要角色[1],它不仅是胰岛素和瘦素信号转导的关键生理调节因子[2],而且其与ER应激[3-4]以及胰岛β细胞[5]之间也有重要关联。因此,近年来PTP1B抑制剂已成为治疗T2DM和肥胖症的研究热点。本文将对PTP1B及其抑制剂的最新研究进展进行综述。
1 PTP1B的结构及重要位点
PTP1B的晶体结构已由Barford研究组[6]报道(图1),其抑制剂主要靶向3个重要位点,即N端的两个芳基磷酸酯结合位点——亲和力高的催化位点(A位点)和亲和力低的非催化位点(B位点),以及距催化口袋约20 Å的C端的变构位点。PTP1B的A位点是由8个氨基酸残基His214-Arg221形成的刚性环状结构,该位点中的Cys215在催化过程中至关重要(图2)。WPD环的封闭构象、Asp181、Arg221以及Lys120对PTP1B的催化过程也有重要影响[7-9]。值得注意的是,PTP1B的催化中心高度保守(TCPTP的催化中心与PTP1B的几乎完全相同),且其活性位点口袋带正电,因此,竞争性PTP1B抑制剂的选择性和细胞膜通透性问题亟待解决。由Arg24、Arg254、Met258和Gln262等组成的亲脂性非保守位点B对底物特异性识别具有重要的调节作用,其中Arg24和Arg254胍基与pTyr底物间的相互作用最为关键。变构位点由α3、α6和α7等一些独一无二的α螺旋组成。WPD环的封闭构象与α7-α3-α6之间的相互作用有关,变构抑制剂通过阻断它们之间的相互作用,抑制WPD环的封闭,进而使PTP1B失活[10-11]。

图1 蛋白酪氨酸磷酸酶1B(PTP1B)晶体结构(PDB ID:1PTV)

图2 PTP1B的催化过程
2 PTP1B与T2DM和肥胖症的关系
糖尿病已成为继心血管疾病及肿瘤之后的第三大威胁人类生命健康的代谢性疾病,其中以T2DM最为常见。肥胖症亦属于代谢性疾病,它是胰岛素抵抗、T2DM以及心血管疾病的高危因素[12]。PTP1B作为T2DM和肥胖症治疗的潜在靶点[1,13-14],不仅能负调控胰岛素和瘦素信号通路,而且也与ER应激和胰岛β细胞密切相关。
2.1 PTP1B负调控胰岛素和瘦素信号通路
PTP1B是胰岛素和瘦素信号通路中的重要负调控因子[15](图3)。与胰岛素结合后,胰岛素受体(IR)细胞质部分的受体酪氨酸激酶(RTK)域会被激活,随后受体的多个Tyr残基及下游胰岛素受体底物1(IRS1)磷酸化,进而激活PI3K-Akt通路,导致4型葡萄糖转运蛋白(GLUT4)转移至细胞表面,促进葡萄糖的摄取。Akt也可通过抑制GSK3活性刺激糖原合成[16]。PTP1B促使磷酸化的IR和IRS1脱去磷酸,进而终止IR信号,抑制细胞对葡萄糖的摄取,产生胰岛素抵抗。瘦素与瘦素受体(ObR)结合后使JAK2及下游STAT3磷酸化,磷酸化的STAT3转移至细胞核,对控制脂质稳态、食物摄取以及能量消耗的相关靶基因转录进行调控[17]。PTP1B使瘦素活化的JAK2去磷酸化失活,从而抑制瘦素信号转导。有趣的是,瘦素可通过PI3K-AKT信号通路诱导αAMPK丝氨酸485/491磷酸化并减少食物摄入[18],这表明PI3K可能在胰岛素和瘦素信号通路之间有交叉作用,同时也暗示抑制PTP1B是改善肥胖症中胰岛素和瘦素抵抗的有效策略。
2.2 PTP1B与ER应激
ER应激可导致肥胖相关胰岛素抵抗,是肥胖、胰岛素抵抗和T2DM之间的一个关键环节[19-20]。PTP1B位于ER膜上,与ER应激密切相关。最近有报道显示,在培养的肌管中,ER应激上调PTP1B的表达,并使葡萄糖摄取减少,另一方面,PTP1B基因沉默导致ER应激通路受损,使葡萄糖恢复至正常水平[3];在肥胖情况下,骨骼肌中的ER应激可通过激活ROS-NF-κB信号通路诱导PTP1B的表达,导致胰岛素抵抗[4]。此外,肝特异性敲除PTP1B基因能改善高脂饮食诱导的ER应激[21]。鉴于PTP1B在肥胖症中对ER应激相关的胰岛素抵抗的介导作用,有望成为治疗肥胖症和T2DM的有效靶点。
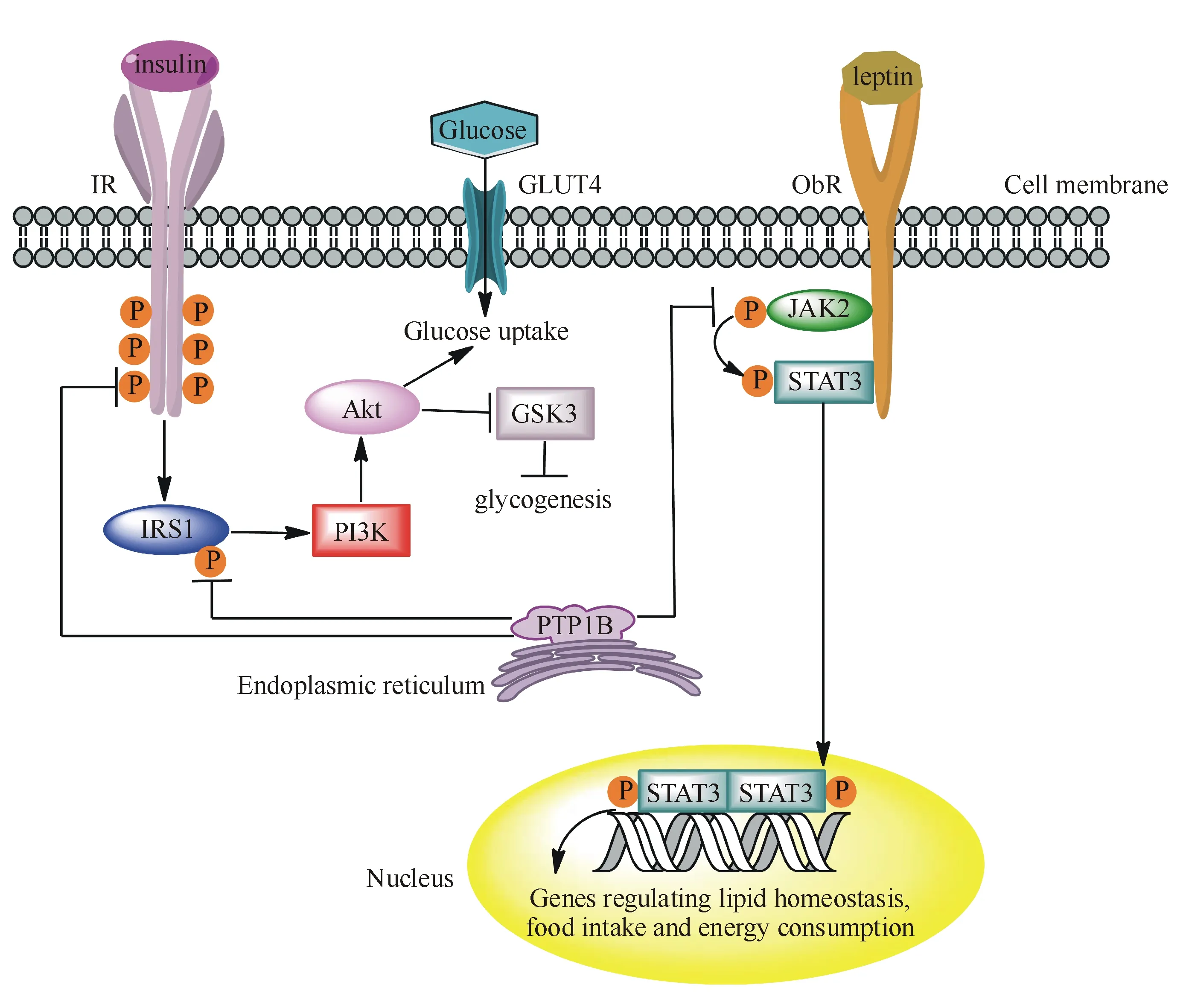
图3 PTP1B在胰岛素和瘦素信号通路中的负调控作用
2.3 PTP1B在胰岛β细胞中的作用
胰岛β细胞是一种能分泌胰岛素的内分泌细胞。PTP1B基因敲除小鼠的胰岛形态分析结果显示,相比于野生对照组,PTP1B基因敲除小鼠的胰岛β细胞量增加;同时,葡萄糖刺激的胰岛素分泌增强[5]。Liu等[22]通过实验确定了胰岛β细胞中的EphA5是PTP1B底物。以上数据表明,PTP1B可能与胰岛β细胞的增殖、凋亡以及胰岛素的分泌有着密切联系,因而抑制PTP1B可能会改善T2DM患者中胰岛β细胞分泌功能。
3 PTP1B抑制剂研究进展
迄今为止,只有3个PTP1B小分子抑制剂ertiprotafib (1)、MSI-1436(2)和JTT-551(3)进入临床试验(图4),但它们最终因疗效不佳或不良反应而终止研发[15]。选择性不佳和细胞膜通透性差是阻碍PTP1B小分子抑制剂开发进程的主要原因。因此,抑制剂需要选择性作用于PTP1B以减少不良反应;此外,大多数竞争性PTP1B抑制剂含有带负电荷的极性基团,难以透过细胞膜,可在综合考虑相对分子质量大小的同时增强疏水性以改善其药代动力学性质。尽管面临以上难题,但由于PTP1B在T2DM和肥胖症中具有多方面重要作用,一些经典结构类型的PTP1B抑制剂如二氟亚甲基磷酸类(DFMP)、草酰氨基苯甲酸类(OBA)、苯氧乙酸类等在过去10年仍得到了广泛研究。本文根据作用位点,将近几年(2013—2016)发现的新型PTP1B抑制剂进行分类,并对其进行归纳总结。
3.1 靶向A位点的小分子PTP1B抑制剂
大部分靶向A位点的PTP1B抑制剂为带有电负性基团的pTyr模拟物,旨在竞争性地结合于A催化位点。本文中,靶向A位点的PTP1B抑制剂结构主要分为两种,即羧酸类化合物和芳基磺酰胺类化合物,如图5所示。

图4 进入临床试验的小分子PTP1B抑制剂

图5 靶向A位点的PTP1B抑制剂结构和PTP1B抑制活性
近几年羧酸化合物作为pTyr模拟物被频繁应用到PTP1B抑制剂中。Zhi等[23]已报道芳基二酮酸是一类靶向酶失活构象并具有较好选择性和活性的新型非竞争性PTP1B抑制剂,然而一些二酮酸不稳定,因此最近该研究组以芳基二酮酸化合物4(IC50=20 μmol/L)为起点,采用生物电子等排策略首次引入新型pTyr替代物4-喹诺酮-3-羧酸骨架。此外,基于前期研究基础在喹诺酮C-6、N-1或C-3位引入一些疏水性基团和芳基二酮酸结构可增强化合物的活性并改善其药物代谢动力学性质。活性最好的竞争性PTP1B抑制剂5[23]既有合适的细胞渗透性,又能显著增强CHO/hIR细胞中的胰岛素信号,同时药理学性质也得以改善,该化合物的结构以及设计方法对PTP1B抑制剂的开发具有一定参考价值。Tang等[24]最近报道了一个3-苯丙酸类化合物6,其钠盐在高脂饮食诱导的胰岛素抵抗小鼠模型中既能显著增强胰岛素敏感性,又能降低血清中三酰甘油和总胆固醇的水平。另外,由Zhang课题组[25]报道的苯甲酸类竞争性PTP1B抑制剂7可与催化位点残基Cys215-Gly218及Gly220-Arg221形成氢键作用,改善饮食诱导肥胖(DIO)小鼠的胰岛素抵抗,增强胰岛素诱导的IRβ/IRS1磷酸化。
Balaramnavar等[26]基于药效团模型、分子对接以及骨架跳跃方法发现了萘基取代的磺酰胺化合物8,并对其进行了多种生物实验。该化合物显著改善多种小鼠模型的空腹和随机血糖水平,改善胰岛素抵抗,它还可通过调控与胰岛素信号相关的基因的表达,如IRS1-2、PI3K、Akt2等,从而增强胰岛素的作用。此外,以30 mg/kg的剂量对大鼠进行灌胃给药后发现,该化合物具有较好的口服生物利用度(约10.29%)。综上表明,化合物8具有理想的理化性质和生物利用度,为新型PTP1B抑制剂的研发提供结构基础。
3.2 靶向B位点的小分子PTP1B抑制剂
因PTP1B A位点氨基酸序列高度保守,故大多数靶向该位点的抑制剂存在较差的选择性,同时作用于A、B双位点的靶向策略能明显的改善这一状况。
芳基磺酰胺类化合物是研究较为广泛的一类双结合位点PTP1B抑制剂。其中,由Li课题组报道的一类芳基甲磺酰胺类化合物9[27]、10[28]、11[29](如图6)对TCPTP均具有较好的选择性,而且化合物9的选择性更是高达120倍以上;另外,该3个化合物均显示有细胞活性,且能明显增强胰岛素介导的IRβ磷酸化和胰岛素刺激的葡萄糖摄取。化合物11表现出优异的活性,原因可能与其能完全占据A、B位点并可延伸至一个大的平面位点等结合特点有关。这些新化合物可为有效的选择性PTP1B抑制剂的设计和开发提供新的见解。

图6 化合物9~11的化学结构及PTP1B、TCPTP抑制活性
1,3-噻唑烷-4-酮类双位点PTP1B抑制剂12[30]表现出明显的PTP1B抑制活性和选择性(如图7),该化合物通过显著增强IRβ磷酸化和促进2-脱氧葡萄糖摄入进而调控小鼠C2C12骨骼肌细胞中的胰岛素信号通路。分子对接显示:化合物12与催化中心中关键残基发生静电及氢键作用;与羧基相连的芳基与Phe182、Tyr46和Ala217发生π-π堆叠和疏水作用;Lys120与C-2位苯亚氨基中N原子形成氢键,而与芳环发生π-阴离子作用;5-亚芳基部分的末端苯环位于非催化口袋内,且与Arg24的胍基形成π-阴离子作用。除此之外,5-亚芳基显著影响PTP1B抑制活性,在此处延伸连接两个芳环的链长能得到更为有效的PTP1B抑制剂,而在该位置引入2-苯乙氧基后既影响抑制活性又能改变抑制机制。最近Meng等[31]合成了含1,3-噻唑烷-4-酮骨架的PTP1B抑制剂13,结构中吡咯环3位取代的羧酸酯被设计为pTyr的生物电子等排阴离子基团,是获得低极性PTP1B抑制剂的有效方法。Ma等[32]基于“母核跳跃”方法合成了一系列咪唑烷-2,4-二酮类选择性PTP1B抑制剂,其中PTP1B抑制活性较好的化合物14对TCPTP的选择性达30倍以上,对接研究表明其结构中的咪唑烷-2,4-二酮与A位点残基Csy215-Ala217形成氢键作用,而芳环尾部则很好地嵌合在由几个B位点中的关键残基如Met 258、Arg 24和Arg 254等形成的口袋中;该化合物具有较高的研究价值。

图7 化合物12~14的化学结构和PTPs抑制活性
3.3 新型PTP1B变构抑制剂
靶向亲水性和保守性均较低的变构位点可成为克服有限的细胞膜通透性以及实现选择性的有效方法,这为PTP1B抑制剂的开发提供了新思路。迄今为止靶向PTP1B变构位点的抑制剂尚不多,本文就图8中所示的变构抑制剂做详细介绍。

图8 新型PTP1B变构抑制剂结构和PTPs抑制活性
2004年,Wiesmann等[10]首次发现了PTP1B的变构位点,并得到了PTP1B抑制活性很好的化合物15(即图9-A中Compound 2),此化合物结合于由α3和α6螺旋形成的凹槽内,结构中苯并呋喃部分位于Leu192、Phe196和Phe280所形成的疏水口袋中,酮羰基和Asn193侧链形成氢键,磺酰胺中N原子也与Glu276的羧基形成氢键作用,苯酚基团通过水分子介导与Phe196主链羰基形成氢键(如图9-B)。此外,化合物15与沿着螺旋α3和α6的侧链形成广泛的疏水作用。Tang等[33]基于变构抑制剂15,在保留药物特征的同时通过分子骨架设计合成了新结构化合物16,其中磺胺噻唑部分保持不变,苯并呋喃由取代苯基代替以改善配体效率。对接结果表明该化合物与变构位点的相互作用与化合物15相似,苯环B位于由Ala189、Leu192和Phe280侧链形成的疏水口袋中,在噻唑环和Phe280之间观察到π-π堆积作用,酮羰基氧与Asn193以及酰胺氮与Glu276之间均有氢键作用。化合物16对PTP1B的抑制活性是TCPTP抑制活性的13倍,且其在胰岛素抵抗小鼠体内能显著增强胰岛素敏感性,故该变构抑制剂值得深入研究。
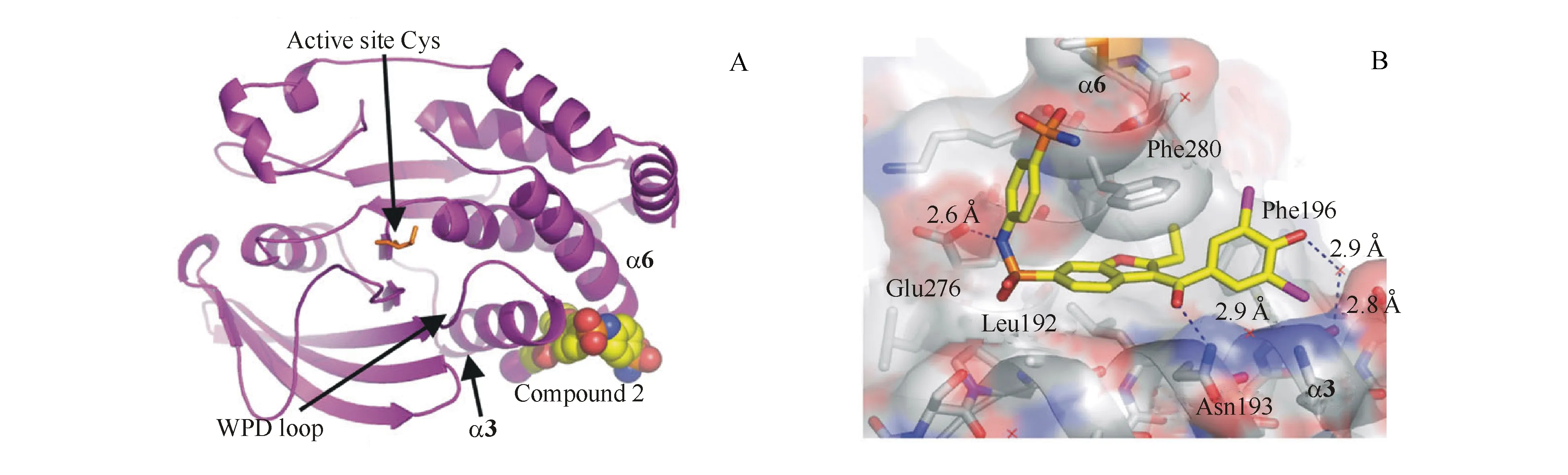
图9 化合物15与PTP1B的晶体结构图[10]
根据Ottana等[34]的最新报道,该研究组在对1,3-噻唑烷-4-酮衍生物的后续研究中发现了一个新的变构位点,并合成了两个PTP1B抑制活性较好的化合物17和18。与前面提及的变构位点不同,此位点位于一个β-片段(包含Leu71和Lys73)与一个亲脂性的封闭口袋(其封闭状态由Pro210-Leu204组成的环所致)之间。化合物17似乎与两个不相互排斥的位点结合,即催化区和新确定的变构位点。该化合物与新变构位点的结合模式如图10所示,它不仅与Lys237形成离子相互作用,而且与Gln78和Ser80的侧链形成氢键,其苄氧基部分被掩埋于亲脂性腔中。虽然化合物17是有效的PTP1B抑制剂,但它们在HepG2细胞中无任何的拟胰岛素作用,不能排除其可能是负面干扰胰岛素信号通路的下游因子。另一方面,化合物18主要结合于活性位点。在HepG2和C2C12细胞中,化合物18通过增强IRβ酪氨酸磷酸化水平进而活化IR,除此之外,它也能激活下游Akt并增加C2C12骨骼肌细胞中2-脱氧葡萄糖的摄入。化合物18作为新型PTP1B抑制剂不仅具有拟胰岛素作用,而且还表现出抗炎性质,可将其视为先导化合物用于PTP1B抑制剂的进一步研究。

图10 化合物17与新变构位点的结合模式[34]
3.4 新型天然PTP1B抑制剂
近几年来,大量天然产物及其衍生物表现出显著的PTP1B抑制活性,部分新型天然PTP1B抑制剂的结构和活性如图11所示。

图11 新型天然PTP1B抑制剂结构和PTPs抑制活性
Li等[35]通过甘草黄酮化合物库的筛选发现了新非竞争性PTP1B抑制剂19,与之前分离得到的竞争性PTP1B抑制剂20相比,活性有所增强,然而对同源酶VHR显示出较差的选择性(图11)。在75 μmol/L浓度时,生物碱类竞争性PTP1B抑制剂21[36]对PTP1B抑制率为TCPTP的3.2倍,该化合物与Cys215、Tyr46、Phe182、Lys120等关键残基作用,C-3脂肪侧链的延伸可导致抑制活性降低,而C-4由甲基、乙基取代或C-9由甲氧基取代的化合物转变为非竞争性PTP1B抑制剂。最近分离得到的香豆素22[37]也有显著的PTP1B抑制活性。经半合成得到的模绕酮酸衍生物23[38]对TCPTP显示有非常好的选择性,该化合物作用于B位点。Chen等[39]基于环状二硫化合物库筛选和结构修饰合成了结构罕见的1,2-二硫戊环-4-取代苯甲酸酯化合物24,它不仅显著抑制PTP1B活性,而且对TCPTP显示出约3倍选择性。
4 结 语
目前进入临床试验的PTP1B抑制剂较少,大多数抑制剂还停留在初步研究阶段,选择性和细胞膜通透性是该类药物研发的两大壁垒。PTP1B抑制剂同时靶向A、B位点或靶向亲脂性低保守变构位点可改善其选择性和细胞膜通透性;因此,开发不同结构类型的双位点PTP1B抑制剂和变构抑制剂可作为高效、高选择性以及较好药代动力学性质的PTP1B抑制剂的主要发展方向。另外,芳基二酮酸、芳基磺酰胺、1,3-噻唑烷-4-酮类化合物有较好的药理学性质,对其进行进一步研究有望推动PTP1B抑制剂的开发进程。
[1] Owen C,Lees EK,Grant L,etal.Inducible liverspecific knockdown of protein tyrosine phosphatase 1B improves glucose and lipid homeostasis in adult mice[J].Diabetologia,2013,56(10):2286-2296.
[2] Bakke J,Haj FG.Protein-tyrosine phosphatase 1B substrates and metabolic regulation[J].SeminCellDevBiol,2015,37: 58-65.
[3] Panzhinskiy E,Hua Y,Culver B,etal.Endoplasmic reticulum stress upregulates protein tyrosine phosphatase 1B and impairs glucose uptake in cultured myotubes[J].Diabetologia,2013,56(3):598-607.
[4] Panzhinskiy E,Ren J,Nair S.Protein tyrosine phosphatase 1B and insulin resistance:role of endoplasmic reticulum stress/reactive oxygen species/nuclear factor kappa B axis[J].PLoSOne,2013,8(10):e77228.
[5] Fernandez-Ruiz R,Vieira E,Garcia-Roves PM,etal.Protein tyrosine phosphatase-1B modulates pancreatic β-cell mass[J].PLoSOne,2014,9(2):e90344.
[6] Barford D,Flint AJ,Tonks NK.Crystal structure of human protein tyrosine phosphatase 1B[J].Science,1994,263(5152):1397-1404.
[7] Ozcan A,Olmez EO,Alakent B.Effects of protonation state of Asp181 and position of active site water molecules on the conformation of PTP1B[J].Proteins,2013,81(5):788-804.
[8] Liu M,Wang L,Sun X,etal.Investigating the impact of Asp181 point mutations on interactions between PTP1B and phosphotyrosine substrate[J].SciRep,2014,4:5095.
[9] Brandão TA,Hengge AC,Johnson SJ.Insights into the reaction of protein-tyrosine phosphatase 1B:crystal structures for transition state analogs of both catalytic steps[J].JBiolChem,2010,285(21):15874-15883.
[10] Wiesmann C,Barr KJ,Kung J,etal.Allosteric inhibition of protein tyrosine phosphatase 1B[J].NatStructMolBiol,2004,11(8):730-737.
[11] Li S,Zhang J,Lu S,etal.The mechanism of allosteric inhibition of protein tyrosine phosphatase 1B[J].PLoSOne,2014,9(5):e97668.
[12] Briancon N,McNay DE,Maratos-Flier E,etal.Combined neural inactivation of suppressor of cytokine signaling-3 and protein-tyrosine phosphatase-1B reveals additive,synergistic,and factor-specific roles in the regulation of body energy balance[J].Diabetes,2010,59(12):3074-3084.
[13] Elchebly M,Payette P,Michaliszyn E,etal.Increased insulin sensitivity and obesity resistance in mice lacking the protein tyrosine phosphatase-1B gene[J].Science,1999,283(5407):1544-1548.
[14] Waring JF,Ciurlionis R,Clampit JE,etal.PTP1B antisense-treated mice show regulation of genes involved in lipogenesis in liver and fat[J].MolCellEndocrinol,2003,203(1/2):155-168.
[15] Qian S,Zhang M,He Y,etal.Recent advances in the development of protein tyrosine phosphatase 1B inhibitors for type 2 diabetes[J].FutureMedChem,2016,8(11):1239-1258.
[16] Frame S,Cohen P.GSK3 takes centre stage more than 20 years after its discovery[J].BiochemJ,2001,359(1):1-16.
[17] Panzhinskiy E,Ren J,Nair S.Pharmacological inhibition of protein tyrosine phosphatase 1B:a promising strategy for the treatment of obesity and type 2 diabetes mellitus[J].CurrMedChem,2013,20(21):2609-2625.
[18] Dagon Y,Hur E,Zheng B,etal.p70S6 kinase phosphorylates AMPK on serine 491 to mediate leptin′s effect on food intake[J].CellMetab,2012,16(1):104-112.
[19] Ozcan U,Yilmaz E,Ozcan L,etal.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes[J].Science,2006,313(5790):1137-1140.
[20] Fu S,Watkins SM,Hotamisligil GS.The role of endoplasmic reticulum in hepatic lipid homeostasis and stress signaling[J].CellMetab,2012,15(5):623-634.
[21] Agouni A,Mody N,Owen C,etal.Liver-specific deletion of protein tyrosine phosphatase (PTP) 1B improves obesity- and pharmacologically induced endoplasmic reticulum stress[J].BiochemJ,2011,438(2):369-378.
[22] Liu S,Xi Y,Bettaieb A,etal.Disruption of proteintyrosine phosphatase 1B expression in the pancreas affects β-cell function[J].Endocrinology,2014,155(9):3329-3338.
[23] Zhi Y,Gao LX,Jin Y,etal.4-Quinolone-3-carboxylic acids as cell-permeable inhibitors of protein tyrosine phosphatase 1B[J].BioorgMedChem,2014,22(14):3670-3683.
[24] Tang YB,Liu JZ,Zhang SE,etal.3-Phenylpropanoic acid-based phosphotyrosine (pTyr) mimetics:hit evolution to a novel orally active protein tyrosine phosphatase 1B (PTP1B) inhibitor[J].ChemMedChem,2014,9(5):918-921.
[25] Zhang X,Tian J,Li J,etal.A novel protein tyrosine phosphatase 1B inhibitor with therapeutic potential for insulin resistance[J].BrJPharmacol,2016,173(12):1939-1949.
[26] Balaramnavar VM,Srivastava R,Rahuja N,etal.Identification of novel PTP1B inhibitors by pharmacophore based virtual screening,scaffold hopping and docking[J].EurJMedChem,2014,87:578-594.
[27] Du Y,Ling H,Zhang M,etal.Discovery of novel,potent,selective and cellular active ADC type PTP1B inhibitors via fragment-docking-oriented de novel design[J].BioorgMedChem,2015,23(15):4891-4898.
[28] Liu P,Du Y,Song L,etal.Novel,potent,selective and cellular active ABC type PTP1B inhibitors containing (methanesulfonyl-phenyl-amino)-acetic acid methyl ester phosphotyrosine mimetic[J].BioorgMedChem,2015,23(21):7079-7088.
[29] Liu P,Du Y,Song L,etal.Discovery of novel,high potent,ABC type PTP1B inhibitors with TCPTP selectivity and cellular activity[J].EurJMedChem,2016,118:27-33.
[30] Ottanà R,Maccari R,Mortier J,etal.Synthesis,biological activity and structure-activity relationships of new benzoic acid-based protein tyrosine phosphatase inhibitors endowed with insulinomimetic effects in mouse C2C12 skeletal muscle cells[J].EurJMedChem,2014,71:112-127.
[31] Meng G,Zheng M,Wang M,etal.Design and synthesis of new potent PTP1B inhibitors with the skeleton of 2-substituted imino-3-substituted-5-heteroarylidene-1,3-thiazolidine-4-one:part I[J].EurJMedChem,2016,122:756-769.
[32] Ma Y,Sun SX,Cheng XC,etal.Design and synthesis of imidazolidine-2,4-dione derivatives as selective inhibitors by targeting protein tyrosine phosphatase-1B over T-cell protein tyrosine phosphatase[J].ChemBiolDrugDes,2013,82(5):595-602.
[33] Tang YB,Lu D,Chen Z,etal.Design,synthesis and insulin-sensitising effects of novel PTP1B inhibitors[J].BioorgMedChemLett,2013,23(8):2313-2318.
[34] Ottanà R,Paoli P,Naß A,etal.Discovery of 4-[(5-arylidene-4-oxothiazolidin-3-yl)methyl]benzoic acid derivatives active as novel potent allosteric inhibitors of protein tyrosine phosphatase 1B:insilicostudies andinvitroevaluation as insulinomimetic and anti-inflammatory agents[J].EurJMedChem,2017,127:840-858.
[35] Li W,Li S,Higai K,etal.Evaluation of licorice flavonoids as protein tyrosine phosphatase 1B inhibitors[J].BioorgMedChemLett,2013,23(21):5836-5839.
[36] Sasaki T,Li W,Higai K,etal.Canthinone alkaloids are novel protein tyrosine phosphatase 1B inhibitors[J].BioorgMedChemLett,2015,25(9):1979-1981.
[37] Ali MY,Jannat S,Jung HA,etal.Coumarins from Angelica decursiva inhibit α-glucosidase activity and protein tyrosine phosphatase 1B[J].ChemBiolInteract,2016,252:93-101.
[38] Cerón-Romero L,Paoli P,Camici G,etal.InvitroandinsilicoPTP-1B inhibition andinvivoantidiabetic activity of semisynthetic moronic acid derivatives[J].BioorgMedChemLett,2016,26(8):2018-2022.
[39] Chen J,Gao LX,Gong JX,etal.Design and synthesis of novel 1,2-dithiolan-4-yl benzoate derivatives as PTP1B inhibitors[J].BioorgMedChemLett,2015,25(10):2211-2216.
