大穗型水稻品种抽穗开花期遭遇高温后的结实表现*
2018-03-19陈建珍闫浩亮穆麒麟朱开典张运波田小海
陈建珍,闫浩亮,刘 科,穆麒麟,朱开典,张运波,田小海
(1.长江大学农学院,荆州 434025;2.主要粮食作物产业化湖北省协同创新中心,长江大学,荆州 434025)
水稻是全球主要粮食作物之一,据预测,至2050年需达到8亿t才能满足市场需求[1]。中国是水稻的主产国之一,但近年水稻产量呈下降趋势[2],培育大穗、扩大库容是进一步提高水稻产量的途径之一[3]。袁隆平[4]曾提出选育产量为 16~18t·hm-2甚至 18~20t·hm-2的超级杂交稻组合的设想,且认为实现这一目标要采用现有的单穗重 7~8g的大穗型水稻为材料。但现有的大穗型水稻品种主要是通过增加二次枝梗籽粒的比例实现,粒位间差异大,结实稳定性差,影响了高产潜力的实现[5-7]。
预估到本世纪末,全球平均地表温度将比1986−2005年增加0.3~4.8℃[8]。在全球增温的背景下,中国高温发生的频率和气温增幅将更大[9],水稻高温热害发生的几率也将增加[10],严重影响中国水稻的高产和稳产。因此,探明大穗型水稻在抽穗开花期遭遇高温热害后的结实表现及其机理对保障中国粮食安全具有重要意义。
抽穗开花期是水稻对高温最敏感的时期,一般认为,雄性器官对高温更为敏感[11]。花期高温胁迫会导致花粉活力和萌发率降低,颖花败育,受精率降低[12]。原因可能是,花期高温导致剑叶净光合速率降低,叶片经光合作用合成并通过韧皮部输送到花粉中的蔗糖减少,进而降低花粉中淀粉的合成,影响花粉活力和育性[12-16]。李敏等[17]研究发现,抽穗开花期剑叶光合能力越强的品种,耐高温能力越强,花期高温对其结实率的危害越小。千粒重是籽粒灌浆充实的结果,主要受水稻开花前后的营养状况、环境条件以及源库关系的影响。谢晓金等[18]研究认为,随着抽穗开花期温度的升高和胁迫时间的延长,水稻品种的千粒重显著降低。但是,Cao等[19]研究发现,花期高温(38℃/28℃)处理后,不同品种结实籽粒的千粒重呈升高和降低两种变化趋势。可见,抽穗开花期高温对颖花受精率和籽粒千粒重的影响较大,但以往相关研究报道针对普通穗型水稻品种较多,针对大穗型品种较少;同时针对整穗的较多,而针对不同粒位颖花的较少。因此,本试验模拟湖北省典型高温发生年田间高温的变化特征,研究抽穗开花期高温(日平均气温30℃和33℃)处理后,大穗型水稻颖花受精率和籽粒千粒重的变化,比较分析品种间和同一品种粒位间的差异,旨在探明大穗型水稻品种在抽穗开花期遭遇高温后的结实差异及其原因,为水稻的超高产育种提供理论指导。
1 材料与方法
1.1 试验材料
供试材料为 BL006、R-农白和黄华占 3个水稻品种,其中,BL006和 R-农白的穗粒数分别为 245粒和 281粒,属大穗型,对照品种黄华占的穗粒数为210粒,属中穗型。试验于2015年在湖北荆州长江大学农学院的试验场进行(112°31′E,30°21′N)。2015年4−6月,将每个品种分4期播种,于大田进行育秧,待秧龄 25d左右时选取长势一致的秧苗移栽至塑料桶(内径 30cm、高 32cm)内培养,每期10桶,每桶20株。试验采用分期播种以保证试验材料避开处理时段之外的高温危害,此外,采用积温法调整播种日期以使各水稻品种的抽穗开花期基本一致,从而选出合适的试验材料。在稻株生长期间,定期剪除分蘖,只留主茎,以保证同期各盆内的秧苗长势基本一致。栽培用土为试验基地0−20cm的表层土,自然风干后打碎、过筛,每桶装土 12.5kg,与复合肥8g(N:P2O5:K2O=26:10:15)混匀,肥料只作基肥施用。播种日期见表1。
1.2 处理设置
试验共设3个温度水平,分别为日平均气温26℃(CK)、30℃(HT1)和33℃(HT2)。于水稻抽穗扬花期的前一天,选取长势一致且同一天抽穗扬花的稻穗挂牌标记,并将水稻材料移入日光型人工气候室(型号 AGC-MR,浙江产)中进行温度处理,处理时间为 3d,每天调换盆栽桶的位置,以保证所有稻株所受温度和光照条件一致。人工气候室温度的设定模拟大田昼夜温度变化,每小时变化 1次(变化幅度为 0~3℃),湿度为恒湿模式(75%),温度的具体变化过程见图1。高温处理结束后,将水稻植株与对照均放置在适温条件下继续生长直到成熟。

表1 2015年3个试验品种的播种日期(月-日)Table 1 Sowing dates of three cultivars in 2015(mm-dd)
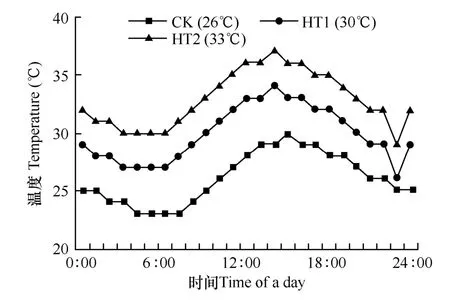
图1 各处理一日内每小时的温度变化Fig. 1 Hourly changes of temperature in a day
1.3 项目测定
1.3.1 颖花受精率和籽粒千粒重
在水稻成熟期,每一品种每个处理随机选取 10个标记穗,3次重复。以穗长为基准,从穗轴中部将稻穗等分成上、下两部分,然后分别将一次枝梗和二次枝梗分开,由此分成上部一次枝梗、上部二次枝梗、下部一次枝梗和下部二次枝梗 4部分,按部位分开取样和分装[20],考察颖花受精率和籽粒千粒重。用食指和拇指挤压籽粒判断受精与否,凡有结实触感的饱粒和瘪粒均计为受精粒,其余的计为非受精粒[21]。

1.3.2 剑叶净光合速率和蒸腾速率
在高温处理结束后第1天的8:30−12:00,用LI-6400(美国产)光合仪测定剑叶的净光合速率(Pn)和蒸腾速率(Tr)等生理因子。采用开放式气路,CO2浓度约为 380µmol·L-1,选择红蓝光源叶室,光合有效辐射(PAR)设定为 1000µmol·m-2·S-1。每处理每重复选取 3片生长一致且受光方向相近的剑叶进行测定。
1.4 数据处理
试验数据采用 Excel2010进行初步整理,用DPS7.05进行统计分析,采用LSD法检验处理间的差异性(P<0.05)。
2 结果与分析
2.1 抽穗开花期高温处理后水稻颖花受精率的表现
由图2可见,与对照26℃处理(CK)相比,抽穗开花期高温处理后,3个品种的颖花受精率均显著降低。HT1(30℃)处理后,BL006、R-农白和黄华占3个品种的颖花受精率分别比CK降低了10.37、10.05和 7.24个百分点,当抽穗开花期温度提高到33℃时,BL006和R-农白的颖花受精率急剧下降,比 CK分别下降 53.17和65.38个百分点,比 HT1(30℃)处理分别下降42.80和55.33个百分点,而此时中穗型品种黄占华的颖花受精率则与 HT1(30℃)处理差异不显著。说明 BL006和 R-农白两个大穗型水稻品种在抽穗开花期遇到高温后颖花受精率将严重受损,且随着温度升高受损程度加大,中穗型品种在抽穗开花期遇到 30℃高温后的颖花受精率严重受损,但当日平均温度上升到 33℃时颖花受精的损害并未加重。
由表2可知,与CK相比,抽穗开花期高温处理后,各品种不同部位的颖花受精率均降低,降幅因处理温度、品种和部位而异。HT1(30℃)处理后,BL006下部一次枝梗和R-农白上部一次枝梗的颖花受精率无显著变化,其它部位的颖花受精率显著降低,且均为下部二次枝梗的降幅最大,分别比CK降低15.77和19.12个百分点;中穗型品种黄华占仅下部二次枝梗的颖花受精率显著降低,比CK降低11.74个百分点。当抽穗开花期温度升至 33℃时,BL006和R-农白不同部位的颖花受精率较CK显著降低,BL006不同部位的降幅表现为下部二次枝梗>下部一次枝梗>上部二次枝梗>上部一次枝梗,R-农白上部一次枝梗颖花受精率的降幅最大(72.59个百分点),其它部位相近(59.92~68.80个百分点);中穗型品种黄华占下部二次枝梗的颖花受精率则无显著变化,其上部一次枝梗的降幅最大(19.19个百分点),其它两个部位的降幅相近,分别为9.39和12.10个百分点。说明在抽穗开花期遭遇高温后,3个水稻品种不同部位颖花受精率的受损程度不同,且随着温度的升高,受损程度加大,大穗型水稻品种 BL006和 R-农白受损的范围和程度大于中穗型品种黄华占;HT1(30℃)处理后,下部二次枝梗的颖花受精率受损最重,HT2(33℃)处理后,BL006下部二次枝梗的颖花受精率受损最重,R-农白和黄华占上部一次枝梗的颖花受精率受损最重。
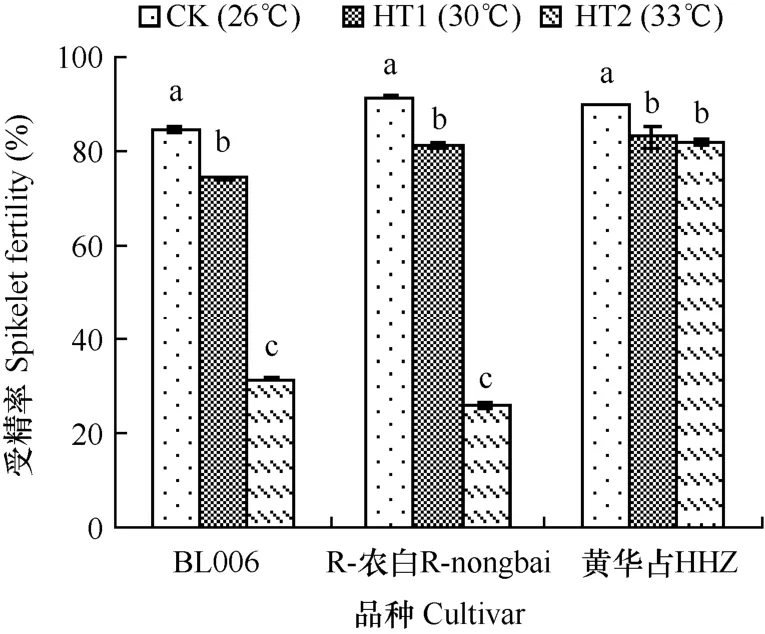
图2 3个水稻品种在抽穗开花期不同温度处理下颖花受精率的比较Fig. 2 Comparison of the spikelet fertilities of three rice cultivars among treatments

表2 同一品种不同处理条件下各部位颖花受精率(%)的比较(平均值±标准误)Table 2 Comparison of spikelet fertilities(%)on different grain positions among treatments (mean±standard error)
2.2 抽穗开花期高温处理后水稻千粒重的表现
由图3可见,与CK相比,抽穗开花期高温处理后,不同水稻品种结实粒的千粒重总体降低,仅个别升高,其中,R-农白(33℃处理后)和黄华占(30℃处理后)的千粒重较CK显著升高,这可能与抽穗开花期高温处理后 R-农白和黄华占颖花受精率较 CK显著降低,结实粒的数量减少有关。
由表3可知,和CK相比,抽穗开花期HT1(30℃)处理后,BL006不同粒位结实粒的千粒重未受显著影响;R-农白上部一次枝梗的千粒重显著提高,下部一、二次枝梗的千粒重显著降低;而黄华占上部一次枝梗的千粒重未受显著影响,其它 3个部位的千粒重均显著提高。抽穗开花期温度提高到33℃时,BL006和黄华占不同部位的千粒重较CK显著降低,且均为下部二次枝梗的降幅最小;R-农白下部一次枝梗的千粒重未受显著影响,其它部位的千粒重较CK显著升高。
可见,各水稻品种在抽穗开花期遭遇高温后,结实粒的千粒重呈现升高和降低两种变化,不同部位结实粒千粒重与穗千粒重的变化趋势基本一致。HT1(30℃)处理后,上部一次枝梗结实粒的千粒重受高温危害较小;HT2(33℃)处理后,下部二次枝梗结实粒的千粒重受危害较小。
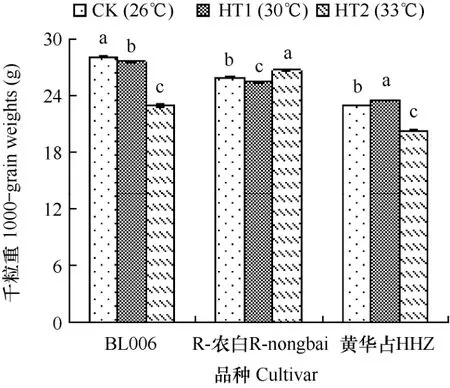
图3 3个水稻品种在抽穗开花期不同温度处理下千粒重的比较Fig. 3 Comparison of 1000-grain weights of three rice cultivars among treatments

表3 同一品种不同处理条件下各部位千粒重(g)的比较(平均值±标准误)Table 3 Comparison of 1000-grain weights(g)on different grain positions among treatments (mean ± standard error)
2.3 抽穗开花期高温处理后水稻光合速率和蒸腾速率的表现

图4 3个水稻品种在抽穗开花期高温处理后剑叶净光合速率和蒸腾速率的比较Fig. 4 Comparison of net photosynthetic rate(Pn) and transpiration rate(Tr) of three rice cultivars among treatments
由图4可见,抽穗开花期HT1(30℃)处理后,R-农白和黄华占的剑叶净光合速率较CK显著升高,增幅分别为 9.84%和14.38%;当抽穗开花期的温度升至33℃时,BL006和R-农白的剑叶净光合速率显著降低,分别较CK降低了35.38%和13.94%。抽穗开花期HT1(30℃)处理后,BL006和黄华占剑叶的蒸腾速率较CK显著降低39.31%和28.17%,R-农白剑叶的蒸腾速率较CK显著升高11.22%;当抽穗开花期的温度升至33℃时,BL006和R-农白剑叶的蒸腾速率较CK显著降低46.80%和39.85%,黄华占剑叶的蒸腾速率较CK显著提高59.61%。可见,高温胁迫后,不同品种自身生理特征的适应性存在差异,中穗型品种黄华占表现出较强的耐高温特性。
3 结论与讨论
3.1 讨论
水稻高产栽培的重要措施是通过培育大穗型水稻品种提高单位面积的颖花量实现高产,但是大穗型水稻品种的颖花受精易受环境影响。抽穗开花期是水稻对高温最敏感的时期之一,花期高温导致花粉败育,颖花受精率降低[12]。一般而言,随着温度的增加,颖花败育率提高,但是颖花受精率对高温的响应存在品种间差异[21-22]。本试验结果显示,高温处理后,各品种的颖花受精率显著降低;大穗型品种 BL006和 R-农白的降幅高于中穗型品种黄华占,且随着温度的升高,降幅增大。HT1(30℃)处理后,BL006剑叶的净光合速率未受显著影响,黄华占剑叶的净光合速率显著升高,二者的蒸腾速率均显著降低;R-农白剑叶的净光合速率和蒸腾速率均显著升高,HT2(33℃)处理后,BL006和 R-农白剑叶的净光合速率和蒸腾速率显著降低,中穗型品种黄华占的蒸腾速率则显著升高。较低的光合速率可能导致光合产物积累减少,花粉粒中同化物供应不足,花粉活力降低,颖花败育,受精率显著降低[13,23];蒸腾速率升高,可能导致叶温和穗温降低,在一定程度上缓解高温对颖花受精率的危害。这些结果说明,HT1(30℃)处理后,3个水稻品种颖花受精率的降低可能是蒸腾速率起主要作用,HT2(33℃)处理后,大穗型水稻品种BL006和R-农白颖花受精率的急剧降低是净光合速率和蒸腾速率降低共同作用的结果,而中穗型品种黄华占则因蒸腾速率的升高而维持了稳定的光合速率和较高的颖花受精率,这与前人的研究结果一致[24]。稻穗上不同部位的颖花异步发育,整穗完成开花需要 5~7d,上部一次枝梗上着生的强势颖花开花较早,而下部二次枝梗上的弱势颖花开花较晚[25]。一般认为,花期高温对弱势颖花的危害大于强势颖花[19]。本研究结果显示,HT1(30℃)处理后的3个品种以及HT2(33℃)处理后的 BL006均表现为下部二次枝梗颖花受精率的降幅最大。其原因是:穗粒数增加使水稻开花时间延长,下部二次枝梗颖花开花与上部一次枝梗籽粒灌浆同步进行,而上部一次枝梗的籽粒对同化物的竞争能力较强,导致下部二次枝梗的颖花因营养物质供应不足而败育[13,26-27]。但是,本研究还发现,HT2(33℃)处理后,R-农白和黄华占上部一次枝梗颖花受精率的降幅最大。Mohammed等[20]的研究结果显示,32℃的夜温导致不同部位颖花败育率显著提高,上部颖花提高的幅度大于下部。Fu等[24]研究发现,抽穗开花期40℃的高温处理下,强势颖花的温度高于弱势颖花,颖花受精率的降幅高于弱势颖花。上述结果说明,抽穗开花期较低的高温对下部二次枝梗上着生的颖花,即弱势花的危害较大,较高的高温则对有些品种上部一次枝梗上着生的颖花,即强势花的危害较大。
前人以常规穗型水稻为试验材料,一般认为,高温加速籽粒灌浆,缩短灌浆时间,导致稻米粒重降低[20,28],但是 Cao等[19]研究发现,抽穗开花期高温(38/28℃)处理后,水稻品种“钱江3号”的千粒重显著升高。本试验结果显示,高温处理后,各品种的千粒重总体降低,但是 R-农白(33℃)和黄华占(30℃)的千粒重反而较对照升高。其原因可能是,高温处理后,颖花受精率显著降低,实粒数减少、源库比增加、千粒重显著升高。Shimoda等[29-30]发现,高温促进抽穗开花前积累的干物质向籽粒转运,维持了稻米粒重的恒定。
一般而言,同一穗上部强势颖花开花较早、对同化物的竞争能力较强、籽粒千粒重较大,下部弱势颖花表现相反[25]。高温使同化物积累减少,粒位间竞争加剧,下部弱势颖花的千粒重显著降低[20]。但是,Cao等[19]研究发现,抽穗开花期高温(38/28℃)处理后,水稻品种“钱江 3号”下部籽粒的千粒重显著升高。本研究结果显示,抽穗开花期高温处理后,不同粒位结实粒的千粒重总体降低;但是,抽穗开花期 HT2(33℃)处理后,BL006下部二次枝梗千粒重的降幅最小;R-农白在 HT2(33℃)和黄华占在 HT1(30℃)处理后,不同粒位的千粒重升高。分析可能的原因是,一方面,抽穗开花期高温处理后,不同部位颖花受精率的降幅不同,受精籽粒对同化物的竞争能力及籽粒灌浆顺序存在粒位间差异;另一方面,高温胁迫解除后,叶片的光合能力逐渐恢复[31],但是,不同品种的恢复能力及本身的光合能力存在差异,从而导致不同品种和同一品种不同部位千粒重对高温响应不同。
3.2 结论
抽穗开花期高温处理后,各水稻品种的颖花受精率显著降低;大穗型水稻品种的耐高温性低于中穗型品种,且温度越高,耐高温性越差。较低的高温对弱势颖花受精的危害较大,较高的高温可能对强势颖花受精的危害较大。不同品种和同一品种不同部位籽粒的千粒重对高温呈现正、反两种响应,千粒重的提高可以弥补高温对大穗型水稻的危害。较低温度处理后水稻品种颖花受精率的降低可能主要取决于蒸腾作用,较高温度处理后则取决于蒸腾和光合的共同作用。大穗型水稻育种必须认真考虑这些特点,培育整体耐高温,并充分关注不同粒位颖花在高温条件下受精率和千粒重的稳定性。
References
[1]Virk P S,Khush G S,Peng S.Breeding to enhance yield potential of rice at IRRI:the ideotype approach[J]. International Rice Research Notes,2004.
[2]钱永兰,毛留喜,周广胜.全球主要粮食作物产量变化及其气象灾害风险评估[J].农业工程学报,2016,32(1):226-235.Qian Y L,Mao L X,Zhou G S.Changes in global main crop yields and its meteorological risk assessment[J]. Transactions of the CSAE,2016,32(1): 226-235.(in Chinese)
[3]Kato T,Dai S,Taniguchi A.Activities of enzymes for sucrosestarch conversion in developing endosperm of rice and their association with grain filling in extra-heavy panicle types[J].Plant Production Science,2007,10(4):442-450.
[4]袁隆平.选育超高产杂交水稻的进一步设想[J].杂交水稻,2012,27(6):1-2.Yuan L P.Conceiving of breeding further super-high- yield hybrid rice[J].Hybrid Rice,2012,27(6):1-2.(in Chinese)
[5]Yamamoto Y,Yoshida T,Enomoto T,et al.Characteristics for the efficiency of spikelet production and the ripening in highyielding japonica-indica hybrid and semidwarf indica rice varieties[J].Japanese Journal of Crop Science,2008, 60(3):365-372.
[6]Yang J C,Peng S B,Zhang Z J,et al.Grain and dry matter yields and partitioning of assimilates in japonica/indica hybrid rice[J].Crop Science,2002, 42(3):766-772.
[7]Yang J C,Zhang J H.Grain-filling problem in 'super' rice[J].Journal of Experimental Botany,2010,61(1):1-5.
[8]Stocker T,Qin D,Plattner G,et al.IPCC,2013:Summary for policymakers in climate change 2013:the physical science basis,contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change[M].Cambridge,United Kingdom and New York, NY, USA:Cambridge University Press,2013.
[9]Rosenzweig C,Lglesias A,Yang X B,et al.Climate change and extreme weather events:implications for food production,plant diseases,and pests[J].Global Change and Human Health,2001,2(2):90-104.
[10]陶龙兴,谈惠娟,王熹,等.超级杂交稻国稻 6号对开花结实期高温热害的反应[J].中国水稻科学,2007,21(5):518-524.Tao L X,Tan H J,Wang X,et al.Effects of high temperature stress on super hybrid rice guodao6 during flowering and filling phases[J].Chinese Journal of Rice Science,2007,21(5):518-524.(in Chinese)
[11]Wassmann R,Jagadish S V K,Heuer S,et al.Climate change affecting rice production:the physiological and agronomic basis for possible adaptation strategies[J].Advances in Agronomy,2009,101(8): 59-122.
[12]Satake T,Yoshida S.High temperature-induced sterility in indica rices at flowering[J].Japanese Journal of Crop Science,1978,47(1):6-17.
[13]Kobata T,Yoshida H,Masiko U,et al.Spikelet sterility is associated with a lack of assimilate in high-spikelet-number rice[J].Agronomy Journal, 2013,105(6):1821-1831.
[14]Paupière M J,van Heusden A W,Bovy A G.The metabolic basis of pollen thermo-tolerance: perspectives for breeding[J].Metabolites,2014,4(4):889-920.
[15]周建霞,张玉屏,朱德峰,等.高温后移对水稻颖花败育的影响[J].中国农业气象,2014,35(5):544-548.Zhou J X,Zhang Y P,Zhu D F,et al.Effects of high temperature on rice spikelet sterility at flowering stage[J]. Chinese Journal of Agrometeorology,2014, 35(5):544-548. (in Chinese)
[16]黄福灯,曹珍珍,李春寿,等.花期高温对水稻花器官性状和结实的影响[J].核农学报,2016,30(3):565-570.Huang F D,Cao Z Z,Li C S,et al.Study on effects of hightemperature stress on rice in floral organ character and seedsetting rate[J].Journal of Nuclear Agricultural Sciences, 2016,30(3):565-570. (in Chinese)
[17]李敏,马均,王贺正,等.水稻开花期高温胁迫条件下生理生化特性的变化及其与品种耐热性的关系[J].杂交水稻,2007,22(6):62-66.Li M,Ma J,Wang H Z,et al.Relationship between some physiological and biochemical characteristics and heat tolerance at flowering stage in rice[J]. Hybrid Rice,2007,22(6):62-66.(in Chinese)
[18]谢晓金,李秉柏,李映雪,等.抽穗期高温胁迫对水稻产量构成要素和品质的影响[J].中国农业气象,2010,31(3):411- 415.Xie X J,Li B B,Li Y X,et al.Effects of high temperature stress on yield components and grain quality during heading stage[J].Chinese Journal of Agrometeorology,2010,31(3):411-415.(in Chinese)
[19]Cao Z Z,Zhao Q,Huang F D,et al.Effects of high temperature at anthesis on spikelet fertility and grain weight in relation to floral positions within a panicle of rice (Oryza sativa L.)[J].Crop & Pasture Science,2015,66(9):922-929.
[20]Mohammed A R,Tarpley L.Effects of high night temperature and spikelet position on yield-related parameters of rice (Oryza sativa L.)plants[J]. European Journal of Agronomy,2010, 33(2):117-123.
[21]Prasad P V V,Boote K J,Jr L H A,et al.Species, ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress[J].Field Crops Research,2006, 95(2):398-411.
[22]Jagadish S V K,Craufurd P Q,Wheeler T R.High temperature stress and spikelet fertility in rice (Oryza sativa L.)[J].Journal of Experimental Botany, 2007,58(7):1627-1635.
[23]Yoshinaga S,Takai T,Araisanoh Y,et al.Varietal differences in sink production and grain-filling ability in recently developed high-yielding rice (Oryza sativa L.)varieties in Japan[J].Field Crops Research,2013,150(15):74-82.
[24]Fu G,Feng B,Zhang C,et al.Heat stress is more damaging to superior spikelets than inferiors of rice(Oryza sativa L.)due to their different organ temperatures[J].Frontiers in Plant Science,2016, 7(16):1637.
[25]Yang J C,Cao Y Y,Zhang H,et al.Involvement of polyamines in the post-anthesis development of inferior and superior spikelets in rice[J].Planta,2008, 228(1):137-149.
[26]Luquet D,Dingkuhn M,Kim H,et al.EcoMeristem,a model of morphogenesis and competition among sinks in rice:1.Concept,validation and sensitivity analysis[J].Functional Plant Biolog,2006,33(4): 309-323.
[27]Kobata T,Hamahara Y,Matsuyama S.Liquid culturing of detached panicles of rice:cooled culture solutions extend the period of growth[J]. Plant Production Science,2001,4(4):280-282.
[28]Lin C J,Li C Y,Lin S K,et al.Influence of high temperature during grain filling on the accumulation of storage proteins and grain quality in rice(Oryza sativa L.)[J].Journal of Agricultural & Food Chemistry,2010,58 (19):10545-10552.
[29]Shimoda S.Effects of high temperature and early drainage on leaf CO2assimilation and grain yield in the rice cultivar Hinohikari[J].Journal of Agricultural Meteorology,2011,67(4): 259-267.
[30]Huang M,Zhang R C,Jiang P,et al.Temperature- related yield constraints of early-rice in South China:a cross-location analysis[J].PLoS ONE,2016, 11(7):e0158601.
[31]杨再强,李伶俐,殷剑敏,等.灌浆初期不同时长高温胁迫对早稻叶片光合和荧光参数的影响[J].中国农业气象,2014,35(1):80-84.Yang Z Q,Li M L,Yin J M,et al.Effects of different duration of high temperature stress during filling stages on leaf photosynthetic and fluorescence parameters of early rice[J].Chinese Journal of Agrometeorology,2014,35(1):80- 84.(in Chinese)
