喷施不同化学制剂对水稻叶片抗高温胁迫的效果分析*1
2018-03-19江晓东姜琳琳华梦飞陈惠玲杨晓亚
江晓东,姜琳琳,华梦飞,陈惠玲,吕 润,胡 凝,杨晓亚
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心/江苏省农业气象重点实验室,南京 210044;2.中国气象局农业气象保障与应用技术重点开放实验室,郑州 450003)
长江中下游地区,由于受中高纬度大气环流和西太平洋副热带高压等天气系统的控制,双季早稻易受高温热害的影响[1],造成水稻严重减产[2]。特别是在未来全球气候变暖背景下,中国多数大陆地区极端高温、热浪等事件的发生频率很可能继续增加[3],成为制约水稻产量和品质提高的重要因子。
化学制剂能够通过调节细胞活性和激素水平等方式影响植物生长和发育进程[4],是农业生产中抗逆保收的重要措施,也是提高作物抗高温的重要措施。目前,生产上常用的抗高温化学制剂主要有次硅酸钠(Na2SiO3·9H2O)、水杨酸(SA)、氯化钙(CaCl2·5H2O)和磷酸二氢钾(KH2PO4)等。研究表明,高温条件下叶面喷施1.5mmol·L-1SA溶液能显著降低植株叶片细胞膜质过氧化伤害[5],喷施0.5mmol·L-1SA能够提高水稻幼苗可溶性糖和可溶性蛋白质含量[6];喷施 10 和 20mmol·L-1CaCl2·5H2O 溶液都能够提高高温胁迫下叶片抗氧化酶活性,降低MDA 含量[7-8];喷施 1.5mmol·L-1Na2SiO3·9H2O 能显著提高高温下水稻花药的开裂率和柱头授粉量[9],喷施 2.5mmol·L-1Na2SiO3·9H2O 能显著提高水稻的结实率[10];喷施浓度为 0.3%和 0.5%的 KH2PO4溶液皆对植株的生长有促进作用[11-12]。然而,目前研究大多基于单一化学制剂,对不同种类化学制剂之间的对比研究较少,因此,如何在众多化学制剂中进行有效筛选有待进一步探讨。本研究选取 SA、Na2SiO3·9H2O、CaCl2·5H2O 和 KH2PO44 种常用化学制剂,在前人研究的基础上各筛选出两种常用浓度,以水稻为对象,比较不同化学制剂对高温胁迫的缓解作用,以期为水稻生产应对高温热害提供参考依据。
1 材料与方法
1.1 试验设计
试验于2016年在南京信息工程大学农业气象试验站进行,以杂交早籼稻陵两优 268为供试品种进行盆栽实验。水稻于2016年4月20日播种,3叶1心期选择均匀一致的壮苗移栽于内径20cm、高30cm的塑料盆中,每盆 3株,等边三角形种植,植株离盆沿5cm。在水稻拔节期(6月20日)连续3d每日17:00对处理植株分别喷施4种不同的化学制剂,每种试剂采用两种不同的浓度,以喷施蒸馏水为对照(CK),试验共计9种处理,每处理种植12盆,共计108盆(表1)。6月23日9:00将所有盆栽植物放入人工气候箱(TPG1260,Australian)进行连续 5d的高温处理,处理方法为,6:00-18:00,40±0.5℃;18:00-次日 6:00,30±0.5℃,日平均气温为35℃,6月28日9:00将所有处理水稻材料移至室外自然生长。
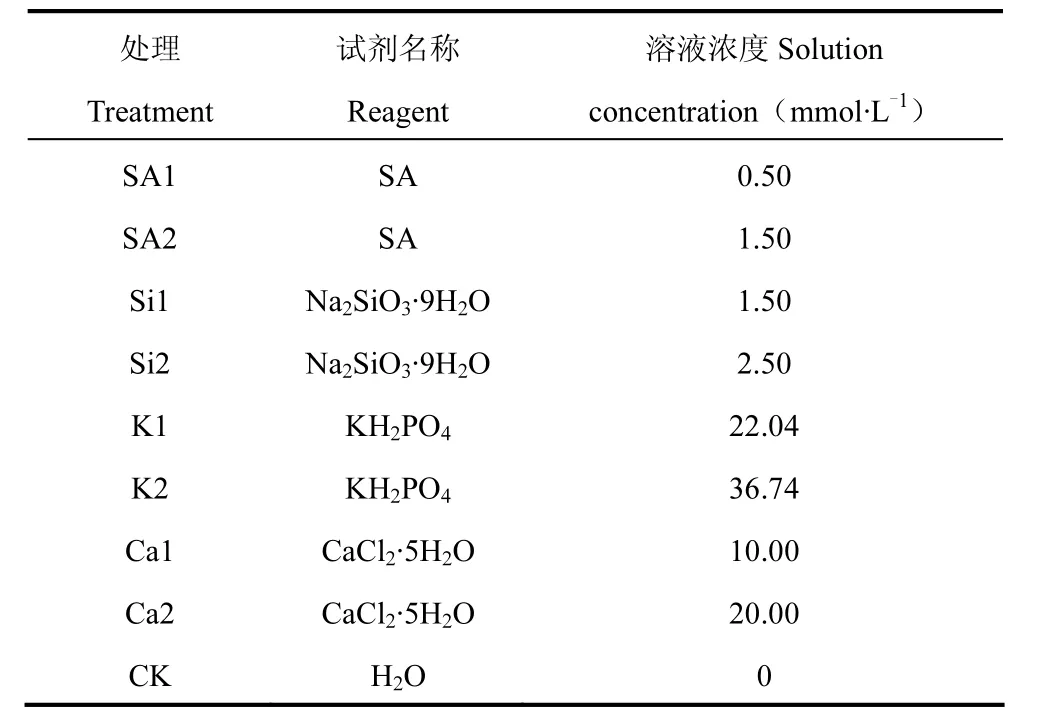
表1 试验处理设置Table 1 Experimental treatment settings
1.2 测定项目与方法
在高温处理 72h(6月26日 9:00)、120h(6月28日9:00)和高温处理结束后自然条件下室外恢复120h(7月3日9:00),各取一次活体叶片,取分蘖最上两片展开叶,每个处理取样 3盆,每盆取样12片叶片,取样后立即放入液氮中冷冻保存,用于测定各项生理指标。
采用 95%乙醇提取测定叶绿素含量[13];采用氮蓝四唑法[14]测定超氧化物歧化酶(SOD),以抑制NBT光化还原50%为一个酶活力单位(U);采用愈创木酚法[15]测定POD活性,以OD470nm每分钟增加1为1个酶活力单位(U);采用紫外吸收法[16]测定CAT活性,以OD-240nm每分钟减少0.1为1个酶活力单位(U);采用硫代巴比妥酸比色法[13]测定丙二醛(MDA)含量;采用考马斯亮蓝法[13]测定可溶性蛋白含量。
1.3 数据处理
数据采用SPSS进行统计分析。
2 结果与分析
2.1 喷施不同制剂后遭遇高温胁迫时叶片叶绿素含量的比较
叶绿素是衡量作物光合能力的重要指标。由表2可见,CK处理的水稻植株叶片,在经过高温处理72h、120h以及恢复120h后,所观测的叶片叶绿素含量表现出明显的下降,由 3.00降至 2.60和2.45mg·g-1,表明高温胁迫导致叶片叶绿素含量明显降低,且高温结束恢复120h后叶绿素含量仍持续降低。喷施化学制剂的各处理中,植株经过高温处理72h、120h以及恢复120h后,叶片叶绿素含量也均表现出明显的下降,但是总体上各处理叶绿素含量均高于CK。对比喷施不同制剂的各处理可见,高温处理72h后,K1和Si1处理其水稻叶片叶绿素含量分别达到4.59和4.62mg·g-1,显著高于其它处理;高温处理120h后,K1、SA1和K2处理叶片叶绿素含量较高,分别为3.62、3.68和3.69mg·g-1;而在高温处理结束后,自然条件下室外恢复120h,Si2处理的叶片叶绿素含量最高,Ca2次之。表明喷施22.04mmol·L-1KH2PO4有利于提高高温胁迫下水稻叶片叶绿素的合成功能,喷施 20mmol·L-1CaCl2·5H2O溶液和 2.5mmol·L-1Na2SiO3·9H2O 溶液对叶片叶绿素的合成机能恢复效果最好。
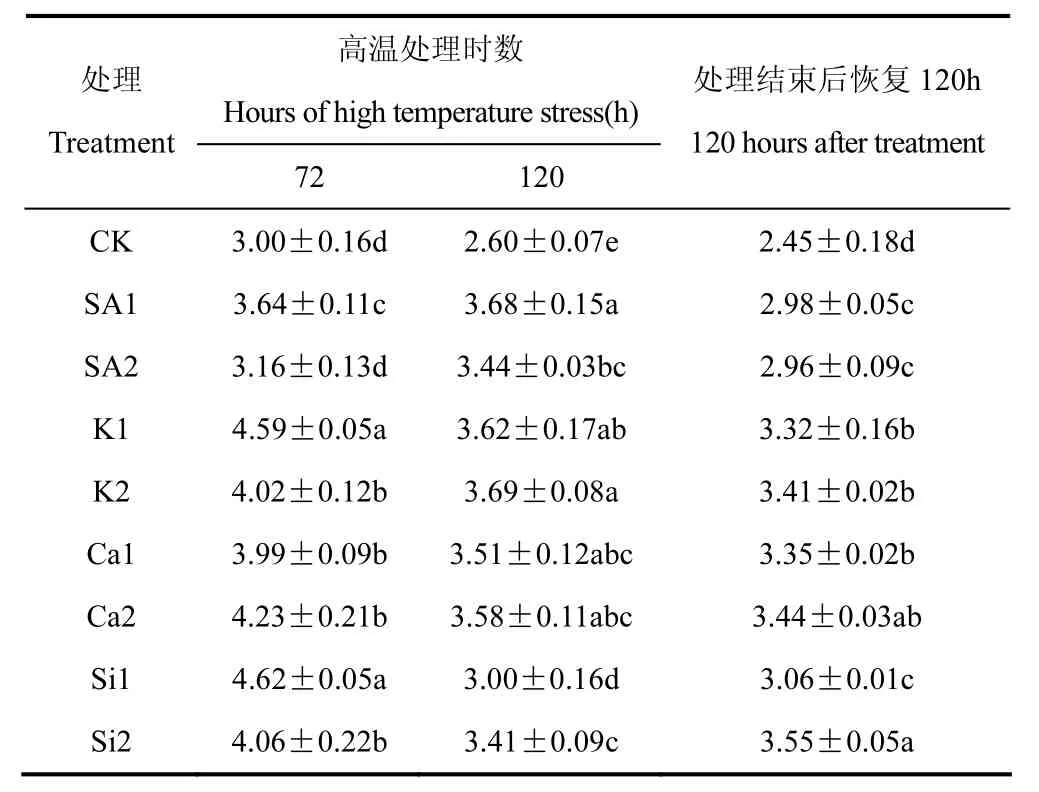
表2 喷施不同化学制剂后高温胁迫期和恢复期叶片叶绿素含量的比较(mg·g-1)Table 2 Comparison of the leaf chlorophyll content during high temperature stress and recovery stage after spraying different chemical agents(mg·g-1)
2.2 喷施不同制剂后遭遇高温胁迫时叶片 SOD活性的比较
SOD作为抗氧化系统中的核心酶类,能够将O2-·歧化成 H2O2和 O2,从而减少逆境对植物的伤害[17]。由表3可见,高温处理过程中以及高温处理结束后,4种化学制剂作用下叶片SOD活性均呈现先增加后下降的趋势。高温处理72h后,K1处理的SOD活性达394.87U·g-1FW,显著高于其它处理;高温处理120h后,叶片SOD活性继续增加,Ca2处理的SOD活性最高,达到 691.06U·g-1FW,Si2处理次之,为666.28U·g-1FW。表明高温胁迫下水稻叶片活性氧产生过多,植株通过自身防御机制增加SOD活性对其进行清除。高温处理结束后,自然条件下室外恢复120h,K1、Ca2和Si2处理叶片SOD活性显著高于其它处理,分别为559.01、548.09和547.85U·g-1FW。因此认为,22.04mmol·L-1KH2PO4(K1)、20mmol·L-1CaCl2·5H2O(Ca2)和 2.5mmol·L-1Na2SiO3·9H2O(Si2)溶液处理更能提高叶片SOD活性。

表3 喷施不同化学制剂后高温胁迫期和恢复期叶片SOD活性的比较(U·g-1FW)Table 3 Comparison of the SOD activity during high temperature stress and recovery stage after spraying different chemical agents(U·g-1FW)
2.3 喷施不同制剂后遭遇高温胁迫时叶片 CAT活性的比较
CAT主要将H2O2分解,清除过剩自由基,使植物体内维持正常的动态水平[18]。由表4可知,随着高温胁迫时间增加,各处理CAT活性呈上升趋势,在温度恢复正常后CAT活性有所降低。高温处理72h,除SA2处理外,其余处理的CAT活性皆显著高于CK;高温处理120h,Ca1和K2处理CAT活性显著高于其它处理,分别比CK高出22.83%和22.75%。各高温处理结束后,自然条件下室外恢复120h,K2和Ca1处理的CAT活性最高,且两者无显著差异。因此认为,36.74mmol·L-1KH2PO4溶液和 10mmol·L-1CaCl2·5H2O溶液能够显著提高水稻叶片CAT活性。
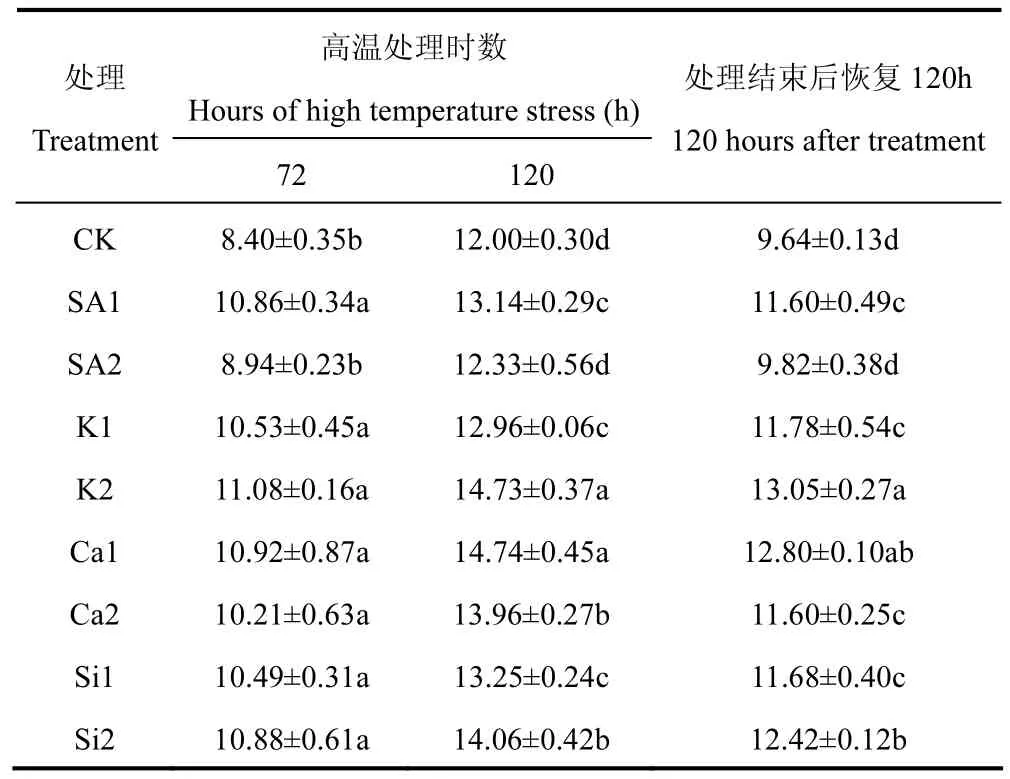
表4 喷施不同化学制剂后高温胁迫期和恢复期叶片CAT活性的比较(U·g-1FW)Table 4 Comparison of the CAT activity during high temperature stress and recovery stage after spraying different chemical agents(U·g-1FW)
2.4 喷施不同制剂后遭遇高温胁迫时叶片 POD活性的比较
POD也是植物体内抗氧化酶系统的重要成分,可催化H2O2转化为活性较低的H2O,从而使植物体免受过氧化伤害。由表5可知,高温处理72h后,K1处理POD活性最高,达到78.43U·g-1FW。高温处理达到120h后,各处理POD活性均较72h显著增加,其中 Ca1处理的 POD活性最高,达到116.95U·g-1FW,其次是Si2处理,为108.38U·g-1FW。高温处理结束后,自然条件下室外恢复 120h,各处理POD活性有所下降,其中Ca1处理的POD活性最高,达到 95.56U·g-1FW,其次是 K1处理,为84.10U·g-1FW。由此可见,在高温处理前期,22.04mmol·L-1KH2PO4更能显著提高 POD 活性;而在高温处理后期和恢复 120h后,10mmol·L-1CaCl2·5H2O溶液更能显著提高POD活性。
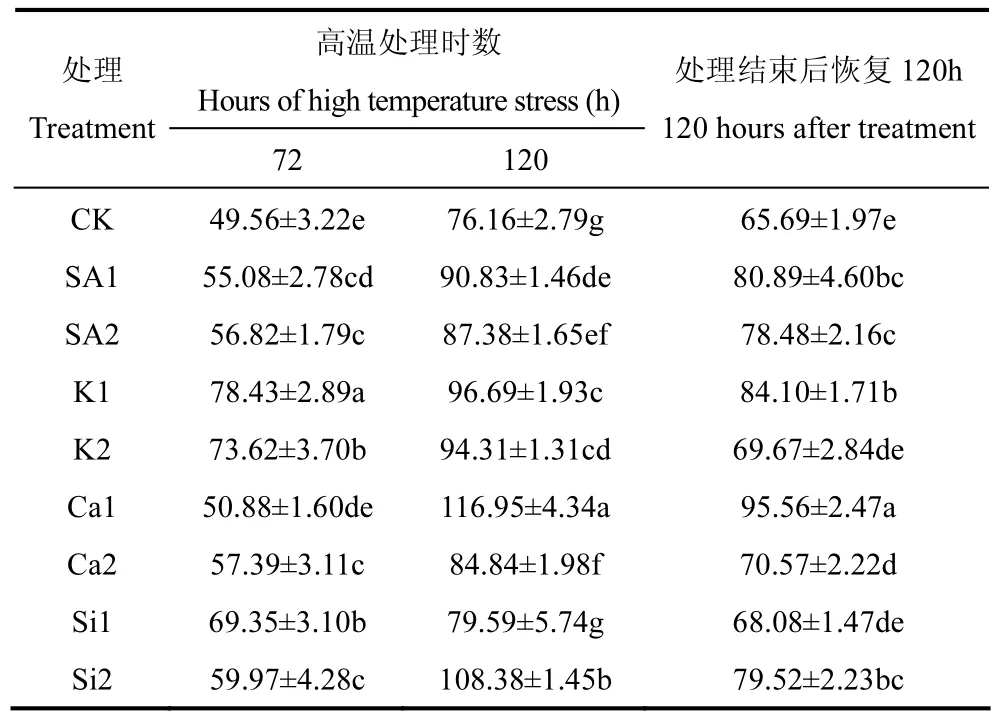
表5 喷施不同化学制剂后高温胁迫期和恢复期叶片POD活性的比较(U·g-1FW)Table 5 Comparison of the POD activity during high temperature stress and recovery stage after spraying different chemical agents(U·g-1FW)
2.5 喷施不同制剂后遭遇高温胁迫时叶片 MDA含量的比较
丙二醛(MDA)是膜脂过氧化的产物,通常用来表征细胞膜受损程度。由表6可知,高温处理72h后,K1和SA2处理叶片MDA含量显著低于其它处理,含量分别为 4.86和 5.00µmol·g-1FW;高温处理120h后,各处理MDA含量较72h有所上升,CK达到最大,表明高温加剧了水稻叶片的膜脂过氧化程度,但此时除SA2和Si2处理外,其它处理间MDA含量无显著差异;高温处理结束后,自然条件下室外恢复120h,各处理MDA含量均显著低于对照,其中Ca1、K1、Ca2和Si1处理的MDA含量最低,分别比对照降低28.86%、28.73%、28.48%和27.47%,表明喷施 4种化学制剂均能显著减轻水稻叶片膜脂过氧化程度。

表6 喷施不同化学制剂后高温胁迫期和恢复期叶片MDA含量的比较(µmol·g-1FW)Table 6 Comparison of the MDA content during high temperature stress and recovery stage after spraying different chemical agents(µmol·g-1FW)
2.6 喷施不同制剂后遭遇高温胁迫时叶片可溶性蛋白含量的比较
细胞可溶性蛋白质是植物代谢的主要调控和促进物质,其含量的变化反映了植物合成和代谢的能力。由表 7可知,随着高温处理时间的增加,可溶性蛋白呈增加趋势,在高温处理结束后,其含量有所下降,表明植株受到高温胁迫时能够产生更多的可溶性蛋白以提高对高温的耐受力。高温处理 72h后,Ca1和Ca2处理的可溶性蛋白含量显著高于其它处理,分别比对照高出29.59%和27.18%;高温处理120h后,Ca2和K1处理可溶性蛋白含量显著高于其它处理,分别达到21.82和20.94mg·g-1FW;高温处理结束后,自然条件下室外恢复 120h,Si2、K1和Ca2处理的可溶性蛋白含量最高,分别为18.59、18.53和17.87mg·g-1FW,且三者间无显著差异。结合高温处理过程及恢复过程,认为20mmolL-1CaCl2·5H2O和22.04mmol·L-1KH2PO4溶液更能提高水稻植株可溶性蛋白质含量。
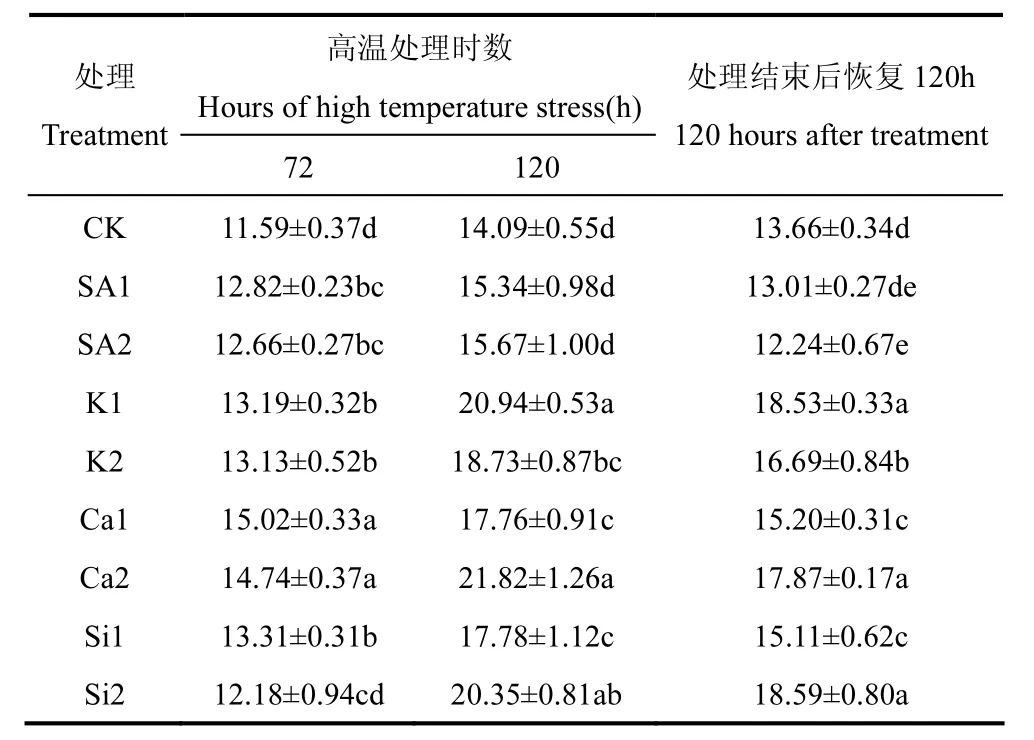
表7 喷施不同化学制剂后高温胁迫期和恢复期叶片可溶性蛋白含量的比较(mg·g-1FW)Table 7 Comparison of the soluble protein content during high temperature stress and recovery stage after spraying different chemical agents(mg·g-1FW)
3 结论与讨论
3.1 讨论
植物受高温胁迫时,体内活性氧产生与清除的平衡机制被打破,导致活性氧大量积累,植物内部生理生化过程发生紊乱,引起了抗氧化酶活性、膜脂过氧化产物含量、可溶性蛋白含量及叶绿素含量的变化[5-7]。本研究中,高温导致CK叶片叶绿素含量下降,SOD、POD、CAT活性、可溶性蛋白质和MDA含量增加,叶片的衰老程度增加;喷施4种制剂皆能提高高温下水稻叶片叶绿素含量、SOD、POD、CAT活性以及可溶性蛋白质,降低MDA含量,可有效缓解高温对水稻叶片的伤害,但各种化学制剂的作用效果有所不同。
喷施CaCl2·5H2O溶液能显著提高水稻叶片叶绿素和可溶性蛋白含量,降低 MDA含量,同时提高POD、SOD和CAT活性,主要表现在高温处理120h及高温处理结束后的恢复期。Ca2+提高植物抗热性的主要原因是,钙离子作为偶联胞外信号与胞内生理反应的第二信使,能够调节植物细胞对逆境胁迫的信号转导过程[19]。逆境胁迫下,外源 Ca2+对细胞膜表面电荷具有屏蔽作用[20],同时,Ca2+能结合固定膜上的组分从而减少了质膜的流动性[21]。另外,本研究发现,添加 Ca2+化学制剂对水稻的抗热作用主要出现在高温处理120h和高温处理结束后恢复120h,这可能与外源 Ca2+进入细胞质传递高温信号且植物作出生理生化反应需要一定时间有关。
喷施KH2PO4溶液后,水稻幼苗叶片在高温处理72h、120h和高温处理结束后恢复120h始终保持较低的MDA含量和较高的SOD、CAT、POD活性和可溶性蛋白含量。这是因为K+具有髙速度透过生物膜的特性[22],且能够通过诱导酶构象的改变从而实现对生理代谢酶的活化,同时还能调节蛋白质的合成[23]。本研究结果说明,喷施22.04mmol·L-1KH2PO4溶液对水稻叶片抗高温的作用效果最显著。
喷施Na2SiO3·9H2O溶液虽然能够提高高温下水稻叶片叶绿素含量、SOD、CAT、POD活性和可溶性蛋白含量,降低 MDA含量,但效果不如CaCl2·5H2O和KH2PO4明显,这可能与硅有关的物质形成有关。硅作为水稻细胞结构成分和组成物质,能够维持细胞膜结构和功能的稳定性,增强水稻抗热能力[24]。另外,植物叶外表皮细胞质外体空间内沉积的纳米尺寸的硅具有较强红外热辐射能力,能够降低叶表温度[25]。外源喷施Na2SiO3·9H2O溶液,Si元素进入细胞合成为细胞的组分并发挥作用需要一定的代谢过程,故其抗高温的效果不如 KH2PO4和CaCl2·5H2O溶液。
SA是一种酚类内源生长调节剂,是能够激活植物过敏反应和系统获得性抗性的内源信号分子[26],外源SA不仅能促进蛋白磷酸化的反应[27],同时可以诱导蛋白质的可逆磷酸化[28]。研究表明,外源SA溶液能提高CAT活性[7],通过增强清除H2O2的能力减少活性氧对细胞的损伤。本研究中外源SA溶液虽然能够提高高温下SOD、POD、CAT活性,提高叶绿素含量,降低MDA含量,但综合效果在4种化学制剂中最低,这可能与水稻体内缺乏对SA起应答反应的机制有关[29]。
3.2 结论
本研究表明,SA、Na2SiO3·9H2O、CaCl2·5H2O和 KH2PO4四种化学制剂均能提高水稻的抗氧化酶活性、叶绿素含量和可溶性蛋白含量,降低膜质过氧化程度,以KH2PO4和CaCl2·5H2O的抗高温效果更好。KH2PO4制剂的作用时期在高温处理的 72h、120h和高温结束自然状态下恢复 120h后,而CaCl2·5H2O作用时期在高温处理的120h和高温结束后恢复 120h,以浓度为 20mmol·L-1CaCl2·5H2O 和22.04mmol·L-1KH2PO4效果最好,生产上可以考虑将两种浓度的化学制剂混合使用。
References
[1]王春乙,姚蓬娟,张继权,等.长江中下游地区双季早稻冷害、热害综合风险评价[J].中国农业科学,2016, 49(13):2469-2483.Wang C Y,Yao P J,Zhang J Q,et al.Risk assessment of cold and hot damages for double-cropping early rice in lower-middle reaches of the Yangtze River Basin[J].Scientia Agricultura Sinica,2016,49(13):2469-2483.(in Chinese)
[2]骆宗强,石春林,江敏,等.孕穗期高温对水稻物质分配及产量结构的影响[J].中国农业气象,2016,37(3):326-334.Luo Z Q,Shi C L,Jiang M,et al.Effect of high temperature on rice dry matter partition and yield component during booting stage[J].Chinese Journal of Agrometeorology, 2016, 37(3):326-334.(in Chinese)
[3]史军,丁一汇,崔林丽.华东地区夏季高温期的气候特征及其变化规律[J].地理学报,2008,63(3):237-246.SHI J,Ding Y H,Cui L L.Climatic characteristics and their changing law during summer high-temperature times in east China[J].Acta Geographica Sinica,2008,63(3):237-246.(in Chinese)
[4]刘永红,杨勤,何文铸,等.花期干旱和灌溉条件下植物生长调节剂对玉米茎流和光合生理的影响[J].西南农业学报,2009,22(5):1305-1309.Liu Y H,Yang Q,He W Z,et al.Effect of plant growth regulators on maize stem sap and photosynthesis under drought stress and irrigation at flowering stage[J].Southwest China Journal of Agricultural Sciences,2009, 22(5):1305-1309.(in Chinese)
[5]杨岚,师帅,王红娟,等.水杨酸对高温胁迫下铁皮石斛幼苗耐热性的影响[J].西北植物学报,2013,33(3):534-540.Yang L,Shi S,Wang H J,et al.Effects of salicylic acid on heat-resistance of dendrobium of ficimale seedling under high temperature stress[J].Acta Bot.Boreal.-Occident.Sin, 2013, 33(3):534-540.(in Chinese)
[6]吕俊,张蕊,宗学凤,等.水杨酸对高温胁迫下水稻幼苗抗热性的影响[J].中国生态农业学报,2009,17(6):1168-1171.Lv J,Zhang R,Zong X F,et al.Effect of salicylic acid on heat resistance of rice seedling under heat stress[J].Chinese Journal of Eco-Agriculture,2009,17(6):1168-1171.(in Chinese)
[7]李天来,李淼,孙周平.钙和水杨酸对亚高温胁迫下番茄叶片保护酶活性的调控作用[J].应用生态学报,2009, 20(3):586-590.Li T L,Li M,Sun Z P.Regulation effect of calcium and salicylic acid on defense enzyme activities in tomato leaves under sub-high temperature stress[J].Chinese Journal of Applied Ecology,2009,20(3):586-590.(in Chinese)
[8]张建霞,李新国,孙中海.外源钙对柑橘抗热性的相关生理生化指标的影响[J].华中农业大学学报,2005,24(4):397-400.Zhang J X,Li X G,Sun Z H.Effects of exogenous calcium on the correlative physiological and biochemical index on heat-resistance of citrus[J].Journal of Huazhong Agricultural University,2005,24(4):397-400.(in Chinese)
[9]李文彬,王贺,张福锁.高温胁迫条件下硅对水稻花药开裂及授粉量的影响[J].作物学报,2005,31(1):134-136.Li W B,Wang H,Zhang F S.Effects of silicon on anther dehiscence and pollen shedding in rice under high temperature stress[J].Acta Agronomica Sinica,2005,31(1):134-136.(in Chinese)
[10]吴晨阳,陈丹,罗海伟,等.外源硅对花期高温胁迫下杂交水稻授粉结实特性的影响[J].应用生态学报,2013,24(11):3113-3122.Wu C Y,Chen D,Luo H W,et al.Effects of exogenous silicon on the pollination and fertility characteristics of hybrid rice under heat stress during anthesis[J].Chinese Journal of Applied Ecology,2013,24(11):3113-3122.(in Chinese)
[11]齐红岩,李天来,陈元宏,等.叶面喷施磷酸二氢钾与葡萄糖对番茄光合速率和蔗糖代谢的影响[J].农业工程学报,2005, 21(s2):137-142.Qi H Y,Li T L,Chen Y H,et al.Effects of foliage applications of KH2PO4and glucose on photosynthesis and sucrose metabolism of tomato[J].Transactions of the CSAE,2005,21(Supp2):137-142.(in Chinese)
[12]谭瑞坤,王承南,李凡松,等.施用不同浓度的磷酸二氢钾对香椿生长及养分的影响[J].经济林研究,2017,(2):161-165.Tan R K,Wang C N,Li F S,et al.Effects of different concentrations of potassium dihydrogen phosphate on growth and nutrients in Toona sinensi[J].Nonwood Forest Research, 2017,(2):161-165.(in Chinese)
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-261.Li H S.Principles and techniques of plant physiology and biochemistry[M].Beijing:Higher Education Press,2000:134-261.(in Chinese)
[14]王学奎.植物生理生化实验原理和技术(第 2版)[M].北京:高等教育出版社,2006:172-173.Wang X K.Principles and techniques of plant physiology and biochemistry[M].Beijing:Higher Education Press,2006: 172-173.(in Chinese)
[15]张宪政.作物生理研究法[M].北京:农业出版社,1992:197-198,201-212.Zhang X Z.Physiological research of crops[M].Beijing:China Agricultural Press,1992:197-198,201-212.(in Chinese)
[16]Scebba F,Sebastiani L,Vitagliano C.Protective enzymes against activated oxygen species in wheat(Triticum aestivum L.) seedlings:responses to cold acclimation[J].Journal of Plant Physiology,1999,155(155):762-768.
[17]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学报,2001,18(4):459-465.Wang J,Li D Q.The accumulation of plant osmoticum and activated oxygen metabolism under stress[J].Chinese Bulletin of Botany,2001,18(4):459-465.(in Chinese)
[18]Gechev T,Willekens H,Van M M,et al.Different responses of tobacco antioxidant enzymes to light and chilling stress[J].Journal of Plant Physiology,2003,160(5):509-515.
[19]孙大业,马力耕.细胞外钙调素:一种植物中的多肽信使[J].中国科学,2001,(4):289-297.Sun D Y,Ma L G.Extracellular calmodulin:a plant more skin in the messenger[J].Science China,2001,(4):289-297.(in Chinese)
[20]Weis E.The influence of metal cations and pH on the heat sensitivity of photosynthetic oxygen evolution and chlorophyll fluorescence in spinach chloroplasts[J]. Planta,1982,154(1):41-7.
[21]Cooke A,Cookson A,Earnshaw M J.The mechanism of action of calcium in the inhibition of high temperatureinduced leakage of betacyanin from beet root discs[J].New Phytologist,2010,102(4):491-497.
[22]李廷强,王昌全.植物钾素营养研究进展[J].四川农业大学学报,2001,19(3):281-285.Li T Q,Wang C Q.Studying proceeding of plant potassium nutrient[J].Journal of Sichuan Agricultural University,2001,19(3):281-285.(in Chinese)
[23]李宗泰,陈二影,张美玲,等.施钾方式对棉花叶片抗氧化酶活性、产量及钾肥利用效率的影响[J].作物学报,2012,38(3):487-494.Li Z T,Chen E Y,Zhang M L,et al.Effect of potassium application methods on antioxidant enzyme activities, yield,and potassium use efficiency of cotton[J].Acta Agronomica Sinica,2012,38(3):487-494.(in Chinese)
[24]Agarie S,Hanaoka N,Ueno O,et al.Effects of silicon on tolerance to water deficit and heat stress in rice plants (Oryza sativa L.),monitored by electrolyte leakage[J].Plant Production Science,2015,1(2):96-103.
[25]王荔军,李敏,李铁津,等.植物体内的纳米结构 SiO2[J].科学通报,2001,46(8):625-632.Wang L J,Li M,Li T J,et al.The nano structure of SiO2in plant[J].Chinese Science Bulletin,2001,46(8):625-632.(in Chinese)
[26]Malamy J,Carr J P,Klessig D F,et al.Salicylic acid:a likely endogenous signal in the resistance response of tobacco to viral infection[J].Science,1990,250(4983):1002-1004.
[27]孙军利,赵宝龙,郁松林.外源水杨酸(SA)对高温胁迫下葡萄幼苗耐热性诱导研究[J].水土保持学报,2014,28(3):290-294.(in Chinese)Sun J L,Zhao B L,Yu S L.Study of exogenous salicylic acid on the heat tolerance in grape seedlings under high temperature stress[J].Journal of Soil and Water Conservation,2014,28(3):290-294.(in Chinese)
[28]马培芳,李利红,杨亚军,等.水杨酸对高温强光胁迫下小麦叶绿体 D1蛋白磷酸化及光系统Ⅱ功能的影响[J].应用生态学报,2008,19(12):2632-2636.Ma P F,Li L H,Yang Y J,et al.Effects of salicylic acid on D1 protein phosphorylation and PSⅡ performance in wheat leaf chloroplasts under high temperature and high light stress[J].Chinese Journal of Applied Ecology,2008, 19(12):2632-2636.(in Chinese)
[29]王利军,战吉成,黄卫东.水杨酸与植物抗逆性[J].植物生理学报,2002,38(6):619-624.Wang L J,Zhan J C,Huang W D.Salicylic acid and response to stress in plants[J].Plant Physiology Journal,2002,38(6):619-624.(in Chinese)
