高温胁迫后小白菜的补偿生长能力及防御机制*1
2018-03-19孙晨曦赵和丽郑箐舟宋星林
韩 玮,孙晨曦,赵和丽,胡 琪,郑箐舟,宋星林
(1.南京信息工程大学应用气象学院/江苏省农业气象重点实验室,南京 210044;2.山东省环境规划研究院,济南 250100)
小白菜(Brassica chinensis L.)又名不结球白菜、青菜、油菜。原产于中国,在中国栽培十分广泛,南北各地均有分布,其生长快,产量高,消费量居各类蔬菜之首[1]。由于其喜冷凉气候条件,夏季高温障碍导致生长缓慢,且在自然条件下,夏季气温波动较大,研究极端高温天气过后,小白菜的生长恢复情况具有重要意义。
高温对植物生长一般有负面影响,但是在自然选择的作用下,生物存在补偿能力,能够减少或消除胁迫所带来的不利影响,这是对环境变化的一种适应性[2]。补偿生长表现为低补偿、等补偿和超补偿,补偿类型因物种、生长期和胁迫程度而异[3-5],轻度胁迫条件下植物会发生超补偿或等量补偿,但随着胁迫强度的增大,可出现低补偿反应[6-7]。李留勇[8]发现,早期高温处理结束后,水稻干物质增加量表现出超补偿效应,这种补偿效应可能在减轻水稻高温伤害方面起一定的作用。孙宪芝等[9]发现高温胁迫解除后,遭受低强度胁迫的菊花植株可较快恢复生长,高强度胁迫导致幼苗出现不可逆伤害。李婷等[10]发现经过 6d的高温胁迫后,铜绿微囊藻生长速率高于对照,出现超补偿生长。补偿生长的出现可能归因于某些植物应答机制,诸如光合作用活性增强、叶绿素含量提高、抗氧化酶活力增强,生长率增大等[11-13]。
前人对高温后植物补偿生长方面有过不少研究,但是对于小白菜的研究多偏重于高温胁迫对白菜生理生化指标的影响[14-16],如高温胁迫降低小白菜生长量和叶片净光合速率[14],提高细胞膜伤害率和丙二醛含量等[15],对高温胁迫后小白菜的补偿生长却鲜有研究。随着全球气候变暖,高温成为作物生长面临的主要逆境[17-20]。但是,自然条件下,高温天气往往是不连续的,对高温过后小白菜在补偿性生长方面的生理生化机制进行研究,有助于了解小白菜补偿生长中的特点、规律和生理机制,对准确估测小白菜高温胁迫后的产量补偿能力具有重要意义,可为自然条件下小白菜合理规避高温风险提供指导。本研究针对小白菜的高温伤害症状、产量补偿能力、生理生化作用对不同时间高温胁迫的响应展开研究,以期查明小白菜的补偿生长能力并从生物内源性因素方面探讨小白菜的补偿机制,为夏季小白菜产量品质预测及环境调控提供理论依据和技术支持。
1 材料与方法
1.1 实验设计
实验于2017年3-4月在南京信息工程大学江苏省农业气象重点实验室的人工气候箱内进行。以青梗类型“上海青”Brassica chinensis L.为实验材料,选取籽粒饱满,整齐一致的种子 6~8粒直播于高30cm,直径20cm的塑料盆中。长至三叶一心时,每盆定植3株。栽培条件为:昼/夜温度为25℃/18℃,光照条件2000lx,光暗周期12h/12h,空气相对湿度75%,每2d浇1次水,用称重法将土壤含水量控制在田间持水量的80%左右。养分条件维持在适宜水平。待小白菜长至 5片真叶时,选取长势基本一致的植株进行高温胁迫处理。根据长江中下游地区夏季常见的高温天气,实验设高温组(HT),其昼夜温度设为 37℃/30℃,对照组(CK),昼/夜温度为 25℃/18℃,每组3个重复。实验分为2个阶段:胁迫阶段和恢复阶段。高温培养时间分别为3d、6d和9d,处理后,均置于昼/夜温度为 25℃/18℃的光照培养箱内恢复生长9d。分别在高温胁迫3、6、9d后以及恢复生长的3、6、9d后进行叶片光合参数测定,并取样测定叶绿素含量、可溶性蛋白含量、丙二醛(MDA)和保护酶活性。由于高温胁迫9d后的小白菜均在恢复过程中死亡,因此该处理无恢复期数据。
1.2 观测项目
(1)小白菜干重测定:在高温胁迫的 0d、3d、6d、9d以及恢复期的3d、6d、9d将植株地上部分和地下部分在通风干燥箱内 105℃杀青,然后 80℃烘至恒重,称重。小白菜干物质相对增量指当次测量的植株干重与前一次测量的干重之差。
(2)光合参数的测定:选取植株第3或第4片展开叶,用LI-6400便携式光合仪测定叶片的净光合速率、胞间CO2浓度、气孔导度、蒸腾速率,每个处理重复测定3次。叶室(2cm×3cm)内设定温度20℃,辐射强度为 600µmolm-2·s-1。
(3)叶绿素含量的测定:选取每棵植株上第 3或第 4片展开叶,洗净擦干,剪碎,称取 0.2g,置于95%乙醇中48h直至叶片中的叶绿素完全被提取出。取提取液在紫外分光光度计UV-1800(日本岛津)中采用比色法测定光密度值[21]。
(4)酶活性参数的测定:超氧化物歧化酶(SOD)活性用氮蓝四唑(NBT)法测定,以抑制NBT光化学还原的50%为1个酶活性单位;过氧化物酶(POD)活性用愈创木酚法测定,以每克鲜重每分钟在470nm处光吸收值变化0.1为1个酶活性单位;过氧化氢酶(CAT)活性测定用紫外吸收法,以每克鲜重每分钟在240nm处光吸收值变化0.1为1个酶活性单位[22]。
(5)可溶性蛋白含量的测定:采用考马斯亮蓝G-250 法测定[22]。
(6)丙二醛(MDA)的测定:采用硫代巴比妥酸(TBA)法测定[22]。
1.3 数据分析
补偿指数(G/C)为相同时段内实验组与对照组生长量的比值,用以表示生物的补偿生长模式。G为实验组补偿量,C为对照组生长量,G/C>1为超补偿,G/C=1为等补偿,G/C<1为低补偿[6]。
应用SPSS19.0软件,采用Duncan法进行差异显著性分析。利用灰色关联法对各指标与补偿指数的关系进行分析。
2 结果与分析
2.1 高温胁迫不同天数后小白菜的补偿生长量比较
由图 1a可以看出,与胁迫前相比,高温胁迫3d、6d和9d后,小白菜生物量相对增加量逐渐减小,3d处理为0.309g,6d为0.072g,高温处理9d后植株死亡,增加量为 0,而对照的生物量相对增加量稳定在 0.45g左右。可见,在此高温条件下,小白菜植株生长受到明显抑制,其中高温处理 3d组受到的抑制最小,处理6d组居中,处理9d组的伤害最大,直接造成植株死亡。图 1b显示,处理3d组和处理6d组胁迫结束后,植株在适宜温度下恢复,3d、6d和9d后其生长表现不同,胁迫3d组干物质增加量迅速上升,恢复生长3d后其增加量尚显著低于对照,但恢复生长6天后,其干物质增加量等于或高于对照,而胁迫6d组生长逐步恢复,但其生长速率一直显著低于对照;胁迫9d后小白菜多数死亡,即停止生长。说明经3d高温胁迫后,小白菜的生长仍可达到正常水平,6d和9d的高温则引起小白菜的不可逆损伤。
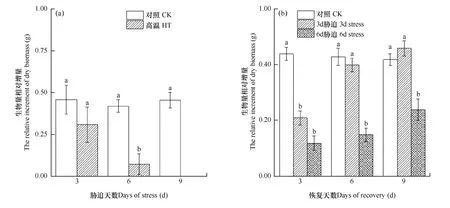
图1 高温胁迫后(a)及恢复后(b)小白菜生物量相对增量的比较Fig. 1 The relative increment of dry biomass of Chinese cabbage during the stress phase (a) and the recovery phase (b)
进一步计算胁迫结束恢复生长后小白菜的生长补偿指数,结果见图 2。由图可见,3d胁迫组小白菜在恢复的6d以内补偿指数均小于1,为低补偿阶段,但是在恢复的 6~9d则呈现超补偿,补偿指数达到1.10。6d胁迫组则在整个恢复期均呈现低补偿。可见,经过不同时间的高温胁迫小白菜出现了不同程度的补偿效应,补偿能力与胁迫时间有关。推测经过不同时间的高温胁迫,小白菜的各项生理生化指标,如光合能力、保护酶活性等可能产生了一系列的应激调整,从而影响植株的补偿能力。
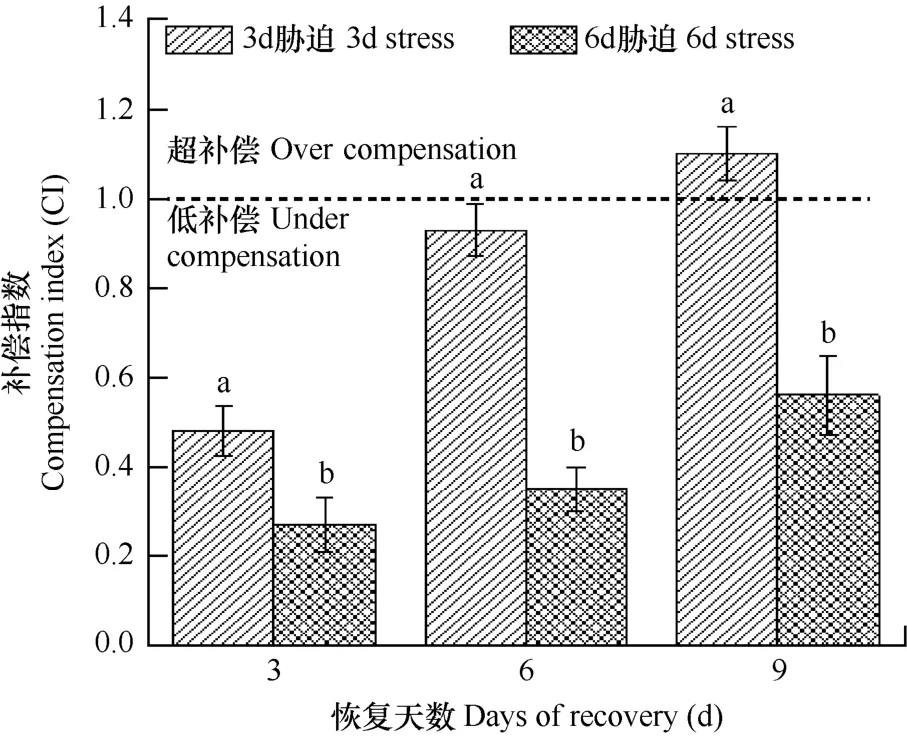
图2 高温胁迫后恢复期的补偿指数Fig. 2 Compensation indices (CI) of the relative increment ofdry biomass of Chinese cabbage during the recovery phase
2.2 高温胁迫不同天数后小白菜叶片叶绿素含量及光合特性的比较
高温胁迫及恢复生长期小白菜叶片叶绿素总量随时间的变化如图 3所示。由图可见,在高温胁迫阶段,胁迫组的叶绿素a含量在前3d呈上升趋势,高于对照处理水平,之后则呈下降趋势,9d低于对照水平,比对照下降了16.96%。胁迫3d、6d时叶绿素总量分别为3.03、2.82mg·g-1,比对照升高了28.26%和18.49%。在恢复阶段,胁迫3d组叶绿素含量逐渐下降,处理组与对照组的差异逐渐减小,直至降至对照水平,而胁迫6d组,叶绿素含量则逐渐下降至低于对照水平。

图3 高温胁迫(3、6、9d)后及恢复(3、6、9d)后小白菜叶绿素总量的比较Fig. 3 Total chlorophyll content of Chinese cabbage during the stress phase (3, 6, 9d) and the recovery phase (3, 6, 9d)
光合速率的高低是衡量叶片活力的重要生理指标,净光合速率的高低基本反映了叶片光合生理功能的强弱。如图4所示,在胁迫阶段,叶片Pn呈持续下降趋势,并在胁迫9d时出现负值。Gs和Tr也随着高温胁迫时间的增加而持续下降。可见高温有可能影响了叶片上气孔的开关程度,由于气孔限制和高温伤害共同造成光合系统效率降低。而 Ci随着高温胁迫时间的增加而持续上升,胞间 CO2浓度与净光合速率始终呈现负相关,说明气孔的开放程度与胞间 CO2浓度的相互作用影响了叶片的光合速率。在恢复阶段,3d处理组叶片Pn、Gs、Tr快速上升并高于对照水平,6d处理组Pn、Gs、Tr虽也呈现上升趋势,但始终低于对照。可见,3d的短期高温胁迫可能触发了了小白菜的某些防御应答机制,使光合速率出现超补偿,有利于植株的快速恢复,说明 3d短期的高温胁迫不足以对光合系统造成不可恢复性的影响。而6d长期高温胁迫则会对小白菜造成不可逆的损害,即使在恢复期,光合能力也不能达到对照水平。
2.3 高温胁迫不同天数后小白菜叶片 MDA、可溶性蛋白和保护酶活性的比较
蛋白质是生物体的重要组成部分,可调节植物生长发育和抗性形成等过程,大多数酶也是蛋白质,细胞在适应环境胁迫的过程中,需调节自身蛋白质的合成与分解。由图5a可见,高温胁迫期,小白菜可溶性蛋白含量显著上升,显著高于对照(图5a),说明小白菜叶片在高温胁迫下能迅速积累可溶性蛋白以抵御高温胁迫的伤害。在恢复阶段,3d处理组与6d处理组可溶性蛋白在恢复的前6d均继续呈现上升趋势,之后迅速下降至对照水平。
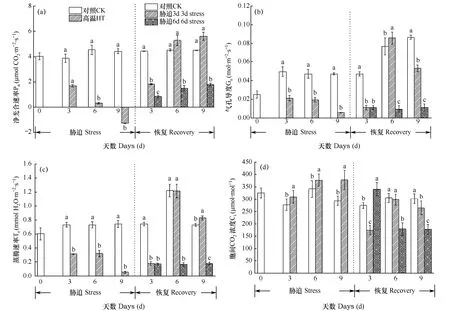
图4 胁迫期及恢复期小白菜净光合速率(a)、气孔导度(b)、蒸腾速率(c)和胞间CO2浓度(d)的变化Fig. 4 Photosynthetic parameters Pn (a),Gs (b),Tr (c) 和 Ci (d) of Chinese cabbage during the stress phase and the recovery phase
MDA含量可反应细胞在高温胁迫中受损伤的严重程度和抗逆性的强弱。由图5b可以看出,高温胁迫阶段,随着高温胁迫时间的推移,MDA含量持续增加,含量显著高于对照,高温处理3d、6d和9d组的含量比对照分别提高 36.13%、57.66%和63.24%,胁迫时间越长,MDA含量越高,细胞受损越严重。在恢复阶段,3d胁迫组和6d胁迫组MDA含量均呈下降趋势,但是胁迫3d处理的MDA含量一直低于6d处理。
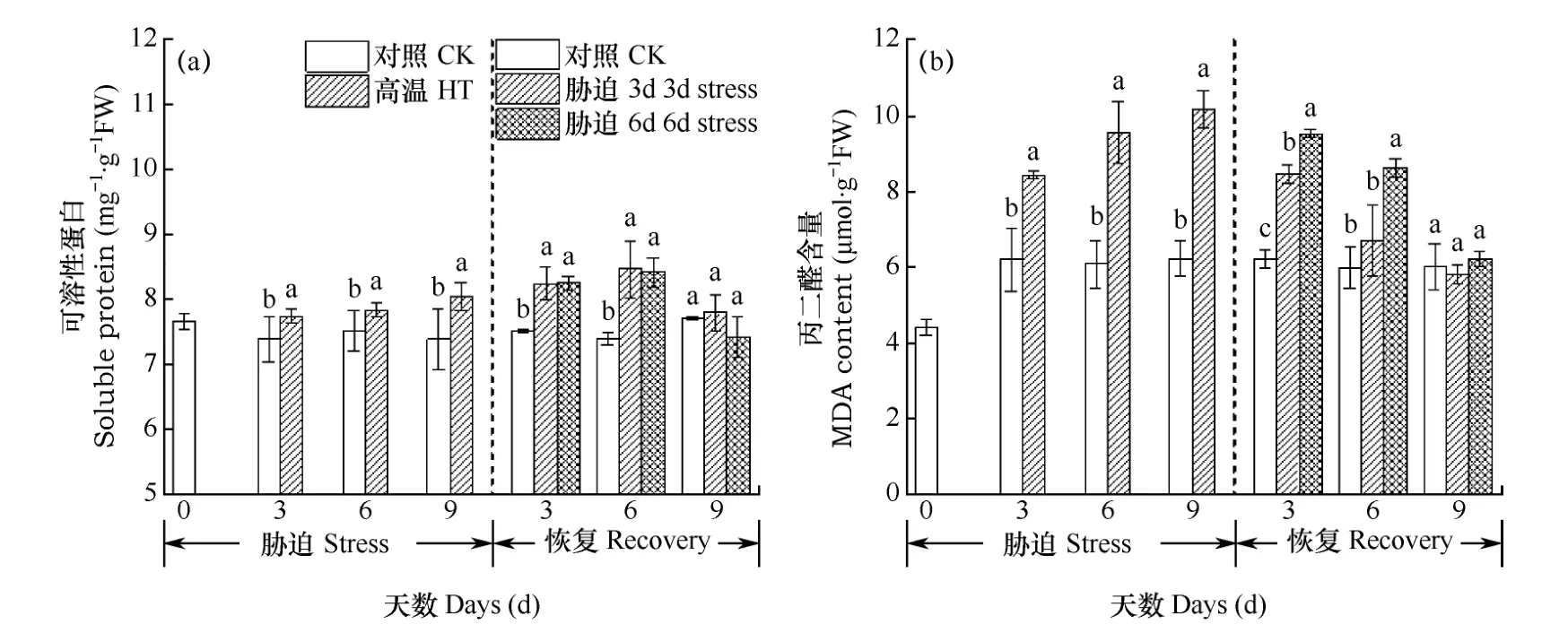
图5 胁迫期及恢复期小白菜可溶性蛋白(a)和丙二醛(b)含量Fig. 5 Soluble protein (a) and MDA (b) contents of Chinese cabbage during the stress phase and the recovery phase
SOD、CAT、POD是抗氧化酶系的重要成员,负责清除有氧呼吸相伴产生的活性氧及自由基,以避免细胞质膜等受到过氧化损伤。从图6可以看出,在高温胁迫阶段,SOD、CAT酶活性均呈上升趋势,显著高于对照,高温处理3、6和9d组的SOD活性分别比对照提高21.66%、27.45%和24.88%,CAT活性分别比对照提高10.17%、22.13%和16.00%。因为胁迫会引起活性氧增加,细胞则通过提高自身抗氧化系统的酶活性和抗氧化剂的含量来清除过量的氧自由基。而恢复阶段,保护酶的变化趋势较复杂,3d处理组SOD、CAT、POD保护酶活性逐渐恢复至对照水平,与对照的差异逐渐减小。而6d处理组在恢复阶段SOD和POD活性持续上升,高于对照水平,CAT持续下降,低于对照水平,出现一定的紊乱。

图6 胁迫期及恢复期小白菜超氧化物歧化酶(a)、过氧化氢酶(b)和过氧化物酶(c)活性Fig. 6 SOD (a), CAT (b), and POD (c) activities of Chinese cabbage during the stress phase and the recovery phase
2.4 高温胁迫不同天数后小白菜补偿生长的机制分析
利用每个生理生化指标的归一化数值绘制雷达图,以确定小白菜生长限制指标(图 7)。每个独立的数轴对应一个生理生化指标,数轴呈辐射状分布在中心点周围,把不同数轴上的指标归一化数值用折线连接起来所形成的曲线代表不同的处理。越靠近数轴的外侧,代表对应指标有利于小白菜生长,越靠近数轴的原点,代表指标不利于小白菜生长。由图可见,在3d处理组,各项指标归一化指标评分均较高,各指标的评价值除CAT和MDA外均为最大值,评分结果所构成的多边形面积在 3个处理中最大,可见,3d处理各项生长指标较好,在恢复过程中达到了较好状态,因此,其恢复生长后期干重增长速率高于对照,可出现超补偿现象;而对于 6d处理和 CK,评分结果构成的多边形向圆心明显收缩,说明各项指标综合状况较差。雷达图不仅综合反映了评价对象的好坏,更直接表现了其在单个指标上的优劣。在6d处理组,Pn、Gs、叶绿素和MDA含量的评价值靠近圆心,说明它在这方面具有很明显的劣势,Pn、Gs、叶绿素和MDA含量是6d处理的生长限制因素;在CK处理中,保护酶活性和可溶性蛋白含量的评价值靠近圆心,说明它在保护酶活性和可溶性蛋白方面较劣势。

图7 基于10项指标的小白菜恢复期生长分析Fig. 7 Description of Chinese cabbage growth based on the 10 factors of different treatments during the recovery phase
为了研究小白菜补偿生长与生理生化指标的具体关系,利用灰色关联法分析了10项具体的生理生化指标(叶绿素、Pn、Gs、Tr、Ci、可溶性蛋白、SOD、CAT、POD、MDA)与小白菜干物质增加量的关系。影响因素对目标因素的重要性越大,关联系数越高。由表1可见,与小白菜干物质增加量关联密切的因素主要有Pn(0.6287),其次是Gs(0.5518)、可溶性蛋白(0.4559)、MDA(0.4446)和叶绿素含量

表1 恢复期小白菜干重相对增量与生理生化指标之间的灰色关联度Table 1 Grey correlation degree between Chinese cabbage absolute increment weight and biochemical indices during the recovery phase
3 结论与讨论
灰色关联分析表明,与小白菜恢复生长速率关系最密切的指标为 Pn。周瑞莲等[12]研究也发现单叶蔓荆补偿生长与Pn呈显著正相关。有关研究表明,高温直接伤害植物的光合系统[23]。在胁迫期,植物Pn下降,在恢复期,3d处理迅速恢复甚至超过对照水平,6d处理也有缓慢恢复,但是一直显著低于对照水平,说明长期的高温胁迫会对小白菜的光合作用造成严重影响。诸多其它作物上的实验也证明了这点,孙宪芝等[9]研究表明,5d内33/28℃短期处理后菊花的光合作用可以在较短时间内得到恢复,而胁迫时间大于5d的Pn在短期正常条件下不能完全恢复。张洁等[24]研究表明,即使35℃亚高温处理番茄2h,番茄叶片 Pn在一日内也很难完全恢复,处理时间越长,光合作用恢复的时间也将越长。然而王晨阳等[25]发现小麦经过36h的38℃高温处理后,在恢复期小麦旗叶的Pn略呈上升趋势。这与本研究中3d处理迅速恢复甚至超过对照水平相似。因此,小白菜对高温胁迫较敏感,3d以上的高温伤害将对产量造成严重影响。
根据灰色关联分析,与小白菜恢复生长速率关系密切的指标为Gs。一般认为气孔对CO2和水汽进出叶片的共同控制作用是叶片光合-蒸腾耦合关系形成的原因,它是决定植物光合强度和水分蒸腾强度的重要因素,气孔调节在植物适应环境变化和环境压力中起着关键作用[26]。
灰色关联分析还表明,与小白菜生长速率关系密切的指标为可溶性蛋白。赵伟洁等[13]研究也发现,糜子的补偿生长与可溶性蛋白含量呈显著正相关。在胁迫期,植物可溶性蛋白一直呈上升趋势,在恢复期的前3d植物可溶性蛋白继续上升,之后下降至(0.4414),说明这些因子与小白菜干重增加有较密切关系,是影响小白菜补偿生长速率的主要因素。正常水平。可溶性蛋白的积累可能是植物细胞适应高温的一种保护策略,增加的蛋白质含量可能表明增强生理代谢[27]。一方面可能与合成更能适应温度胁迫环境的蛋白即热激蛋白有关[27];另一方面可能是高温诱导或增加了某些抗逆性酶的含量和活性从而引起可溶性蛋白的积累[27]。高温胁迫下小白菜叶片内的可溶性蛋白含量呈上升趋势,表明小白菜体内的可溶性蛋白在抵御高温胁迫过程中起到积极的作用。
MDA是膜脂过氧化过程中的分解产物,表示膜脂过氧化程度和对逆境反应的强弱。MDA含量越高,则损伤越大[21]。MDA具有细胞毒性,能引起细胞膜功能紊乱[28]。在高温胁迫期,MDA含量累积,随着胁迫时间的增加而增加。这表明虽然抗氧化酶随胁迫时间的推移而升高,但增高的抗氧化酶活性仍然不足以应付越来越多的自由基,导致细胞膜脂过氧化程度加重,MDA增加。然而,在恢复期,MDA含量显著下降,表明当受损细胞处于修复阶段时,膜功能逐渐恢复,小白菜的生长逐渐恢复正常。
有研究发现,植物补偿生长与叶绿素含量呈显著正相关[13]。叶绿素是植物重要的光合色素,在光子捕获、光能转换和电子传递等过程中起重要作用,直接影响光合效率和代谢水平[21],这在植物对温度的反应中起关键作用。在本研究中,高温胁迫阶段,叶绿素含量在前3~6d呈上升趋势,高于对照水平,之后则呈下降趋势,9d低于对照水平。在恢复阶段,3d处理叶绿素含量下降直到接近正常水平,6d处理则降低直至低于对照水平。虽然多种作物叶绿素含量会随高温胁迫而下降,但是本研究中叶绿素含量在胁迫阶段增加,与董瑜的研究一致[29-30],这可能与植物种类有关,可能是被响应和抗氧化相关基因在转录水平控制引起的,植物以此对抗高温胁迫。
SOD、CAT和POD是细胞抵御活性氧伤害的重要保护性酶,它们在清除O2-、H2O2和过氧化物,阻止或减少羟基自由基形成,保持膜系统免受损伤方面起着重要作用,与植物的抗逆性密切相关[31-32]。正常条件下,植物细胞内自由基的产生与清除之间保持着动态平衡状态,但在逆境条件下,植物细胞内的活性氧产生与清除的平衡关系受到破坏,积累的自由基就会对细胞造成伤害[33]。本实验发现,SOD、CAT、POD含量在胁迫期大多呈现上升趋势,恢复期则缓慢下降。这可能是植物的自身保护机制,热应激可能诱发表达氧化代谢的变化,激活基因表达,增加抗氧化酶活性[34]。Wang等[35-36]也发现高温胁迫下小麦SOD活性增加,查倩等[30]发现高温导致抗氧化酶活性增高。当然过度的高温伤害也会引起保护酶活性的降低[37]。
高温是抑制夏季小白菜生长的环境因素之一。从本研究可以看出,小白菜在37/30℃高温处理下生长受阻,高温伤害对小白菜伤害主要是降低叶片光合速率,提高细胞膜脂过氧化程度,小白菜在不良条件下难以完成正常生理活动,从而导致细胞生长迟缓、产物合成能力下降[38]。超补偿是生物与环境的长期博弈中形成的抗逆机理的重要组成部分,适度胁迫下,作物自身调控潜力可实现超补偿生长[7]。本实验中,不同胁迫时间处理补偿能力不同,这与王利彬等[3]研究结论相近,即补偿效应与胁迫程度有关,重度胁迫尤其是长时间重度胁迫会降低补偿效应甚至产生伤害效应,而适度胁迫可产生超补偿效应。3d胁迫组由于植株机体应激调整,启动防御应答机制,保护酶活性上升,可溶性蛋白积累,适度防御高温伤害,另外,3d胁迫使细胞内产生更多叶绿素,对叶片光合作用和恢复生长最为有利,Pn快速恢复,因此可以出现超补偿生长。灰色相关分析表明,Pn、Gs、可溶性蛋白、MDA和叶绿素含量在恢复期补偿生长中发挥了重要作用,是产生超补偿生长的主要驱动因素。但在持续(高温处理 6d)高温下,Pn迅速下降,MDA含量迅速上升,即使保护酶活性上升,但仍然不足以有效清除严重高温伤害引起的过量活性氧积累,而且积累过量的活性氧及其引发的膜脂过氧化产物反过来对防御体系起到破坏作用,从而加剧膜脂过氧化。因此,6d高温胁迫后Pn恢复缓慢,小白菜表现为低补偿生长。9d高温胁迫后小白菜Pn下降,叶绿素含量降低,在恢复过程中死亡。整体来看,3d及其以上的高温胁迫均会给小白菜生长带来不可逆损伤,生产中要尽量避免高温胁迫的影响,即使有高温条件出现也应尽可能将高温胁迫时间控制在3d以内,否则将对产量产生严重影响。
综合看来,小白菜在37/30℃高温处理下生长受阻,但是在胁迫解除后,3d组在恢复前6d呈现低补偿,恢复的6~9d呈现超补偿;6d组在整个恢复期均呈现低补偿;9d组则在恢复过程中死亡。因此,超过3d的高温胁迫将引起小白菜的不可逆损伤。小白菜在高温胁迫下,启动防御应答机制,Pn、Gs、可溶性蛋白、MDA和叶绿素含量是产生补偿生长的主要驱动因素。
References
[1]谭文,杨再强,李军.基于温光效应的小白菜营养品质模拟模型研究[J].中国农业气象,2016,37(1):59-67.Tan W,Yang Z Q,Li J.Simulation of nutrient quality of pakchoi based on temperature-light function[J].Chinese Journal of Agrometeorology,2016,37(1):59-67.(in Chinese)
[2]Ali M,Nicieza A,Wootton R J.Compensatory growth in fishes:a response to growth depression[J].Fish and Fisheries,2003,4(2):147-190.
[3]王利彬,祖伟,董守坤,等.干旱程度及时期对复水后大豆生长和代谢补偿效应的影响[J].农业工程学报,2015,31(11):150-156.Wang L B,Zu W,Dong S K,et al.Effects of drought stresses and times on compensation effect after re-watering in soybean[J].Transactions of the CSAE,2015,31(11):150-156. (in Chinese)
[4]孙永江,杜远鹏,翟衡.高温胁迫下不同光强对‘赤霞珠’葡萄PSII活性及恢复的影响[J].植物生理学报,2014,50(8):1209-1215.Sun Y J,Du Y P,Zhai H.Effects of different light intensity on psii activity and recovery of Vitis vinifera cv. cabernet sauvignon leaves under high temperature stress[J].Plant Physiology Journal,2014,50(8):1209-1215.(in Chinese)
[5]韩冬,杨菲,杨再强,等.高温对茶树叶片光合及抗逆特性的影响和恢复[J].中国农业气象,2016,37(3):297-306.Han D,Yang F,Yang Z Q,et al.Effects of high temperature stress and recovery on photosynthesis and stress tolerance of tea leaves[J].Chinese Journal of Agrometeorology,2016,37(3):297-306.(in Chinese)
[6]Belsky A J.Does herbivory benefit plants:a review of the evidence[J].The American Naturalist,1986,127(6):870-892.
[7]银敏华,李援农,周昌明,等.调亏灌水和分蘖干扰对冬小麦生长的补偿效应[J].应用生态学报,2015,26(10):3011-3019.Yih M H,Li Y N,Zhou C M,et al.Compensation effects of regulated deficit irrigation and tillering interference to winter wheat[J].Chinese Journal of Applied Ecology,2015,26(10):3011-3019.(in Chinese)
[8]李留勇.不同生育期高温处理对水稻生长及产量形成的影响[D].武汉:华中农业大学,2015.Li L Y.Effects of high temperature treatments at different growth stages on the growth and yield formation of rice[D].Wuhan:Huazhong Agriculture University,2015.(in Chinese)
[9]孙宪芝,郭俊娥,郑成淑.菊花的高温伤害及生长恢复研究[J].山东农业大学学报:自然科学版,2013,(1):6-11.Sun X Z,Guo J E,Zheng C S.Study on heat damage and vegetative recovery of chrysanthemum[J].Journal of Shandong Agricultural University (Natural Science),2013,(1): 6-11.(in Chinese)
[10]李婷,景元书,韩玮.亚高温胁迫解除后铜绿微囊藻的生长恢复[J].应用生态学报,2014,25(11):3337-3343.Li T,Jing Y S,Han W.Recovery growth of Microcystis aeruginosa after the sub-high temperature stress[J].Chinese Journal of Applied Ecology,2014,25(11):3337-3343.(in Chinese)
[11]Han W,Jing Y S, Li T.Compensatory growth in Microcystis aeruginosa after moderate high-temperature exposure[J].Journal of Limnology,2015,74(3):549-558.
[12]周瑞莲,贾有余,侯月利,等.不同厚度沙埋下植物光合特性变化与补偿性生长的关系[J].生态学报,2016,36(24): 8111-8119.Zhou R L,Jia Y Y,Hou Y L,et al.Relationship between changes in photosynthetic characteristics and plant compensatory growth under different sandburial depths[J]. Acta Ecologica Sinica,2016,36(24):8111-8119.(in Chinese)
[13]赵伟洁,李翠,晁桂梅,等.复水对水分胁迫条件下糜子生长的补偿效应[J].中国农业大学学报,2014,19(5):55-65.Zhao W J,LI C,Chao G M,et al.Compensation effect of rewatering on the growth of broomcorn millet under water stress[J].Journal of China Agricultural University,2014,19(5):55-65.(in Chinese)
[14]徐芬芬,柯维忠,王爱斌,等.NaCl 预处理缓解小白菜高温胁迫的光合生理机制[J].生态科学,2016,35(3):161-164.Xu F F,Ke W Z,Wang A B,et al.Photosynthetic mechanism of NaCl pretreatment on Brassica campestris ssp.chinensis L.under high temperature stress[J].Ecological Science,2016,35(3):161-164.(in Chinese)
[15]刘燕燕,沈火林,刘以前.高温胁迫对不结球白菜幼苗生长及生理指标的影响[J].华北农学报,2005,20(5):25-29.Liu Y Y,Shen H L,Liu Y Q.A study on the relationship between the growth and physiology of pakchoi and heat tolerance[J].Acta Agriculture Boreali-sinica,2005,20(5):25-29.(in Chinese)
[16]刘静静.气候因子和肥料结构对小白菜生长和品质的影响[D].上海:上海交通大学,2013.Liu J J.Influence analysis of different cultivated evironments and fertilizers on pakchoi[D].Shanghai:Shanghai Jiao Tong University,2013.(in Chinese)
[17]Sánchez B,Rasmussen A,Porter J R.Temperatures and the growth and development of maize and rice:a review[J].Global Change Biology,2014,20(2):408-417.
[18]冯敏玉,祝必琴,雷俊,等.南昌高温逼熟发生规律及其对早稻产量的影响[J].中国农业气象,2014,35(3):287-292.Feng M Y,Zhu B Q,Lei J,et al.Characteristics of hightemperature forced maturity disaster and it’s impacts on early rice in Nanchang area[J].Chinese Journal of Agrometeorology,2014,35(3):287-292.(in Chinese)
[19]郭建茂,吴越,杨沈斌,等.典型高温年不同播期一季稻产量差异及其原因分析[J].中国农业气象,2017,38(2):121-130.Guo J M,Wu Y,Yang S B,et al.Yield differences and its causes for one season rice under different sowing dates in typical high temperature year[J].Chinese Journal of Agrometeorology,2017,38(2):121-130.(in Chinese)
[20]喻莎,陆魁东,谢佰承,等.高温时数和热积温对超级早稻结实率的影响[J].中国农业气象,2016,37(4):454-463.Yu S,Lu K D,Xie B C,et al.Effects of high temperature hours and thermal accumulated temperature on seed setting rate of super hybrid rice[J].Chinese Journal of Agrometeorology,2016,37(4):454-463.(in Chinese)
[21]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.Li H S,Sun Q,Zhao S J,et al.The experiment principle and technique on plant physiology and biochemistry[M].Beijing:Higher Education Press,2000.(in Chinese)
[22]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002.Chen J X,Wang X F.Plant physiology experimental guidance[M].Guangzhou:South China University of Technology Press,2002.(in Chinese)
[23]Mathur S,Agrawal D,Jajoo A.Photosynthesis:response to high temperature stress[J].Journal of Photochemistry and Photobiology B:Biology,2014,137:116-126.
[24]张洁,李天来.短时间亚高温处理及其恢复对番茄光合特性的影响[J].农业工程学报,2007,23(1):162-167.Zhang J,Li T L.Effects of short time sub-high temperature treatment and its recovery on photosynthetic characteristics of tomato(Lycopersicon.esculentum Mill.)[J].Transactions of the CSAE,2007,23(1):162-167.(in Chinese)
[25]王晨阳,郭天财,阎耀礼,等.花后短期高温胁迫对小麦叶片光合性能的影响[J].作物学报,2004,30(1):88-91.Wang C Y,Guo T C,Yan Y L,et al.Effects of short postanthesis high temperature stress on leaf photosynthetic potential in winter wheat(Triticum aestivum L.)[J].Acta Agronomica Sinica,2004,30(1):88-91.(in Chinese)
[26]范嘉智,王丹,胡亚林,等.最优气孔行为理论和气孔导度模拟[J].植物生态学报,2016,40(6):631-642.Fan J Z,Wang D,Hu Y L,et al.Optimal stomatal behavior theory for simulating stomatal conductance[J].Chinese Journal of Plant Ecology,2016,40(6):631-642.(in Chinese)
[27]曹云英,段骅,王志琴,等.高温对水稻叶片蛋白质表达的影响[J].生态学报,2010,(22):6009-6018.Cao Y Y,Duan Y,Wang Z Q,et al.Influence of protein expression in rice leaves under heat stress[J].Acta Ecologica Sinica,2010,(22):6009-6018.(in Chinese)
[28]徐敦明,马志卿,冯俊涛,等.毒死蜱和鬼臼毒素胁迫对蔬菜上海青抗氧化酶系及丙二醛的影响[J].农业环境科学学报,2004,23(6):1089-1092.Xu D M,Ma Z Q,Feng J T,et al.Effects of chlorpyrifos and podophyllotoxin on antioxidative enzymes and the mda of vegetable(Brassica raps L.)[J].Journal of Agro-Environment Science,2004,23(6):1089-1092.(in Chinese)
[29]董瑜,田昆,郭绪虎,等.不同区域气候条件影响下的纳帕海湿地植物叶绿素荧光特性[J].生态环境学报,2013,22(4):588-594.Dong Y,Tian K,Guo X H,et al.Impacts of regional climate change on chlorophyll fluorescence characteristics of plateau wetland plants in Napahai,Yunnan China [J].Ecology and Environmental Sciences,2013,22(4):588-594.(in Chinese)
[30]查倩,奚晓军,蒋爱丽,等.高温胁迫对葡萄幼树叶绿素荧光特性和抗氧化酶活性的影响[J].植物生理学报,2016,52(4):525-532.Zha Q,Xi X J,Jiang A L,et al.Effects of heat stress on chlorophyll fl uorescence characteristics and antioxidant activity in grapevines(Vitis vinifera L.cv.Xiahei)[J].Plant Physiology Journal,2016,52(4):525-532.(in Chinese)
[31]Xu S,Li J,Zhang X,et al.Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J].Environmental and Experimental Botany,2006,56(3):274-285.
[32]Laxman R H,Rao N K S,Biradar G,et al.Antioxidant enzymes activity and physiological response of tomato (Lycopersicon esculentum M.) genotypes under mild temperature stress[J].Indian Journal of Plant Physiology,2014,19(2):161-164.
[33]Valentine J,Foote C S,Greenberg A,et al.Active oxygen in biochemistry[M].Berlin:Springer Science & Business Media,2012.
[34]Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9(10):490-498.
[35]Wang C,Wen D,Sun A,et al.Differential activity and expression of antioxidant enzymes and alteration in osmolyte accumulation under high temperature stress in wheat seedlings[J].Journal of Cereal Science,2014,60(3): 653-659.
[36]Wang X,Cai J,Liu F,et al.Multiple heat priming enhances thermo-tolerance to a later high temperature stress via improving subcellular antioxidant activities in wheat seedlings[J].Plant Physiology and Biochemistry,2014,74:185-192.
[37]Rai N,Rai K K,Tiwari G,et al.Changes in free radical generation,metabolites and antioxidant defense machinery in hyacinth bean(Lablab purpureus.L) in response to high temperature stress[J].Acta Physiologiae Plantarum,2015,37(3):1-12.
[38]Wahid A,Gelani S,Ashraf M,et al.Heat tolerance in plants:an overview[J].Environmental and Experimental Botany,2007,61(3):199-223.
