黄芪对香菇菌丝体及子实体中成分的影响
2018-03-16张劲松牛宇张丽珍单璐聂建军徐全飞冯婉君潘保华
张劲松,牛宇,张丽珍,单璐,聂建军,徐全飞,冯婉君,潘保华
1(山西大学 生物技术研究所,山西 太原,030006) 2(山西省农业科学院 农业资源与经济研究所,山西 太原,030006) 3(山西大学 生命科学学院,山西 太原,030006)
黄芪(Astragalusmembranaceus),蝶形花科黄芪属黄芪种,国家三级保护植物,传统中药材。主要分布在山西、甘肃、黑龙江、内蒙古、辽宁、河北等地。皂苷类、黄酮类、多糖类为黄芪中主要的三类物质[1]。现已明确黄芪在心肌损伤[2]、低氧-复氧造心肌损伤[3]等模型中,可缓解肌浆网,并影响肌浆网内Ca- ATP酶,从而调节钙的转运过程,影响心脏功能。免疫方面,黄芪对T,B淋巴细胞增殖、腹腔巨噬细胞功能等都有影响[4]。另有研究表明黄芪甲苷具有抗乙型肝炎病毒的活性[5]。
香菇(Lentinusedodes),担子菌门,伞菌目,是一种常见食用菌。中国是世界人工栽培香菇的发祥地,是全球最大的香菇生产和消费国[6]。香菇子实体可以食用,味道鲜美,口感润滑,富含蛋白质、氨基酸和多种矿物质元素,脂肪含量低,是理想的健康食品,深受消费者们喜爱[7]。我国香菇栽培技术已经十分成熟[8]。随着香菇消费量的逐年增加,如何培育出新型特色香菇品种成为了新兴研发热点,其中改变香菇栽培料配方便是其中之一[9-12]。本实验探究了使用黄芪作为培养基质,并对香菇的菌丝体和子实体中的总多糖、总酚酸、总黄酮和总皂苷含量进行测定,同时利用高效液相色谱法检测添加黄芪后获得的香菇菌丝体和子实体中的毛蕊异黄酮葡萄糖苷和芒柄花苷的含量。
1 材料与方法
1.1 材料
材料:黄芪、黄芪下脚料,山西裕隆祥农业发展有限公司;香菇菌种,山西省农科院农业资源与经济研究所保藏。
1.2 供试培养基
PDA固体培养基:马铃薯20%、葡萄糖2%、MgSO40.2%、KH2PO40.2%、蛋白胨0.3%、琼脂2%。
液体种子培养基:黄豆芽汁20%、葡萄糖2%、酵母膏0.5%、KH2PO40.2%、MgSO40.1%、VB10.01%,pH自然。
栽培袋培养料配方:木屑40%,锯末20%,棉籽壳30%,麦麸18%,豆粉2%,石膏0.5%,含水量65%。
1.3 仪器
SNE-3000M台式扫描电子显微镜,韩国(株)SEC公司;Infinite M200 PRO 全波长多功能微孔板检测器,帝肯公司;U3000型戴安高效液相色谱仪,Thermo fisher科技(中国)有限公司;Christ ALPHA 2-4 LD plus真空冷冻干燥机;Sigma 2-16PK冷冻离心机德国西格玛公司,德国西格玛公司;YXQ-LS-50立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;DHG-9040S电热恒温鼓风干燥箱,宁波东南仪器有限公司;RE-2000A型旋转蒸发器,上海市嘉鹏科技有限公司;BS-S恒温振荡培养箱,国华电器有限公司;ME 204电子天平,梅特勒-托利多仪器(上海)有限公司;SW-GJ-1FD系列超净工作台,上海博讯实验有限公司医疗设备厂;SL-500A型高速多功能粉碎机,浙江省永康市松青五金工具厂。
1.4 实验方法
1.4.1 黄芪水提物的制备
将黄芪根部药材切成段,粉碎,过筛,精确称量100.00 g,置于700 mL蒸馏水中浸泡2 h,边搅拌边加热45 min,4层纱布过滤残渣后抽滤,取上清液,重复收集2次,合并提取液。减压浓缩至50 mL,冷冻干燥后研磨成粉末即得黄芪水提物干粉,避光干燥处保藏。
1.4.2 香菇菌丝体扫描电镜形态观察
配黄芪水提物浓度为3 g/100 mL的PDA培养基,121 ℃湿热灭菌20 min后倒平板。待平板培养基水汽消失后,接种活化好的菌种,72 h后挑取菌落边缘在电镜下观察香菇菌丝体的形态,与未添加黄芪水提物的对照做比较。
1.4.3 香菇深层发酵添加黄芪水提物最大量的确定
配制2 g/mL的黄芪水提物溶液(溶剂为水),备用。取50 mL的锥形瓶,依次添加黄芪水提物溶液0、0.3、0.6、1.2、1.8、2.4、3.6 mL,将热的PDA培养基称量后倒入锥形瓶中加至24 mL,振荡混匀,配成黄芪水提物浓度为0、0.25、0.5、1.0、1.5、2.0、3.0 g/100 mL的培养基。灭菌,趁热倒平板,以8 mL为量每个浓度倒3个平板。待培养基水汽消失,将活化好的香菇菌种用打孔器取6 mm2接种于培养基上。连续观察6 d,记录香菇菌丝体生长情况。按公式(1) 计算黄芪水提物对香菇菌丝生长的抑制率。筛选原则以不显著影响香菇生长的最大黄芪水提物添加量作为香菇深层发酵中添加黄芪水提物的量。
(1)
1.4.4 香菇液体发酵
1.4.4.1 液体发酵母液的制备
将活化好的香菇菌种接入装有100 mL液体种子培养基的250 mL锥形瓶中,置于摇床上100 r/min,28 ℃培养7d作为接种时的母液。
1.4.4.2 添加黄芪水提物的香菇的液体发酵
吸取10 mL培养7 d的香菇母液,接入100 mL液体种子培养基,处理组中黄芪水提物添加浓度为0.5 g/100 mL,转速100 r/min,恒温培养箱中28 ℃培养7 d,备用。
1.4.4.3 液体发酵后菌球形态的特征比较
发酵完毕后取出1 mL菌液,数出菌球个数,计算菌球密度。随机取出10个菌球排成一排置于载玻片上,在载玻片下衬坐标纸测量菌球平均直径。从对照组和添加黄芪水提物组中各取3个大小形态近似的菌球,分别接种在PDA培养基上,统计菌丝萌发的时间,从萌发时间开始每隔24 h测量菌落半径,连续观察6 d,计算菌丝的日均生长量。最后将菌球过滤并清洗,60 ℃干燥至恒重,称重。
1.4.5 菌丝体干粉的制备
将培养好的液体发酵液在3 500 r/min条件下离心20 min,清洗后再离心,将沉淀在60 ℃恒温鼓风干燥箱中干燥至恒重,研磨成粉末,称重,密封保存备用。测定并计算香菇菌丝体中的黄芪总皂苷、总酚酸、总黄酮、胞内多糖、胞外多糖、毛蕊异黄酮葡萄糖苷、芒柄花苷的转化率,计算见公式(2):

(2)
1.4.6 香菇栽培添加黄芪下脚料最大量的确定
以普通栽培料配方作为对照,加入3只高20 cm的试管中,边加栽培料边压实,加至试管2/3处。以分别添加5%、10%、15%、20%、25%的黄芪下脚料的栽培料作为实验组。高压蒸汽灭菌,放置1 d,将活化好的香菇菌种取出,用打孔器将大小为6 mm2的菌种接入试管中,在培养箱中28 ℃培养,每隔24 h观察菌丝体生长状况,以此来判断田间栽培时黄芪下脚料的添加量。
1.4.7 添加黄芪下脚料的香菇栽培
以普通培养料配方作为对照组,在普通培养料配方基础上添加最适黄芪下脚料作为实验组,采用菌袋栽培法大棚内栽培。将培养好的香菇子实体及时采摘,收获普通香菇子实体与添加黄芪下脚料栽培收获的香菇子实体。晒干后于4 ℃冰箱密封保藏。测定并计算黄芪总皂苷、总多酚、总黄酮、总多糖、毛蕊异黄酮葡萄糖苷、芒柄花苷的转化率,转化率见公式(3):

(3)
1.4.8 样品前处理
1.4.8.1 总皂苷提取
取样品1 g,加15 mL甲醇,超声提取30 min,4 000 r/min离心5 min,用0.45 μm滤膜过滤,残渣用甲醇超声提取2次,合并滤液,减压蒸干。加入10 mL体积分数为10%氨水,振摇10 min,分别用15、10、10 mL正丁醇萃取3次,合并提取液,减压蒸干,甲醇定容至10 mL。
1.4.8.2 总黄酮、总酚酸提取
取样品1 g,加入15 mL体积分数为70% 乙醇浸泡24 h,于30 ℃水浴超声30 min,5 000 r/min离心15 min,重复提取2次,合并滤液,减压蒸干,甲醇定容至10 mL。
1.4.8.3 毛蕊异黄酮苷、芒柄花苷提取
将样品用甲醇回流提取4 h,过滤。提取物减压过滤浓缩至干,体积分数为50%甲醇溶解定容。
1.4.8.4 总多糖提取
称取20 g样品,加入7倍蒸馏水浸泡1 h,沸水煮45 min,过滤,重复提取1次,合并滤液,减压蒸干,蒸馏水定容。
1.4.8.5 胞外多糖提取
将发酵液过滤后滤液加入3倍体积95%乙醇沉淀24 h,4 000 r/min离心20 min,沉淀60 ℃恒温干燥至恒重,即为胞外粗多糖,蒸馏水定容至50 mL。
1.4.8.6 胞内多糖提取
取菌丝体干粉,以1∶10加蒸馏水,90 ℃水浴加热3 h,提取2次,减压过滤并收集滤液。60 ℃减压浓缩,浓缩液加4倍无水乙醇沉淀24 h,4 000 r/min
离心20min,即为胞内粗多糖,蒸馏水定容至50 mL。
1.4.9 测定方法
总皂苷、总黄酮、总酚酸、总多糖的测定方法分别采用浓硫酸/香草醛法、硼氢化钠四氯苯醌法、福林酚法、硫酸/苯酚法。其中总皂苷测定标准品选用黄芪甲苷[13],总黄酮测定标准品选用槲皮素[14-15],总酚酸测定标准品选用没食子酸[16],总多糖测定标准品选用葡萄糖[17],毛蕊异黄酮葡萄糖苷、芒柄花苷的测定方法采用高效液相色谱法[18]。
1.4.10 数据处理
用SPSS Statistics 17.0进行单因素方差分析,用Duncan’s多重比较,检验各个处理数据间的差异显著性。
2 结果与分析
2.1 黄芪水提物的制备
黄芪水提物呈淡黄色,粉末质地均匀,有黄芪味,极易潮,须密封干燥保存,质量为32.09±1.56 g,得率为32.09%。
2.2 黄芪水提物、黄芪和黄芪下脚料成分含量测定
黄芪水提物、黄芪和黄芪下脚料的总多糖、总酚酸、总黄酮、总皂苷测定见表1。由表1可知,三者中均含有总多糖、总酚酸、总黄酮、总皂苷、毛蕊异黄酮葡萄糖苷和芒柄花苷。对于黄芪和黄芪水提物来说,含量上从大到小依次为总多糖、总皂苷、总黄酮、总酚酸、毛蕊异黄酮葡萄糖苷和芒柄花苷。而黄芪下脚料中含量上从大到小依次为总多糖、总黄酮、总皂苷、总酚酸、毛蕊异黄酮苷和芒柄花苷。由黄芪与黄芪下脚料成分含量倍数关系可知,黄芪中多糖含量是黄芪下脚料的3.91倍,黄芪中毛蕊异黄酮苷和芒柄花苷含量是黄芪下脚料的5.24倍和5.21倍,黄芪中总皂苷含量和总酚酸含量是黄芪下脚料中的2.05倍和1.89倍,黄芪与黄芪下脚料中的总黄酮含量差距最小,为1.77倍。

表1 黄芪水提物、黄芪和黄芪下脚料中各物质含量Table 1 The content of Astragalus aqueous extract, Astragalus and Astragalus waste material
毛蕊异黄酮苷、芒柄花苷的高效液相色谱测定结果见图1,可见在该色谱条件下毛蕊异黄酮苷和芒柄花苷在色谱柱中分离的很好,毛蕊异黄酮苷和芒柄花苷的出峰时间分别为(17.53±0.09)和(32.61±0.04)min,经考察,标准曲线的线性关系、实验的精密度、准确性、重现性和回收率良好,实验结果具有可参考性。
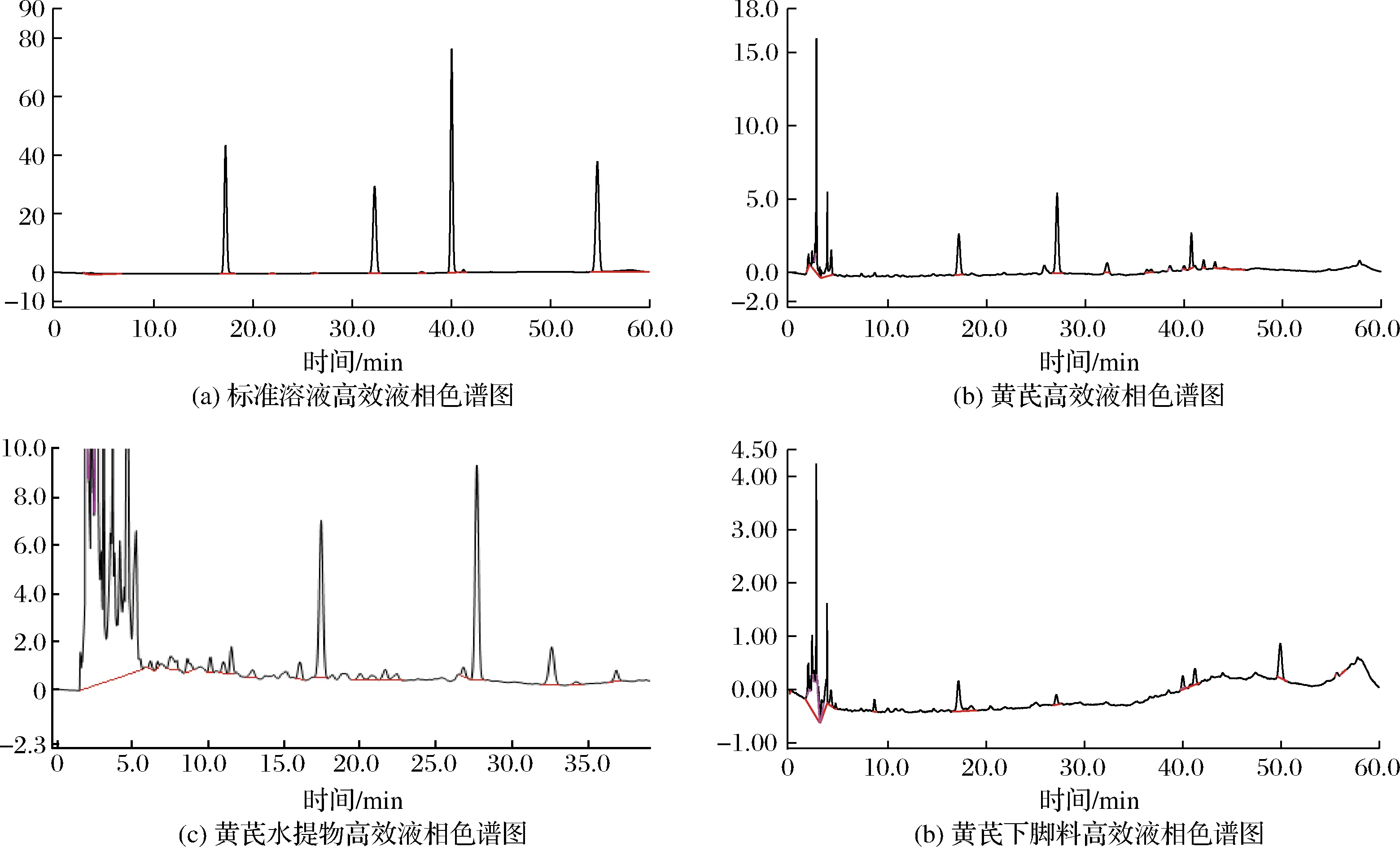
A-标准溶液高效液相色谱图;B-黄芪高效液相色谱图;C-黄芪水提物高效液相色谱图;D-黄芪下脚料高效液相色谱图图1 高效液相色谱图Fig.1 High performance liquid chromatography
2.3 添加黄芪水提物的香菇菌丝体在扫描电子显微镜下的形态
培养基中添加黄芪水提物的香菇菌丝以及不添加黄芪水提物的香菇菌丝在扫描电子显微镜的形态见图2。

图2 添加黄芪水提物后香菇菌丝体在扫描电子显微镜下的照片Fig.2 Photos of Lentinus edodes after adding Astragalus aqueous extract under scanning electron microscopy注:其中图①、②为未添加黄芪添加水提物(1k倍、5k倍);图②、④为添加浓度为3 g/100 mL的黄芪水提物(1k倍、5k倍)。
从放大1k倍的电镜图像上可以看到添加3 g/100 mL的黄芪水提物后香菇菌丝的密度远远小于未添加黄芪水提物的香菇菌丝密度。从放大5k倍的电镜图像上可以看到添加黄芪水提物后香菇菌丝在最粗处达3.13 μm,最细处为746 nm。而未添加黄芪水提物的香菇菌丝在最粗处为2.80 μm,最细处为508 nm。添加黄芪水提物实验组中的香菇菌丝形态饱满,对照组中的菌丝形态略微干瘪。说明添加高浓度的黄芪水提物能够明显影响香菇菌丝生长状况,黄芪水提物虽然能抑制香菇菌丝致密生长,但菌丝会比对照组更为粗壮饱满。
2.4 香菇深层发酵添加黄芪水提物的量的确定
图3为接种6 d后香菇菌丝体在含不同浓度黄芪水提物培养基上的生长状况,可以看出随着黄芪水提物浓度的增加,对香菇菌丝体的生长产生抑制作用,且黄芪水提物浓度越大抑制越明显。图4为黄芪水提物添加浓度对香菇菌丝体生长抑制情况及日生长情况的关系曲线,经SPSS方差分析,不影响香菇菌丝体生长的最大黄芪水提物添加量为0.5 g/100 mL,因此本实验选取添加浓度为0.5 g/100 mL黄芪水提物作为深层发酵实验组的添加浓度,这样既不影响香菇菌丝体的生长,又能使黄芪水提物中的物质在香菇菌丝体中的含量尽可能达到最大,对后续栽培实验的添加量提供依据。

图3 接种6 d后香菇菌丝体在含不同浓度黄芪水提物的培养基上的生长状况Fig.3 Appearance of mushroom mycelia in different concentrations of Astragalus aqueous extract inoculated six days later
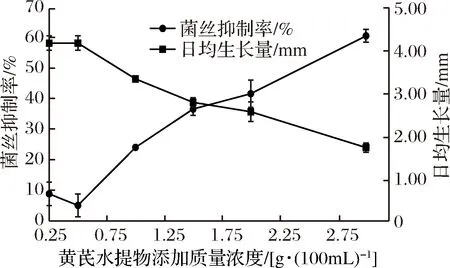
图4 黄芪水提物添加浓度对香菇菌丝体生长抑制情况的关系曲线Fig.4 Curve of the inhibitory effect of the extract concentration of Astragalus on mycelial growth of Lentinula edodes
2.5 液体发酵后菌球形态的特征比较
培养7 d后,将液体发酵后的锥形瓶从恒温振荡培养箱中取出,香菇菌球的生长状况如图5所示。
从图5可以观察出发酵液的颜色基本相同,对照组和添加黄芪水提物培养的香菇菌球大小均匀,长势良好。添加黄芪水提物培养的香菇菌球数目明显多于未添加组。
由表2可以看出,添加黄芪水提物香菇的液体发酵在菌球密度大于未添加对照组,为67.33±4.04个/mL,对照组为54.00±4.36 个/mL。添加黄芪水提物组的菌球平均直径远小于对照组,说明菌球长势良好,相对表面积大,有利于与外界进行物质交换。香菇菌丝体干重添加黄芪水提物组则与对照组相近。说明该黄芪水提物浓度下对香菇进行深层发酵不对香菇菌丝体的生长产生抑制。添加黄芪水提物组的菌球接回PDA培养基后的萌发时间较对照组短,为12.83±0.29 h。接回PDA培养基后,添加黄芪水提物组的菌丝平均生长速度快于未添加对照组,但结果不显著。
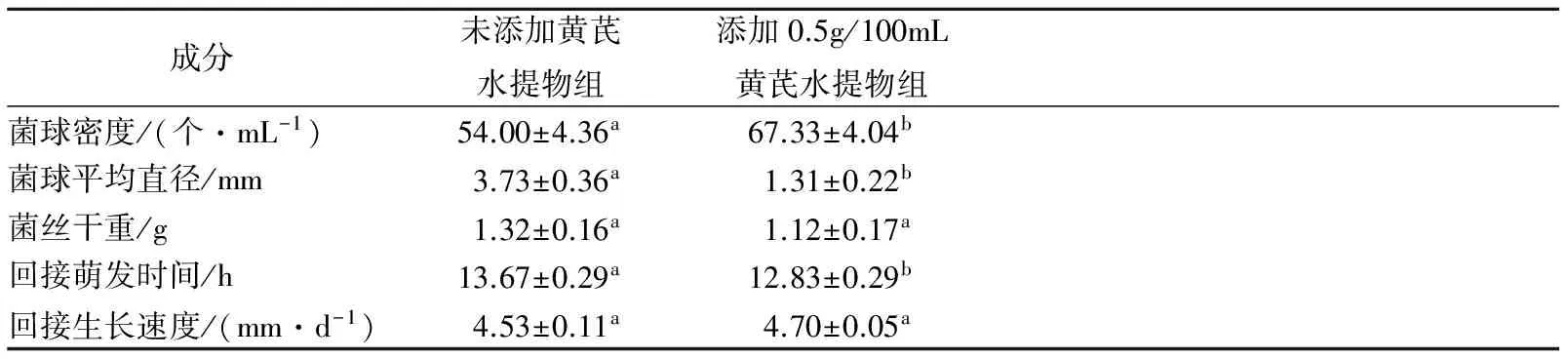
表2 添加黄芪水提物对香菇液体发酵菌球形态的影响Table 2 Effect of aqueous extract of Astragalus ondeep fermentation of Lentinula edodes
注:同行小写字母表示0.05显著水平。
2.6 菌丝体中成分含量测定
通过对液体发酵后的香菇菌丝体的胞内多糖、胞外多糖、总酚酸、总黄酮、总皂苷、毛蕊异黄酮葡萄糖苷和芒柄花苷进行含量测定,得到表3。
从表3可以看出在添加黄芪水提物后,香菇菌丝体中的胞外多糖、胞内多糖、总酚酸、总黄酮和总皂苷在含量上较对照组香菇菌丝体均有增加。其中总皂苷的转化率最高,达13.56%,说明黄芪水提物对香菇液体发酵在胞内多糖和总酚酸成分上造成的影响较大;胞内多糖和总酚酸的转化率相近,均在3%以下,说明黄芪水提物对香菇深层发酵在胞内多糖和总酚酸成分影响较小;总黄酮的转化率最低,为0.17%,说明黄芪中的黄酮成分对香菇菌丝体的影响很小,基本可以忽略不计。此外,黄芪中特有的毛蕊异黄酮苷在添加黄芪水提物的实验组被检测到,说明香菇菌丝将黄芪水提物中的毛蕊异黄酮苷进行了转化,转化率为0.69%,而在添加黄芪水提物的实验组中未检测到香菇菌丝中含有芒柄花苷,说明香菇菌丝在生长过程中对芒柄花苷没有转化。
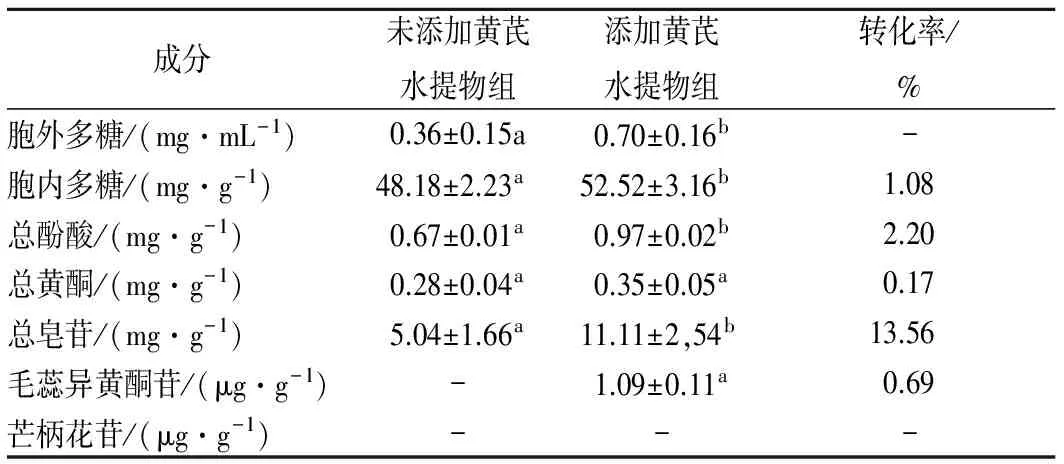
表3 香菇液体发酵后菌丝体成分含量测定Table 3 Content of mycelium of Lentinula edodesafter deep fermentation
注:同行小写字母表示0.05显著水平。
2.7 香菇栽培添加黄芪下脚料最大量的确定
黄芪下脚料添加量依次为0%、5%、10%、15%、20%、25%,随着黄芪下脚料添加量的增大,相应香菇菌丝的生长速度变缓。图6为菌丝体长满试管至试管底部所用的时间及菌丝平均每日向下生长的距离,经SPSS分析,与不添加下脚料对照组生长状况大致相同,不显著影响香菇菌丝的生长。因此后续的田间栽培实验中添加黄芪下脚料的比例选择为5%。
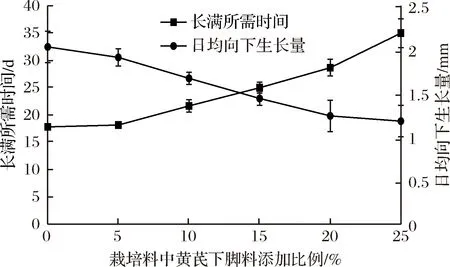
图6 添加黄芪下脚料对香菇菌丝生长的影响Fig.6 The effect of adding Astragalus waste on the growth of mycelia of Lentinus edodes
2.8 香菇子实体中成分含量测定
在栽培料中添加5%的黄芪下脚料后,培育出的香菇子实体产量与对照大体相近,但个头略小,气味更浓,口感更细腻。经测定,由表4可知,栽培料中添加黄芪下脚料培育出的香菇子实体中的总多糖、总酚酸、总黄酮和总皂苷含量都有不同程度的提高,黄芪特征组分毛蕊异黄酮苷也被检测出,芒柄花苷未被检出。从转化率来看,香菇对黄芪下脚料中的总多糖含量转化最多,为29.43%,说明黄芪下脚料中的糖分可以被充分吸收并转化,且相对于香菇菌丝体来讲,香菇子实体对多糖的转化率更高;其次为总皂苷和总酚酸,转化率分别为9.09%和6.26%;总黄酮转化率为0.63%,说明黄酮含量转化较少;出现于香菇子实体中的黄芪成分毛蕊异黄酮苷的转化率为2.54%。
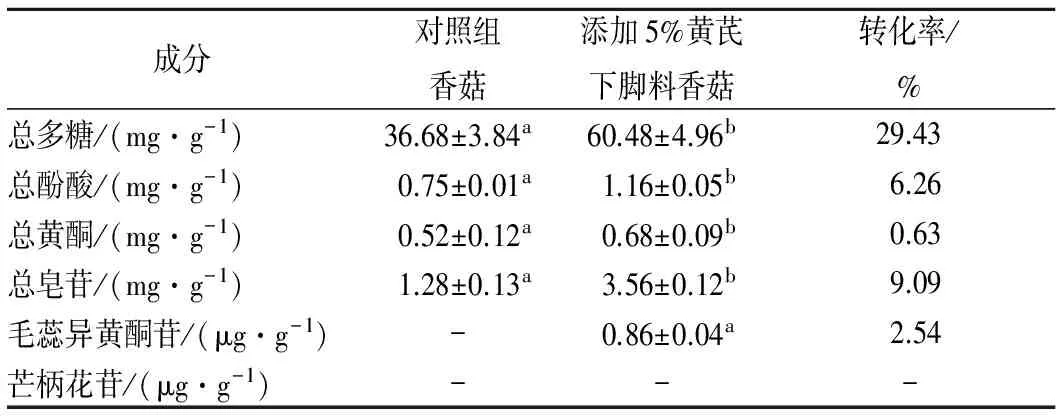
表4 香菇子实体中成分含量测定Table 4 Content of fruiting bodies of Lentinula edodes
注:同行小写字母表示0.05显著水平。
3 结论与讨论
从物种分类角度看蘑菇与植物分属两大不同的界,但两者合成代谢途径中的一些关键酶和分子调控机制是相似的。基于此,国内外学者将药用植物应用于诱导大型食用真菌次生代谢产物积累的研究与实践,取得了重要进展[19-22]。
黄芪主根用来做药材, 黄芪下脚料(包括黄芪茎枝、侧根、根须以及无法做优良药材的较短的主根)烧之可惜。黄芪下脚料中的总皂苷、总黄酮、总酚酸、总多糖、毛蕊异黄酮葡萄糖苷和芒柄花苷含量分别为46.71 mg/g、2.62 mg/g、10.24 mg/g、10.03 mg/g、13.56 μg/g、3.78 μg/g,与黄芪药材相比成分相差倍数分别为3.91、1.89、1.77、2.05、5.21、5.24。这表明黄芪下脚料作为药用栽培植物废弃物,在食用真菌栽培基料中应用可以变废为宝。
培养基中添加黄芪水提物0.5 g/100 mL以上时会出现抑制生长,添加0.5 g/100 mL时生长正常,在添加0.5 g/100 mL黄芪水提物而获得的香菇菌丝体中,胞内多糖、总酚酸、总黄酮、总皂苷、毛蕊异黄酮葡萄糖苷的含量分别为52.52 mg/g、0.97 mg/g、0.35 mg/g、11.11 mg/g、1.09 μg/g,转化率分别为1.08%、2.20%、0.17%、13.56%、0.69%,都较对照组有所提高,说明香菇菌丝在生长时对黄芪中的一些成分进行了转化。例如冮洁等[23]对羊肚菌富硒做了研究。WU等[24]利用藤茶培养茯苓后对其中的酚酸黄酮成分进行了测定。
利用黄芪下脚料栽培培育新型香菇子实体是可行的。在田间栽培添加黄芪下脚料收获的香菇子实体中多糖、总酚酸、总黄酮、总皂苷、毛蕊异黄酮葡萄糖苷的含量分别为60.48 mg/g、1.16 mg/g、0.68 mg/g、3.56 mg/g、0.86 μg/g,转化率分别为29.43%、6.26%、0.63%、9.09%、2.54%。由于代谢途径中关键酶的制约,并不是黄芪中所有特征物质均可以在香菇中转化,如芒柄花苷就未被检出。例如在添加核桃壳之后平菇子实体中的多糖和粗纤维含量都有了显著增加[25]。相信未来利用黄芪下脚料栽培的新型香菇有着广阔的市场和前景。
[1] 张蔷,高文远,满淑丽,等.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3 203-3 207.
[2] XU X L, JI H, GU S Y, et al. Modification of alterations in cardiac function and sarcoplasmic reticulum by astragaloside IV in myocardial injuryinvivo[J]. Eur J Pharmacol,2007,568(1-3): 203-212.
[3] XU X L, CHEN X J, JI H, et al. Astragaloside IV improved intracellular calcium handling in hypoxia-reoxygenated cardiomyocytes via the sarcoplasmic reticulum Ca-ATPase[J]. Pharmacology,2008,81(4): 325-332.
[4] WANG Y P, LI X Y, SONG C Q, et al. Effect of astragaloside IV on T,B lymphocyte proliferation and peritoneal macrophage function in mice[J]. Acta Pharmacol Sin,2002, 23(3): 263-266.
[5] WANG S, LI J, HUANG H, et al. Anti-hepatitis B virus activities of astragaloside IV isolated from Radix Astragali[J]. Biol Pharm Bull,2009,32(1): 132-135.
[6] 孙成文, 江岩, 钟国赣,等. 黄芪多糖抗氧化损伤作用的研究[J]. 中国药理学通报, 1996(2):161-163.
[7] 高观世,张陶,吴素蕊,等.食用菌蛋白质评价及品种间氨基酸互补性分析[J].中国食用菌,2012,31(1):35-38.
[8] 李月梅. 香菇产业具有良好的发展前景[J]. 食品科学, 2005, 26(7):261-266.
[9] 兰良程.中国食用菌产业现状与发展[J].中国农学通报,2009,25(5):205-208.
[10] 王新风.富硒食用菌栽培技术[J].中国食用菌,2002,21(3):13-15.
[11] 姚自奇,兰进.杏鲍菇研究进展[J].食用菌学报,2004,11(1):52-58.
[12] 姜宝财.食用菌栽培技术研究进展[J].中国农业信息,2015(18):91-92.
[13] 韩鲁佳,阎巧娟,江正强,等.黄芪多糖及皂苷提取工艺研究[J].农业工程学报,2000,16(5):118-121.
[14] HE X J, LIU D, LIU R H. Sodium borohydride/chloranil-based assay for quantifying total flavonoids[J]. J Agric Food Chem, 2008,56(20):9 337-9 344.
[15] 单璐.不同加工方式小米营养成分的变化[D].太原:山西大学,2016.
[16] 付煜荣,张万明,陈桂敏,等.景天三七中没食子酸和总酚酸含量测定[J].中成药,2006,28(7):1 016-1 018.
[17] 杨晓华,于广利,赵峡,等.灰树花糖蛋白中总糖含量的测定[J].中国海洋大学学报(自然科学版),2006,36(6):929-931.
[18] 梁丽娟,赵奎君,屠鹏飞,等.HPLC法同时测定黄芪中4种黄酮类成分的含量[J].中国药房,2010,21(15):1 385-1 387.
[19] 柴月明.利用黄芪和甘草茎叶栽培鸡腿菇技术[J].甘肃农业科技,2011(10):60-61.
[20] 佘红,岳文辉,方建龙,等.中药药渣栽培金针菇试验[J].食用菌,2006(6):29-29.
[21] 汪涛,王晓玲,赵舒武,等.中药废渣在食用菌培养中的生物转化再利用研究[J].中华中医药学刊,2008,26(4):871-872.
[22] SONG H B, LEE H S. Changes of ginsenoside content by mushroom mycelial fermentation in red ginseng extract[J]. J Ginseng Res, 2011,35(2): 235-242.
[23] 冮洁,麦海美,解彬,等.羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究[J].食品与发酵工业,2016,42(9):120-125.
[24] WU J, WANG C H. Biotransformation of vine tea (Ampelopsisgrossedentata) by solid-state fermentation using medicinal fungusPoriacocos[J]. J Food Sci Technol,2016,53(8):3 225-3 232.
[25] 朱晓琴.以核桃壳为原料栽培食用菌的研究[D].昆明:西南林学院,2008.
