小曲中优质产酯酵母分离鉴定及其产酯条件优化
2018-03-16王鹏昊关统伟张习超赵顺先向慧平张家旭赵小林欧梦莹林宜锦许琴
王鹏昊,关统伟,张习超,赵顺先,向慧平,张家旭,赵小林,欧梦莹,林宜锦,许琴
1(西华大学 食品与生物工程学院,四川 成都,610039) 2(成都蜀之源酒业有限公司,四川 大邑,611330)
小曲也被称作酒药、酒饼、米曲,是小曲酒生产过程中的糖化发酵剂,在小曲酒酿造过程中同时起着糖化和发酵的双重作用。乙酸乙酯是小曲酒中的主体香味成分,同时也是我国清香型白酒的主体香气组成成分[1]。在清香型白酒的所有酯类物质中,乙酸乙酯在酯类物质中处于主导地位,其含量高低很大程度决定着清香型白酒的质量及风格。并且在小曲原酒中,乙酸乙酯含量高的酒香味好,提高乙酸乙酯含量有利于提高原酒质量。而在小曲酒酿造过程中所产生的乙酸乙酯主要是由小曲中微生物代谢产物的生化反应生成的,酵母在其中扮演了重要角色。酵母在白酒酿造发酵过程中能够产生多种物质,主要有酯类、醇类、酸类等,此外还会有少量的烷烃类、胺类、芳香烃类、酮类、醛类等物质产生。这些物质的含量各异,从而构成了各酵母菌的不同发酵香气。产香酵母在酒的发酵酿制过程中的主要作用是产酯(在小曲酒或清香型白酒中主要是乙酸乙酯),对酒体具有增酯、提香的作用,故又称其为生香酵母[2]。产香酵母可以利用有机酸、糖、醛以及盐类物质为原料,在酯酶的参与下合成众多酯类物质,以此来增香,去除酒中的杂味,从而使酒体协调,改善小曲酒的品质[3-5]。目前,产酯酵母广泛应用于小曲酒生产中。我国作为白酒生产大国,具有优质的天然曲种资源,但国内土著生香酵母曲工业化开发的并不是很多,本实验旨在从酿酒小曲中分离得到优良产酯酵母,并对其产酯条件进行优化研究,为我国土著产酯酵母在白酒工业化生产的开发利用奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源
酿酒小曲由成都蜀之源酒业有限公司、泸州自然香实业有限公司和四川省泸州市美酒源酒业有限公司提供。
1.1.2 主要实验试剂
葡萄糖、蛋白胨、KH2PO4、MgSO4·7H2O、酵母浸膏、H2SO4、HCl、NaCl等常规试剂均购自成都市科龙化工试剂厂;真菌DNA提取试剂盒、蛋白酶K、溶菌酶、胶回收试剂盒等购自上海生工成都分公司。
1.1.3 筛选培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,自然pH。
查氏培养基:蔗糖30 g,NaNO33g,7H2O·MgSO40.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,K2HPO41 g,琼脂15 g,蒸馏水1 000 mL,pH 6.0~6.5。
孟加拉红培养基:蛋白胨5 g,葡萄糖10 g, KH2PO41 g,琼脂20 g, MgSO4·7H2O 0.5 g, 1 g/L孟加拉红溶液3.3 mL,蒸馏水1 000 mL。
1.1.4 活化培养基
液体YEPD培养基:葡萄糖2 g, 酵母提取物1 g, 蛋白胨2 g,蒸馏水100 mL。
1.1.5 产酯培养基
葡萄糖8 g,酵母提取物1 g,蛋白胨2 g,蒸馏水100 mL。
1.2 主要仪器与设备
立式压力蒸汽灭菌锅DHP-902,上海中安医疗器械厂;电热恒温培养箱LDX-75KB,北京市六一仪器厂;真空干燥箱 SWJ-2F,上海一恒科技有限公司;恒温水浴锅 TB-214,金坛市医疗仪器厂;旋转蒸发仪RE-52AA,上海亚荣生化仪器厂;双定时电泳仪MLS-1,上海益恒实验仪器有限公司,旋涡震荡仪DY-8C,苏州净化设备有限公司;数显式酸度计AR-323,上海精宏实验设备有限公司;电子天平HH-S,北京赛多利斯仪器系统有限公司;HSS 86.50 型全自动顶空进样器,意大利 DANI公司;气相色谱质谱联用仪GCMS-QP2010 plus,日本岛津公司。
1.3 实验方法
1.3.1 菌株的初筛
取1 g样品小曲粉加入到装有10 mL无菌生理盐水的试管中,充分振荡摇匀,此时的稀释倍数为10-1倍;然后用移液枪从试管中移取1 mL菌悬液并加入9 mL无菌生理盐水,振荡摇匀,此时稀释倍数为10-2倍;逐级稀释可制得10-3、10-4、10-5倍的样品稀释液。取100 μL 10-4和10-5倍的稀释菌液均匀涂布于PDA、查氏培养基、孟加拉红培养基上,28 ℃培养48 h后,挑菌在PDA培养基纯化。
1.3.2 产酯菌株筛选
用接种环将纯化后得到的菌株接种一环到液体活化培养基中,经28 ℃活化培养24 h,随后取液体培养基10 mL接种到100 mL产酯培养基中,28 ℃恒温培养4 d。然后向发酵液再加入20 mL无水乙醇以及40 mL蒸馏水后进行蒸馏(可加入几滴植物油做消泡剂),收集100 mL蒸馏液,再对蒸馏液进行总酯与乙酸乙酯的测定。
1.3.3 总酯的测定
总酯测定方法为皂化回流法[6-8]。
1.3.4 蒸馏液的GC-MS分析条件。
蒸馏液中的乙酸乙酯含量分析采用GCMS-QP2010 plus进行分析。分析条件为:色谱柱为Rtx-5MS柱(30 m×0.25 mm×0.25 um);程序升温为35 ℃保持2 min,以10 ℃/min至 250 ℃,保持5 min。进样口温度250 ℃,检测器温度250 ℃,无分流进样。载气,高纯He(99.99%);载气流速 1.0 mL/min。电离方式EI;电子能量70 eV;离子源温度230 ℃,全扫描模式,质量扫描范围为40~600。
1.3.5 高产酯菌株的分子鉴定与形态及生理生化观察
优质产酯菌株经溶菌酶破壁后使用真菌DNA提取试剂盒提取DNA。以ITS4和ITS5为引物进行PCR扩增,50 μL PCR反应体系为:10×PCR buffer 5 μL; dNTP4 μL;引物ITS4 1 μL;引物ITS5 1 μL;DNA模板1 μL;TaqDNA聚合酶0.5 μL;ddH2O 37.5 μL。PCR条件为:94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min,30次循环;修复延伸72 ℃ 5min。PCR产物经1% 琼脂糖凝胶电泳后,回收纯化产物送往上海生工成都分公司测序,将测序序列在NCBI数据库中进行同源性检索,使用MEGA6.0构建系统发育树[9-10]。
初步生理生化实验鉴定参照《酵母菌的特征与鉴定手册》[11]对产酯菌株进行测试,主要包括糖发酵实验、碳源同化实验、类淀粉物质生成实验、尿素水解实验等。
1.3.6 产酯条件的研究
1.3.6.1 单因素试验对产酯量的影响
将优质产酯菌株按不同条件分别接种于产酯培养基中,静置培养,以产酯量和乙酸乙酯生成量为考察指标,研究温度、pH、酒精添加量以及发酵时间对菌株生长情况的影响[12],以确定各单因素最佳条件范围。用0.1 mol/L盐酸来调节pH值,用无水乙醇调节酒精含量,实验方法参照1.3.2,对馏液进行总酯和乙酸乙酯的测定。
1.3.6.2 正交实验
以4因素4水平做正交实验[13-14],以此探究温度、pH、酒精添加量以及发酵时间对菌株产酯量的影响,产酯条件水平表如表1所示。
1.3.7 数据处理
数据分析采用spss19.0软件Duncan方差齐性检验进行显著性差异分析[15-16]。
2 结果与分析
2.1 优质产酯酵母的筛选
从样品小曲中经分离培养基初步分离纯化得到了7株疑似酵母菌的菌株,再将筛选得到的这7株菌株采用产酯培养基复筛,其产酯情况结果见表2。表2表明,在初筛的7株酵母菌中,产酯情况差异较大,总酯含量最高的为菌株Y5,总酯达2.684 g/L,乙酸乙酯含量为2.481 g/L,占总酯量的92.4%,显著高于其他菌株。总酯含量最低的为Y3菌株,总酯0.014 g/L,其乙酸乙酯含量并未检出。为此本实验选用Y5菌株作为产酯优质菌株以继续进行后续实验的研究。

表2 筛选菌株产酯情况Table 2 Screening strains of producing strains
注:“-”表示乙酸乙酯含量极低或未检出其含量。
2.2 Y5菌株的鉴定
2.2.1 Y5菌株的形态学观察及生理生化试验
观察Y5的菌落形态:如图1所示,Y5菌株的菌落呈白色,菌落直径1~2 mm,圆形凸起、表面光滑,边缘整齐,大小均匀,有水果香;液态培养时表面有菌膜,液体澄清。参照《酵母菌的特征与鉴定手册》,进一步得出其生理生化试验结果:如表3所示,Y5菌株可利用葡萄糖、蔗糖、麦芽糖、海藻糖、D-甘露醇和柠檬酸,不能利用乳糖、D-木糖和L-鼠李糖,可利用硝酸盐作为氮源,不能产生类淀粉物质,可分解利用尿素。

图1 Y5菌株划线平板图Fig.1 Y5 strain crossed plate chart

生理生化试验项目结果葡萄糖+乳糖-蔗糖+D⁃木糖-L⁃鼠李糖-海藻糖+麦芽糖+D⁃甘露醇+柠檬酸+硝酸盐利用+类淀粉物质生成-尿素水解试验+
注:“+”代表能够利用;“-”代表不能利用。
2.2.2 菌株Y5的分子鉴定
在生理生化试验基础上,进一步对Y5酵母的DNA产物进行了PCR扩增,PCR扩增结果如图2所示,所扩增得到的片段的电泳条带亮度大,无拖尾,通过与D2000 Maker的对比,可以知道扩增得到的分子大小在600 bp左右,与预测扩增片段的长度一致。

图2 PCR产物的琼脂凝胶电泳图Fig.2 Agarose gel electrophoresis of PCR products
将PCR扩增产物送往上海生工成都分公司进行测序,再将其序列在NCBI(https://www.ncbi.nlm.nih.gov)上进行Blast比对,比对结果表明Y5菌株与公布的WickerhamomycesanomalusCBS250(登录号: KY105862)同源性达到99.7%,利用MEGA6.0软件构建系统发育树,如图3所示。结合Y5生理生化实验结果与Y5系统发育树,可确定Y5为异常威克汉姆酵母。

图3 菌株Y5系统发育树Fig.3 Strain Y5 phylogenetic tree
2.3 Y5产酯条件单因素试验
2.3.1 温度对产酯量的影响
发酵温度对总酯产量与乙酸乙酯产量的影响见图4,总酯含量与乙酸乙酯含量随着温度的升高,呈现先升后降的趋势。温度的高低直接影响酵母菌体内的酯化酶活性,进而影响酵母菌产酯能力,且温度的升高会加速酯的水解及挥发。综和总酯含量和乙酸乙酯的生成量,发酵温度为30 ℃时二者含量达到最高(总酯产量为3.197 g/L,乙酸乙酯含量为2.941 g/L),酯化酶的活性达到最大,因此选择发酵温度为30 ℃。

图4 温度对产酯量的影响Fig.4 Effect of temperature on the amount of ester produced
2.3.2 pH对产酯量的影响
如图5所示,培养基的pH对酵母菌酯的生成量影响较大,随着pH的增加,总酯产量和乙酸乙酯生成量显著提高,但是pH过大会使得二者含量下降。综合看来培养基的pH值在pH 4~6的范围内总酯和乙酸乙酯的生成量较高,当pH值偏高或偏低时,其生成乙酸乙酯的能力会有所下降,从而导致总酯的含量较低。其中,当培养基的初始pH值为pH 5时,总酯和乙酸乙酯的生成量达到峰值,总酯含量达到3.629 g/L,乙酸乙酯生成量为3.198 g/L。

图5 pH对产酯量的影响Fig.5 Effect of pH on the amount of ester produced
2.3.3 酒精含量对产酯量的影响
从图6可知,酵母菌Y5对乙醇有较好的适应性,在培养基中加入一定的乙醇对菌株产酯有一定的促进作用,但是过量的乙醇对酵母的产酯性能有一定的抑制作用。随着乙醇添加量的增加,总酯产量和乙酸乙酯产量都呈现先升后降的趋势,乙醇添加量为2%时产酯量达到最高,当乙醇添加量超过2%时,酯含量反而下降,不利于乙酸乙酯的生成。因此选择乙醇添加量为2%,此条件下总酯含量达到3.579 g/L,乙酸乙酯生成量为3.185 g/L。

图6 酒精含量对产酯量的影响Fig.6 Effect of alcohol content on the amount of ester produced
2.3.4 发酵时间对产酯量的影响
由发酵时间对产酯量的影响(图7)可知,菌株Y5在不同发酵时间内产酯量有差异,并且发酵时间对菌株产酯量的影响较大,随着发酵时间的增长,酵母的生长急剧上升,此时酵母的产酯代谢较为旺盛,其总酯含量和乙酸乙酯产量在第4天时达到峰值,产量分别为3.687 g/L和3.204 g/L。而后随着发酵时间的延长,产酯量呈现下降的趋势,在第5~6天下降趋势明显,可能原因是随着时间延长酵母代谢产生的酯类物质挥发。
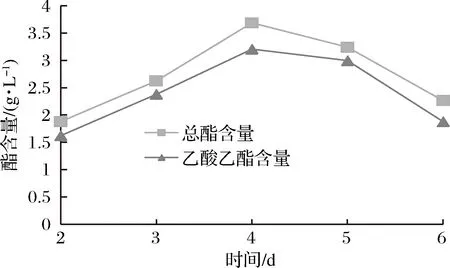
图7 发酵时间对产酯量的影响Fig.7 Effect of fermentation time on the amount of ester produced
2.4 正交实验结果与分析
在单因素实验的基础上,选取适当的因素范围设计正交表,考察Y5菌株的最适产酯条件,产酯条件结果与极差分析见表4,方差分析见表5。

表4 产酯条件正交实验结果Table 4 Production of orthogonal experiment results

表5 正交实验方差分析表Table 5 Analysis of orthogonal experimental variance
注:方差分析表的置信区间为95.0%,“*”代表显著。
如表4所示,根据极差分析,在A(温度)、B(pH值)、C(酒精含量)、D(发酵时间)4个影响因素中pH值对产酯量影响最大,其影响的顺序为pH值>发酵时间>酒精含量>温度。使用SPSS19.0软件对实验结果进行方差分析,如表5所示,pH值与发酵时间这两个因素对菌株产酯量的影响显著(Sig<0.05)。并且通过试验得出的最优组合为A3B2C3D2,即在温度30 ℃、pH 4、乙醇体积分数4%、发酵时间3d时菌株产酯量达到最大,通过后续实验测得Y5菌株在该条件下总酯产量为4.065 g/L,乙酸乙酯产量3.677 g/L;相比优化之前,其总酯含量显著提高51.5%,乙酸乙酯含量显著提高48.2%。
3 结论
从工业化酿酒小曲中分离筛选得到1株优质产酯酵母菌株Y5,经产酯培养基初筛其总酯达2.684 g/L,乙酸乙酯含量为2.481 g/L,经生理生化实验和分子鉴定,确定Y5菌株为异常威克汉姆酵母(Wickerhamomycesanomalus)。目前应用于白酒中的产酯酵母多属于汉逊酵母、产朊酵母属、假丝酵母属和球拟酵母属等[17],本实验的分离鉴定丰富了白酒中产酯酵母的菌种资源,为该种酵母在白酒生产利用提供了理论基础。
通过正交实验将菌株Y5的产酯条件进行优化。根据极差分析,在A(温度)、B(pH值)、C(酒精含量)、D(发酵时间)4个影响因素的顺序为pH值>发酵时间>酒精含量>温度,方差分析结果表明pH值与发酵时间对菌株产酯量的影响显著,试验得出的最优产酯条件为:在初始pH 4、乙醇体积分数4%的培养基中30 ℃恒温发酵3 d。在该条件下Y5菌株总酯产量为4.065 g/L,乙酸乙酯产量3.677 g/L;相比优化之前,其总酯含量显著提高51.5%,乙酸乙酯含量显著提高48.2%。根据严锦等[1]报道,从清香型小曲中分离出一株异常汉逊式酵母,其产乙酸乙酯和总酯能力分别为2.152 g/L和2.368 g/L;陈维新等[12]以腐烂菠萝为原料,筛选出一株马克斯克鲁维酵母,其乙酸乙酯的最高产量达3.13 g/L。综合看来,本实验筛选出的Y5菌株具有较强的产酯能力,可作为白酒酿造生产中重要的产酯菌种资源,为国内土著生香酵母曲工业化开发提供理论依据,具有较好的应用前景。关于该菌株在小曲酒或相关白酒中的具体应用还需作进一步研究。
[1] 严锦, 李锐利, 李文,等. 小曲中产酯酵母的分离鉴定及其在酿酒生产中的应用[J]. 酿酒科技, 2014(2):48-52.
[2] 王国良, 宋俊梅, 曲静然. 生香酵母及其应用[J]. 食品工业, 2004(3):16-17,29
[3] 王晓永. 酒曲中生香酵母分离鉴定及其产酯工艺优化研究[J]. 科技展望,2015,25(7):152.
[4] 陈九武, 霍炜, 桂华明. 酵母合成酯类风味物质发酵条件的优化[J]. 中国酿造,2000(1):25-26.
[5] 蒲春, 胡沂淮, 贾亚伟,等. 产酯酵母的筛选及其发酵特性研究[J]. 酿酒科技,2013(3):47-49.
[6] 吴国峰, 李国全, 马永强,等. 工业发酵分析[M]. 北京:化学工业出版社,2015:75-77.
[7] 邓毛程, 李静, 方俊鹏,等. 甘蔗汁发酵产酯的研究[J]. 中国酿造,2011(3):82-84.
[8] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T10345-2007白酒分析方法[S]. 北京: 中国标准出版社,2007.
[9] FIERER N, JACKSON JA,VILGALYS R, et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J]. Applied and Environmental Microbiology, 2005, 71(7): 4 117-4 120.
[10] GUO Xiu-lan, XIA Xin-jie, TANG Ren-yong, et al. Real-time PCR quantification of the predominant bacterial division in the distal gut of Meishan and Landrace pigs[J]. Anaerobe,2008,14(4): 224-228.
[11] 胡瑞青. 酵母菌的特征与鉴定手册[M]. 青岛:青岛海洋大学出版社,1991.
[12] 陈维新,李静,王瑶,等. 1株乙酸乙酯高产酵母的筛选及其特性研究[J]. 食品与发酵工业,2015,41(9):87-90.
[13] 徐丽萍. 泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J]. 中国酿造,2016, 35(2):74-78.
[14] 黄光建, 徐学锋, 郭梅君,等.豉香型白酒酒饼中高产乙酸乙酯酵母菌的分离鉴定及发酵性能研究[J]. 食品工业科技,2015,36(11):153-158.
[15] 王晓燕, 桑卫国. SPSS正交设计优化琼胶酶产生菌的发酵条件[J]. 宁波大学学报(理工版),2010,23(2):11-16.
[16] 刘娟娟, 汪康游, 金媛媛,等.SPSS方差分析在阿维菌素培养基优化中的应用[J]. 中国抗生素杂志,2015,40(4):251-255.
[17] 范广璞. 生香酵母的培养方法及在白酒生产中的应用[J]. 江苏食品与发酵,2008(1):23-25.
