耐碳青霉烯类阴沟肠杆菌的耐药机制及临床感染分析
2018-03-14张丽琴管海宁肖作淼刘聪肖九长邹淑慧
张丽琴,管海宁,肖作淼,刘聪,肖九长,邹淑慧
(赣州市人民医院检验科,江西 赣州 341000)
阴沟肠杆菌是一种常见的条件致病菌,可导致伤口、呼吸道、泌尿道的严重感染,且多为医院内感染[1]。随着治疗多重耐药阴沟肠杆菌的碳青霉烯类抗生素在临床的广泛使用甚至滥用,导致碳青霉烯类耐药阴沟肠杆菌的检出逐年增多,给临床的感控和治疗带来了重重困难。阴沟肠杆菌对碳青霉烯类耐药主要是产生碳青霉烯酶[2],但多种耐药机制可协同作用,造成阴沟肠杆菌耐药水平高及多重耐药的现象[3,4]。本研究对收集的碳青霉烯类耐药阴沟肠杆菌菌株采用改良Hodge试验进行碳青霉烯酶表型确证,利用PCR扩增技术检测目标菌株的碳青霉烯酶基因型和主动外排系统的AcrAB-TolC基因型,分析相关临床感染资料,为临床合理用药及院感防控提供依据。
1 材料与方法
1.1 菌株来源 2012年1月至2015年12月本院临床标本中分离的经Vitek 2 compact鉴定药敏的碳青霉烯类耐药阴沟肠杆菌76株,剔除同一患者的重复菌株。质控菌株:大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853。
1.2 主要仪器及试剂 法国梅里埃公司生产的Vitek 2 compact全自动微生物鉴定药敏分析系统及配套的GN、AST-GN16卡;PCR扩增仪为德国艾本德公司产品;琼脂糖凝胶电泳仪为美国博乐公司产品;凝胶成像系统为法国VILBER公司产品。细菌基因组DNA提取试剂盒购自北京索莱宝科 技 有 限 公 司 ;Taq DNA Polymerase cat.No.:B500010 (内 含:10×buffer、Mg2+、Taq DNA Polymerase)和dNTP购自上海生工生物工程有限公司。
1.3 方法
1.3.1 改良Hodge试验 按照美国临床实验室标准化协会 (CLSI)M100-S24进行[5],将大肠埃希菌ATCC 25922调制成0.5麦氏浊度后再用生理盐水稀释10倍涂布于MH平板,中间贴厄他培南(10μg)纸片,用接种环挑取受试菌自纸片外缘向平板边缘划线接种,35℃孵育过夜,厄他培南抑菌圈处出现矢状生长者为待检菌产碳青霉烯酶。
1.3.2 PCR检测目标基因 阴沟肠杆菌DNA的提取严格按照试剂盒说明书进行。所有引物由上海生工生物工程公司合成,详见表1。PCR反应体系为 20μl:10×buffer 2.0μl,Mg2+(25mM)1.2μl,dNTP(2.5mM)1.6μl,Taq DNA Polymerase(5U/μl)0.5μl,上、下游引物(10μM)各 1.0μl,DNA 模板 2.0μl,ddH2O 10.7μl。 反应条件:acrA 基因:95℃,5min→(95℃,30s+60℃ 30s+72℃,30s)×30 循 环→72℃,10min;acrB 基 因 :95℃ ,5min→(95℃,30s+60℃ ,30s+72℃,30s)×30 循环→72℃,10min;tolC 基因:95℃,5min→(95℃,30s+60℃,30s+72℃,30s)×30 循环→72℃,10min。IMP和KPC基因引物和反应条件参照文献进行[6,7]。反应结束后取5μl PCR扩增产物经含Goldview I型核酸染色剂的2%琼脂糖凝胶电泳40min,使用凝胶成像系统观察拍照。随机选取部分PCR阳性产物送上海生工测序,在NCBI基因库中比对证实。

表1 目标基因的引物序列和产物长度
2 结果
2.1 菌株来源和药敏结果 76株碳青霉烯类耐药阴沟肠杆菌分离自ICU16株(21.1%),神经外科、烧伤科和急诊科各8株(10.5%),脊柱科和泌尿外科各 6 株(7.9%),其它科室 24 株(31.6%);标本来源为痰26株 (34.2%),伤口分泌物和尿各18株(23.7%),其它标本 14 株(18.4%);药敏结果显示,未出现对替加环素耐药菌株,仅阿米卡星的耐药率低于30%,其余常用抗菌药物均呈现高度耐药现象,详见表2。
2.2 改良Hodge试验结果 76株目标菌株经改良Hodge试验检测10株为阴性,66株碳青霉烯酶表型阳性,阳性率 86.8%。
2.3 目标菌株的基因检测结果 76株目标菌株中,碳青霉烯酶IMP基因型的检出率为63.2%,KPC型检出率为7.9%;AcrAB-TolC外排泵acrA基因的检出率为78.9%,acrB基因的检出率为50.0%,tolC基因的检出率为100%,电泳图见图1。
2.4 碳青霉烯耐药阴沟肠杆菌临床感染资料分析76例碳青霉烯类耐药阴沟肠杆菌感染病例中,新生儿2例,其余均为成人,且以>60岁的老年人感染为主,占 60.5%(46/76);52 例具有一项或多项的基础疾病(如慢性肾功能不全、糖尿病、恶性肿瘤、心功能不全、肝硬化、慢性阻塞性肺气肿、脑血管病变、免疫性疾病等),占 68.4%(52/76);留置导尿管及气管插管等侵袭性操作所占的比例也较高,分别占 76.3%(58/76)和 68.4%(52/76);特别在抗菌药物使用方面,76例感染者均在检出耐药菌之前使用过抗菌药物,其中使用3种及3种以上抗菌药物的有 48例,占 63.2%,见表 3。
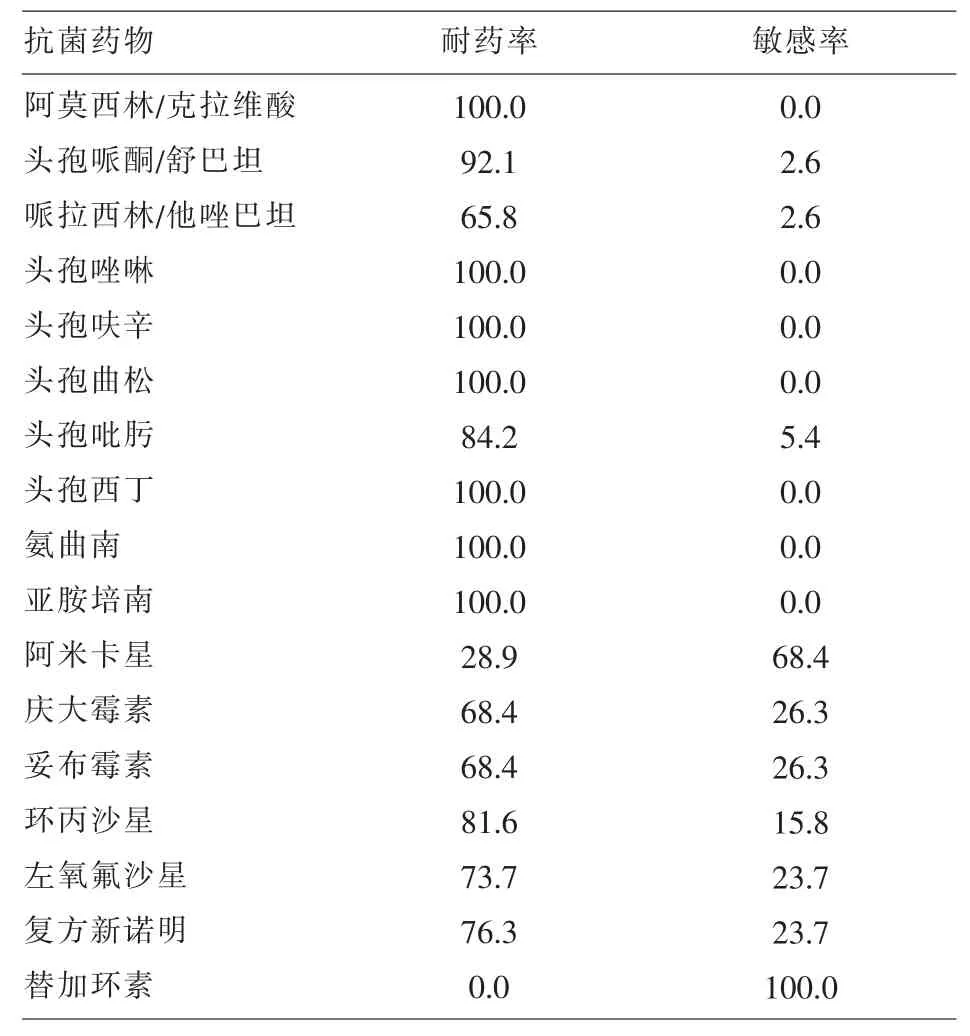
表2 76株碳青霉烯类耐药阴沟肠杆菌对常用抗菌药物的药敏结果(%)
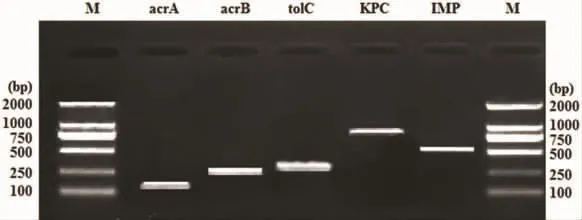
图1 五种基因的PCR扩增结果电泳图
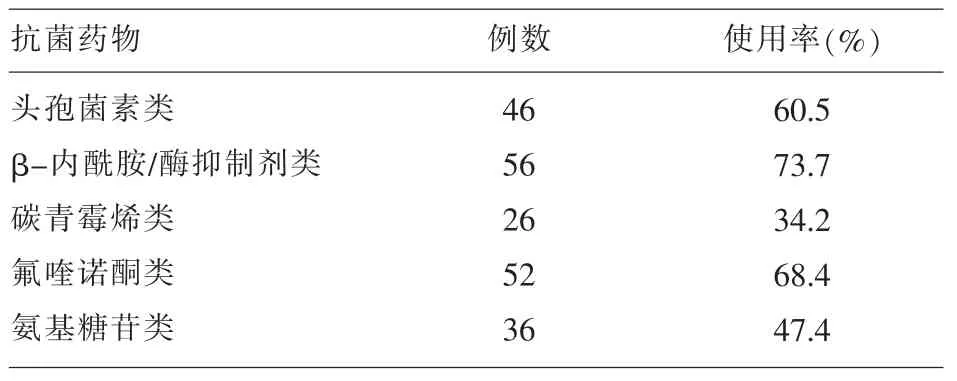
表3 76例患者抗菌药物使用情况
3 讨论
近年来,随着抗菌药物的广泛使用,特别是针对重症感染的碳青霉烯类药物使用的增加,使得碳青霉烯类耐药阴沟肠杆菌有逐年上升倾向。本次研究的菌株主要分布在ICU、神经外科、烧伤科和急诊科,可能与这些科室的住院患者病情危重,且多经历过创伤性手术及术后均有侵袭性操作有关。另外,药敏结果提示替加环素对碳青霉烯类耐药阴沟肠杆菌的敏感性高,可作为治疗该菌的首选药物,且它的抗菌作用不受产酶影响[8]。
KPC和IMP型碳青霉烯酶分属于Ambler分类中的A类和B类β-内酰胺酶。CLSI推荐改良Hodge试验作为筛选肠杆菌科细菌KPC型碳青霉烯酶的确证试验,但庞峰等证实改良Hodge试验检测IMP型碳青霉烯酶同样具有较高的灵敏度[9]。测序结果显示76株目标菌株扩增出IMP和KPC型碳青霉烯酶的总比例达71.1%,说明江西赣州地区碳青霉烯酶的流行不在少数,且是以IMP型为主,与林伯熹等[10]报道一致。阴沟肠杆菌耐药机制复杂,产碳青霉烯酶是阴沟肠杆菌对碳青酶类抗菌药物耐药的主要机制,但在细菌多重耐药性产生过程中主动外排系统也发挥了重要作用[11]。AcrAB-TolC外排系统隶属于主动外排系统的耐药结节分化超家族,由acrA,acrB以及tolC三部分组成,它广泛存在于大肠埃希菌、阴沟肠杆菌等肠杆菌科细菌中,可主动将进入菌体内的抗生素泵出,使药物浓度下降难以发挥抗菌作用而出现耐药[12,13]。本实验中acrB基因的检出率稍低,但tolC基因的检出率高达100%,说明AcrAB-TolC外排系统基因在阴沟肠杆菌中普遍存在,据胡小行等报道AcrAB-TolC外排系统对耐药阴沟肠杆菌株的影响大于敏感株[14],它的高表达可表现对β内酰胺类、喹诺酮类、甲氧苄啶等多种常用抗菌药物耐药。当然,除上述两种耐药机制以外,也可能存在其它耐药机制(ESBLs的高表达、产AmpC酶合并孔蛋白的缺失等)的协同作用,造成了阴沟肠杆菌高水平耐药现象。
临床资料分析显示具有基础疾病的老年患者、留置导尿管、气管插管的感染病例占60%以上,这些都是碳青霉烯类耐药阴沟肠杆菌感染的高风险因素,特别是长期、大量使用抗菌药物是最独立、最重要的高危因素。除碳青霉烯类外,β-内酰胺/酶抑制剂类、氟喹诺酮类、头孢菌素类作为临床医生常选用的广谱抗菌药物同样与碳青霉烯酶的产生具有相关性[15,16]。如何主动筛查产酶菌株,合理有效的选用抗菌药物,延缓耐药菌的出现,做好耐药菌的控制,所涉及的每个环节层层相扣,息息相关。微生物人员应主动发现及时上报产酶株;临床医务人员应尽量减少碳青霉烯类抗生素的暴露和侵入性的操作,加强抗菌药物的优化管理,做好隔离防护,控制交叉传播;感控人员实行全院立体式监管,深入临床进行耐药菌的专题培训,提高医务人员的认识性和积极性,对耐药菌的控制将取得良好的效果。
[1]张丽琴,肖九长,吴天恩.伤口分泌物分离阴沟肠杆菌的耐药性分析[J].实验与检验医学,2014,32(3):289-290.
[2]崔兰英,常东,路娟,等.亚胺培南不敏感的阴沟肠杆菌碳青霉烯酶基因检测[J].微生物学杂志,2013,33(5):99-101.
[3]陈晓玲.阴沟肠杆菌耐药机制的研究进展[J].中国抗感染化疗杂志,2005,5(5):310-313.
[4]Kallman O,Giske CG,Samuelsen,et al.Interplay of efflux,impermeability,and AmpC activity comtributes to cefuroxime resistance in clinical,non-ESBL-producing isolates of Escherichia coli[J].Microb Drug Resist,2009,15(2):91-95.
[5]Clinical Laboratory Standards Institute.MS24-M100 Performance standards for antimicrobial susceptibility testing[S].Wayne,PA,USA:CLSI,2016.
[6]XIONG J,HYNES MF,YE H,et al.bla(IMP-9)and its association with large plasmids carried by Pseudomonas aeruginosa isolates from the People’s Republic of China [J].Antimicrob Agents Chemother,2006,50(1):355-358.
[7]SIMONA B,POOJA T,USHA K,et al.Carbapenemase producing Klebsiella pneumoniae in Brooklyn,NY:molecular epidemiology and in vitro activity of polymyxin B and other agents[J].J Antimicrob Chemother,2005,56(1):128-132.
[8]刘立荣,李向阳,瞿玲娜,等.替加环素对不同耐药基因型耐碳青霉烯类肠杆菌科细菌的敏感性研究 [J].检验医学,2016,31(5):383-386.
[9]庞峰,李艳华,贾秀芹,等.改良Hodge试验检测肠杆菌科IMP型碳青霉烯酶的性能评价 [J].中国实验诊断学,2013,17(11):1981-1984.
[10]林伯熹,李彬,刘秀琴,等.碳青霉烯类耐药阴沟肠杆菌耐药机制研究[J].中国感染与化疗杂志,2016,16(2):194-199.
[11]Swick MC,Morgan-Linnell SK,Carlson KM,et al.Expression of multidrug efflux pump genes AcrAB-TolC,mdfA,and norE in Escherichia coli clinical isolates as a function of fluoroquinolone and multidrug resistance[J].Antimicrob Agents Chemother,2011,55(2):921-924.
[12]Hobbsa EC,Yin X,Paula BJ,et al.Conserved small protein associates with the multidrug efflux pump AcrB and differentially affects antibiotic resistance[J].Proc Natl Acad Sci USA,2012,109(41):16696-16701.
[13]Yu L,Lu W,Ye C,et al.Role of a conserved residue R780 in Escherichia colimultidrug transporterAcrB [J].Biochemistry,2013,52(39):6790-6796.
[14]胡小行,李国明,刘军.主动外排系统与阴沟肠杆菌多重耐药关系的研究[J].国际检验医学杂志,2011,32(1):18-20.
[15]赵岐刚,贾秀芹,庞峰,等.阴沟肠杆菌产碳青霉烯酶的基因型与临床感染的特征分析[J].中华医学杂志,2015,95(40):3264-3268.
[16]Livermore DM,Warner M,Mushtaq S,et al.What remain against carbapenem-resistant Enterobacteriaceae?Evaluation of chloramphenicol,ciprofloxacin,colistin,fosfomycin,minocycline,nitrofurantoin,temocillin and tigecycline [J].Int J Antimicrob Agents,2011,37(5):415-419.
