寨卡病毒E蛋白及第三结构域的原核表达和多克隆抗体制备
2018-03-13,,,,,,,,,
,,,,, ,,,,
寨卡病毒(Zika Virus,ZIKV)是一种可以通过伊蚊传播给人类的单股正链RNA病毒[1],属黄病毒科(Flaviviridae)、黄病毒属(Flavivirus),分为非洲型和亚洲型两个亚型[2],主要传播媒介是伊蚊,存在垂直传播、血液传播、尿液传播、飞沫传播、性传播等方式[2]。ZIKV首先于1947年从乌干达寨卡森林中的恒河猴身上分离出来[3],2007年密克罗尼西亚的雅浦岛和2013年法国的波利尼西亚出现ZIKV大规模流行[4]。2015年ZIKV疫情在巴西进一步暴发,造成3万多人感染,迅速蔓延至包括中国在内的诸多国家,并有证据表明ZIKV感染与胎儿小头症[5]和严重的神经系统并发症(如吉兰巴雷综合征)有关[6],已成为全球人类健康的潜在威胁。
ZIKV基因组全长约10.7 kb,含一条单一开放读码框(ORF),病毒蛋白由一个单一的多蛋白前体经宿主蛋白酶和病毒蛋白酶剪切而成[7],包括3个结构蛋白(C、prM/M、E)和7个非结构(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)蛋白[8]。E蛋白相对分子质量约55 kD,编码E蛋白的基因位于基因组5′端,由1 515个碱基组成[9]。E蛋白是病毒主要的结构蛋白和包膜糖蛋白,与M蛋白共同构成病毒粒子表面结构[10]。当ZIKV入侵宿主细胞时,E蛋白与细胞表面的受体结合诱导病毒粒子包膜与细胞膜融合,通过内吞作用使核衣壳进入细胞质[11]。晶体结构的研究表明,寨卡病毒的E蛋白与其他黄病毒类似[12],分为3个结构域:EDⅠ,EDⅡ和EDⅢ。EDⅠ处于中心区域,呈β桶状结构,与病毒的致病性相关。EDⅡ呈指状结构,可能参与病毒与宿主细胞的融合过程。EDⅢ为IgG免疫球蛋白样结构,包含多个中和性抗原表位,可以结合宿主细胞表面受体引起病毒内吞现象[13]。本研究拟利用ZIKV病毒株克隆表达重组E蛋白和EDⅢ,制备抗E蛋白和EDⅢ的多克隆抗体,为下一步单克隆抗体的制备和快速检测胶体金试纸条的研制奠定基础。
1 材料与方法
1.1病毒株、载体、细胞、主要试剂和实验动物 寨卡亚洲型病毒株ZIKV_SMGC-1(GenBank登录号:KX266255.1)由武汉病毒所惠赠;Vero-E6细胞、蛋白原核表达载体pET28a(Kana+,His-tag)为本实验室保存;E.coliDH5α和E.coliBL21(DE3)感受态细胞购自TIANGEN公司;Ni-NTA亲和层析树脂购自GenScrip公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司;HRP标记山羊抗鼠IgG购自Bioss公司;TMB显色液购自Byotime公司;DAB显色液购自Thermo公司。6周龄SPF级BALB/c雌鼠购自斯莱克实验动物有限公司。
1.2寨卡病毒的增殖培养及RT-qPCR验证 应用Vero-E6细胞培养ZIKV_SMGC-1病毒。取病毒冻存液100 μL加10 μL双抗,4 ℃放置1 h除菌后接种于生长至70%的单层Vero-E6细胞培养瓶中,置于37 ℃、5%CO2培养箱,每隔15~30 min轻摇几次以促进吸附,1h后弃去上清,加入胎牛血清含量为1%的DMEM维持液,置于37 ℃培养箱,24 h后显微镜观察细胞致病变效应(CPE)。每天观察一次,如果培养2~3周没有CPE出现,则盲传1代继续观察,直至盲传3代后-40 ℃保存,再作进一步鉴定。出现CPE后收集细胞培养液,用试剂盒提取总RNA,采用逆转录实时荧光定量PCR(RT-qPCR)方法检测病毒核酸。
1.3E蛋白的生物信息学分析和截短表达质粒构建 从NCBI网站获取ZIKV_SMGC-1基因组序列和E蛋白氨基酸序列,并用BLAST进行比对,选取相似性较高的其他几个病毒的E蛋白氨基酸序列,采用Clustalx和MEGA4软件进行同源性分析和系统进化树构建。采用DNAstar Protean、ABCpred、IEDB-AR等软件预测E蛋白抗原表位,使用TMHMM、DAS、TMpred、CCTOP等软件预测E蛋白跨膜域区域。对预测结果进行综合分析,去除跨膜区域后拼合成新的氨基酸序列,SWISS-MODEL对截短前后的E蛋白进行结构分析,并将去除跨膜域后的氨基酸序列送上海生工公司进行密码子优化,连接到原核表达载体pET32a(Amp+,His-tag)上(酶切位点为BamHⅠ和XhoⅠ),通过全基因合成的方法得到重组表达质粒,并将其命名为pET32a/E。
1.4EDⅢ基因扩增和表达质粒构建 根据ZIKV_SMGC-1基因组中EDⅢ基因的序列,设计引物EDⅢ-F:5′-CCGGAATTCGCGTTCACATTCACCAAG-3′(下划线处为EcoRⅠ酶切位点)和EDⅢ-R:5′-CCGCTCGAGTTAACTCCTGTGCCAGTGGTGG-3′(下划线处为XhoⅠ酶切位点)。以病毒cDNA为模板,PCR扩增目的片段,EcoRⅠ和XhoⅠ同步双酶切纯化后的扩增产物和pET28a载体,高效连接酶对纯化后的酶切产物进行连接后转化E.coliDH5α感受态,挑取PCR验证为阳性的转化子于LB液体培养基中并提取质粒,双酶切鉴定后送上海生工测序,将验证正确的质粒命名为pET28a/EDⅢ。
1.5E和EDⅢ蛋白的原核表达及纯化 将pET32a/E和pET28a/EDⅢ分别转化E.coliBL21(DE3)感受态,挑取阳性转化子于LB液体培养基中活化,并按1∶50接种至500 mL LB培养基中,以不同浓度IPTG、不同诱导时间和温度进行诱导,摸索最佳诱导条件。诱导后离心收菌并超声破碎,收集上清,沉淀用8 mol/L尿素溶液重悬,用12%SDS-PAGE分析蛋白溶解性,考马斯亮蓝染色。用镍柱亲和层析法对收集的蛋白进行纯化,采用咪唑溶液进行梯度洗脱,分别收集流穿液和洗脱液,12%SDS-PAGE电泳分析蛋白纯化情况。如果是包涵体形式表达的蛋白则在纯化后通过透析复性,并用超滤管超滤浓缩。
1.6动物免疫与抗血清制备 将纯化的E蛋白和EDⅢ分别与等体积佐剂混合乳化,对6周龄BALB/c雌鼠进行皮下多点注射免疫,每只小鼠免疫的蛋白量约100 μg,每种抗原免疫4只小鼠。第1次免疫采用弗氏完全佐剂乳化,之后改用弗氏不完全佐剂,剂量不变,每2周免疫1次,共4次。末次免疫7 d后取尾血测效价,效价达标后取同剂量蛋白进行腹腔追加免疫。追加免疫3 d后摘眼球取血,12 000 r/min,离心10 min分离获得血清即为多克隆抗体。
1.7多克隆抗体效价检测 采用间接ELISA方法检测抗体效价。以纯化的E和EDⅢ为抗原,分别用蛋白包被液稀释至0.01 mg/mL包被酶标板,3%BSA(PBST配置)封闭,用对应的多克隆抗体作为一抗,浓度从1∶200梯度稀释至1∶409 600,HRP标记羊抗鼠IgG(1∶5 000)作为二抗,PBST洗板。用TMB底物显色,2 mol/L H2SO4终止显色反应。使用酶标仪在λ=450 nm波长处读取吸光度值,以P/N值≥2.1为阳性(P为阳性血清OD值,N为阴性对照OD值)。
1.8多克隆抗体特异性检测 采用Western Blot方法检测抗体特异性。纯化的E蛋白和EDⅢ经SDS-PAGE电泳后电转移至PVDF膜,用5%脱脂奶粉(TBST配置)封闭,用对应的多克隆抗体(1∶5 000)作为一抗,HRP标记羊抗鼠IgG(1∶5 000)作为二抗,TBST洗膜。DAB显色并扫膜存图。取适量ZIKV_SMGC-1株全病毒裂解物高温灭活并浓缩,分别以上述制备的E和EDⅢ多克隆抗体为一抗,以同样方法进行Western Blot检测。
2 结 果
2.1病毒cDNA荧光定量PCR验证 病毒培养传代一次后即出现CPE,从细胞培养液中提取病毒总RNA,使用试剂盒进行RT-qPCR方法检测出寨卡病毒核酸,Ct值约为20(图1)。
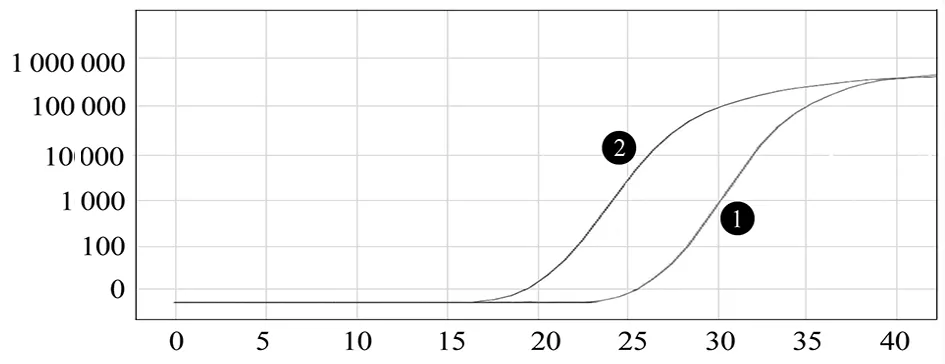
1: Positive control 2: Virus nucleic acid 图1 RT-qPCR检测细胞上清寨卡病毒Fig.1 RT-qPCR was used to detect cell supernatant Zika virus
2.2生物信息学分析 BLAST比对显示寨卡E蛋白与斯庞德温尼病毒(Spondweni virus,SPOV)相似性最高(75%),Clustalx对寨卡病毒、斯庞德温尼病毒、登革病毒、西尼罗河病毒和黄热病毒的E蛋白进行多序列比对,结果显示ZIKV E蛋白与SPOV E蛋白更加同源,使用MEGA软件绘制系统进化树如图2。通过综合分析几种不同的预测方法,筛选出E蛋白的多处潜在抗原表位(如表1下划线所示)和2个跨膜区域(位置为456~477和482~498,如表1阴影区域所示)。SWISS-MODEL建模结果表明去除跨膜域后的蛋白结构未发生改变(图3)。
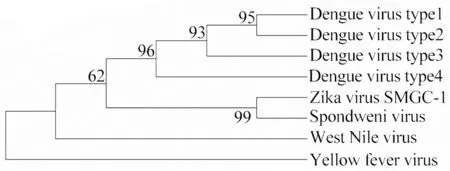
图2 E蛋白系统进化树Fig.2 System phylogenetic tree of E protein
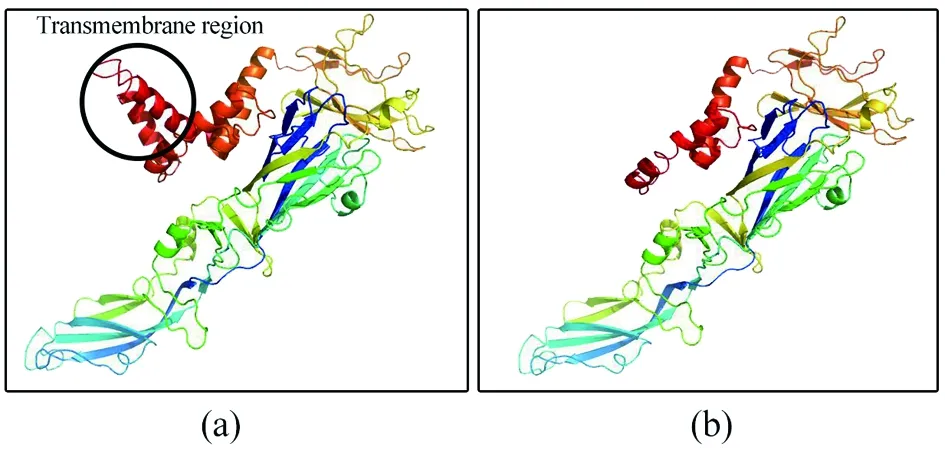
(a)Native E Protein (b)Recombinant E Protein图3 E蛋白截短前后结构比对Fig.3 Structure alignment of E protein before and after truncation
表1 E蛋白抗原表位和跨膜区域预测
Tab.1 Epitope and transmembrane region prediction

2.3表达载体的构建与双酶切鉴定 去除跨膜域后的E蛋白氨基酸长度为468 AA,基因长度为1 404 bp,合成的pET32a/E质粒经双酶切鉴定出现与目的片段大小相符的条带。EDⅢ插入pET28a载体后,提取重组质粒经双酶切鉴定,长度与目的片段大小(279 bp)一致(图4),测序比对显示PCR扩增得到EDⅢ的全长示序列完全匹配。证实成功构建两个重组表达质粒。
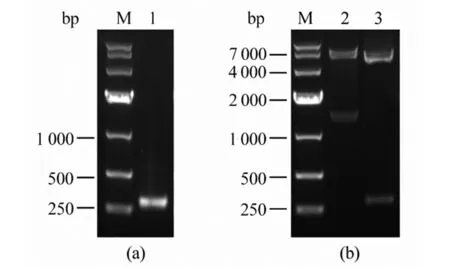
(a) PCR of EDⅢ M: DNA marker; 1: Gene EDⅢ (b) Enzyme digestion of recombinant plasmids M: DNA marker; 2: Restriction enzyme digestion of pET32a/E; 3: Restriction enzyme digestion of pET32a/EDⅢ图4 PCR及重组质粒双酶切鉴定 Fig.4 PCR and enzyme digestion of recombinant plasmids
2.4重组蛋白的表达与纯化 重组转化菌株经IPTG诱导后,SDS-PAGE显示分别在70 kD(图5)和12 kD(图6)处可见明显条带,与目的蛋白大小相符。经不同浓度IPTG(0.05 mmol/L、0.1 mmol/L、0.5 mmol/L)、不同时间(4 h、8 h、12 h)和不同温度(16 ℃、25 ℃、37 ℃)诱导并超声破碎,SDS-PAGE证实蛋白表达量差别不大,且均存在于沉淀中,说明蛋白以包涵体的形式存在。将包涵体用尿素溶解后经Ni+柱纯化并透析复性,获得了纯度较高的E和EDⅢ蛋白。
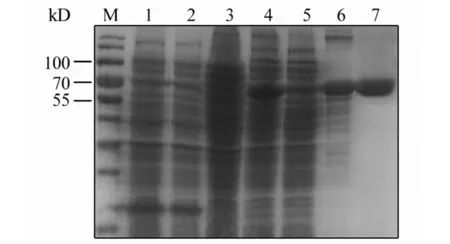
M: Protein marker; 1: Non-induced pET32a; 2: Induced pET32a; 3: Non-induced pET32a/E;4: Induced pET32a/E; 5: Supernatant; 6: Precipitate; 7: Purified E图5 SDS-PAGE检测重组E蛋白的表达和纯化Fig.5 Analysis of recombinant E protein by SDS-PAGE
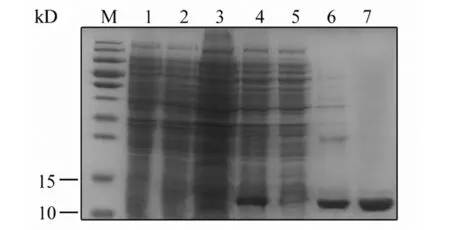
M: Protein marker; 1: Non-induced pET28a; 2: Induced pET28a; 3: Non-induced pET32a/EDⅢ;4: Induced pET28a/EDⅢ; 5: Supernatant; 6: Precipitate; 7: Purified EDⅢ图6 SDS-PAGE检测重组EDⅢ蛋白的表达和纯化Fig.6 Analysis of recombinant EDⅢ protein by SDS-PAGE
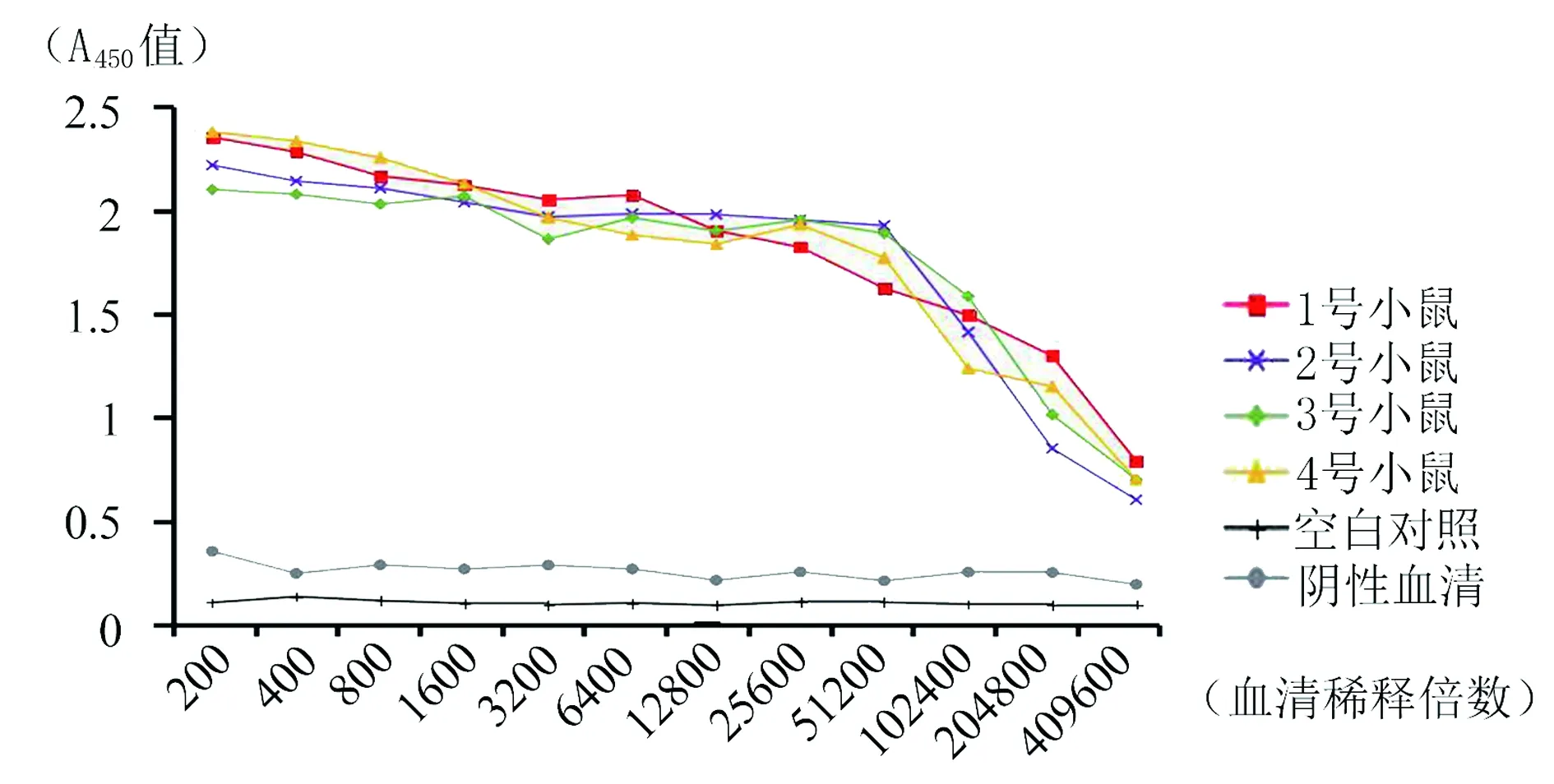
图7 抗E蛋白多克隆抗体效价的测定Fig.7 Titer of the E polyclonal antibody
2.5多克隆抗体的效价检测和特异性鉴定 间接ELISA法测定抗体效价,结果显示8只小鼠均产生了较强的免疫反应。其中抗E蛋白多抗效价均达到1∶409 600(图7),抗EDⅢ多抗有3只达到1∶409 600,效价最低的1只也达到1:204 800(图8)。Western Blot结果显示免疫后的抗血清与对应的重组蛋白反应后分别在70 kD和12 kD处出现特异性免疫反应条带(图9),与全病毒裂解物杂交后均在病毒天然E蛋白相应位置(55 kD) 出现条带(图10),表明抗体与重组蛋白和ZIKV天然E蛋白均可以发生特异性反应。
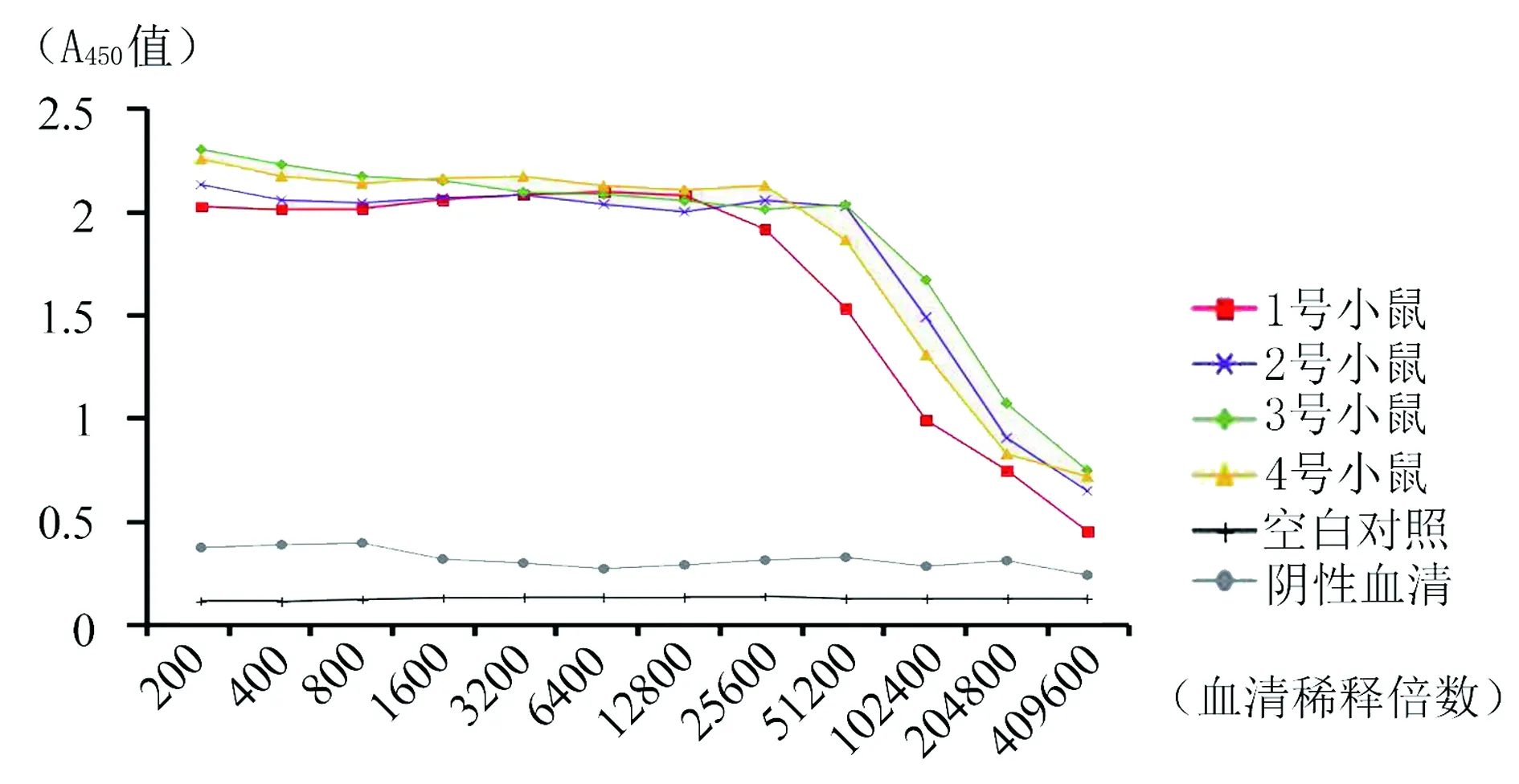
图8 抗EDⅢ蛋白多克隆抗体效价的测定Fig.8 The titer of the EDⅢ polyclonal antibody
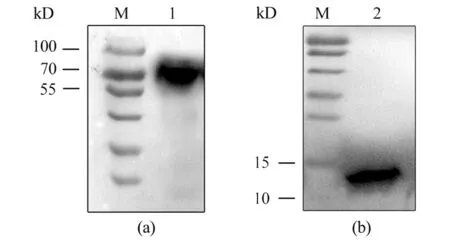
M:Western blot marker;1:Purified E;2:Purified EDⅢ图9 重组蛋白与多克隆抗体的免疫反应性Fig.9 Immunogenicity of recombinant protein with polyclonal antibodies
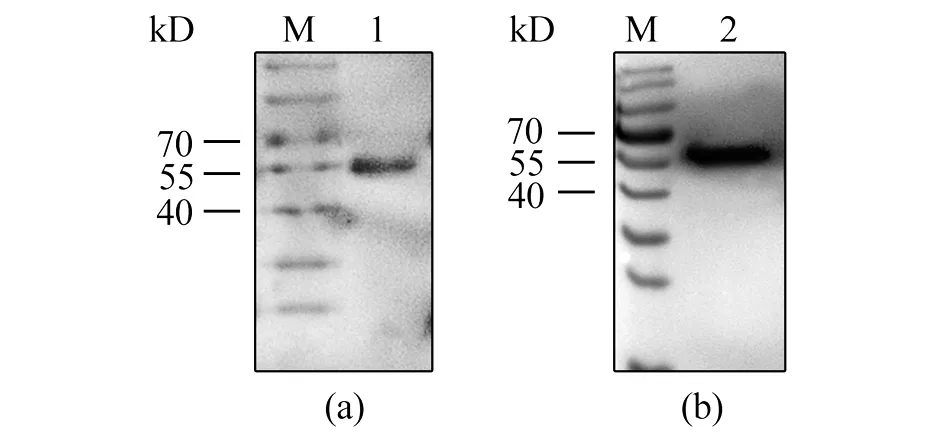
M: Western blot marker; 1: E polyclonal antibody; 2: EDⅢ polyclonal antibody图10 天然蛋白与多克隆抗体的免疫反应性Fig.10 Immunogenicity of native protein with polyclonal antibody
3 讨 论
在2015年以前,ZIKV曾经由于感染人数较少且成年患者症状不明显而没有引起足够重视。近年来其疫情多次暴发并迅速蔓延,且有研究证实其为吉兰巴雷综合征和新生儿小头症的病因之一,已经成为威胁全球人类健康的潜在因素,目前尚无针对性的预防性疫苗和治疗性药物,世界卫生组织(WHO)曾在2016年2月宣布将寨卡病毒列为全球公共卫生紧急关注事件[14]。因此对于ZIKV致病机制、免疫策略、治疗手段的研究已经是当务之急。生物信息学分析显示,ZIKV在黄病毒属中与斯庞德温尼病毒关系最为密切,与西尼罗河病毒、登革热病毒、黄热病毒等分离而单独成簇。这表明尽管ZIKV与其他黄病毒发病症状相似,但是可能已经发展出不同的疾病机制。
位于病毒表面的E蛋白是决定ZIKV毒力的关键蛋白,也是诱导机体产生免疫保护的重要蛋白,Dai等[15]解析了与黄病毒广泛中和抗体2A10G6复合的ZIKV E蛋白的结构,并证明该抗体可以体外中和和小鼠体内保护ZIKV感染。E蛋白结构的解析也证实了ZIKV与其他黄病毒之间潜在的差异性,最主要的是糖基化位点的改变,这种变化可能是决定抗体特异性的重要因素[16]。EDⅢ是病毒与宿主细胞吸附的关键区域,也是E蛋白最主要的抗原区域[17]。目前已经发现许多强毒黄病毒型特异性中和单克隆抗体(mAb)靶向EDⅢ[18]。Zhao等[19]通过使用ZIKV活病毒注射小鼠开发出针对ZIKV的6种单克隆抗体,其中有4种具有中和活性,可以中和不同型毒株的感染,这4种mAb中有3种靶向EDⅢ,还有1种靶向EDI和EDII之间的融合环区域。Yang等[20]描述了EDⅢ作为蛋白质亚基疫苗候选物的免疫原性,并且其抗体不会增强登革热病毒的感染。
尽管单克隆抗体具有特异性高、纯度高、交叉反应少等特点,但相比之下多克隆抗体具有制备过程简单、周期短、成本低等优势[21],而且可以识别任一抗原上的多个表位,有助于放大低表达水平的靶蛋白信号,从而提高检测的灵敏度[22]。本研究首先尝试表达E蛋白全长,但是表达量极低且难以纯化,为提高表达效率,采用了去除跨膜区域后截短表达的方法。生物信息学分析结果表明可能的抗原表位不在这两个跨膜域中,同源建模的结果也表明蛋白结构未发生改变,因此截短表达不影响该蛋白的抗原性。全长的EDⅢ则表达量较高且易于纯化。但是优化诱导条件之后的两种蛋白仍然以包涵体形式表达,可能是由于蛋白自身疏水性较高,因此采用尿素溶解和梯度透析的方式使蛋白复性,获得表达量和纯度均较高的重组E蛋白与EDⅢ。最终通过免疫BALB/c小鼠制备出高效价、高特异性的多克隆抗体。尽管本研究表达的两个蛋白都非完整的E蛋白,但由于两者均含有E蛋白的主要抗原表位,具有良好的免疫原性,均可以诱导小鼠产生高水平的免疫反应,所制备的多克隆抗体不仅可以特异性识别重组蛋白,而且能够从ZIKV全病毒裂解物中检测到完整的天然E蛋白。
本研究成功制备的多克隆抗体可用于E蛋白的结构和功能研究,也可用于ZIKV血清学诊断方法的研究,为深入探索E蛋白在ZIKV感染致病机理中的作用机制以及疫苗的开发奠定了研究基础。
[1] Arora N, Sadovsky Y, Dermody TS, et al. Microbial vertical transmission during human pregnancy[J]. Cell Host Microbe, 2017, 21(5): 561-567. DOI: 10.1016/j.chom.2017.04.007
[2] Faria NR, Quick J, Claro IM, et al. Establishment and cryptic transmission of Zika virus in Brazil and the Americas[J]. Nature, 2017, 546(7658): 406-410. DOI: 10.1038/nature22401
[3] Dick GW, Kitchen SF, Haddow AJ. Zika virus. I. Isolations and serological specificity[J]. Trans R Soc Trop Med Hyg, 1952, 46(5): 509-520.
[4] Worobey M. Molecular mapping of Zika spread[J]. Nature, 2017, 546(7658): 355-357. DOI: 10.1038/nature22495
[5] Faizan MI, Abdullah M, Ali S, et al. Zika virus-induced microcephaly and its possible molecular mechanism[J]. Intervirology, 2016, 59(3): 152-158. DOI: 10.1159/000452950
[6] Garcez PP, Loiola EC, Madeiro da Costa R, et al. Zika virus impairs growth in human neurospheres and brain organoids[J]. Science, 2016, 352(6287): 816-818.
[7] Cao-Lormeau VM, Blake A, Mons S, et al. Guillain-Barre Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study[J]. Lancet, 2016, 387(10027): 1531-1539. DOI: 10.1126/science.aaf6116
[8] Kostyuchenko VA, Lim EX, Zhang S, et al. Structure of the thermally stable Zika virus[J]. Nature, 2016, 533(7603): 425-428. DOI: 10.1038/nature17994
[9] Hou W, Cruz-Cosme R, Armstrong N, et al. Molecular cloning and characterization of the genes encoding the proteins of Zika virus[J]. Gene, 2017, pii: S0378-1119(17)30572-30573. DOI: 10.1016/j.gene.2017.07.049
[10] Dowd KA, Ko SY, Morabito KM, et al. Rapid development of a DNA vaccine for Zika virus[J]. Science, 2016, 354(6309): 237-240.
[11] Muthumani K, Griffin BD, Agarwal S, et al. In vivo protection against Zika infection and pathogenesis through passive antibody transfer and active immunisation with a prMEnv DNA vaccine[J]. Npj Vaccines, 2016, 1: 16021.
[12] Yang M, Dent M, Lai H, et al. Immunization of Zika virus envelope protein domainⅢ induces specific and neutralizing immune responses against Zika virus[J]. Vaccine, 2017, 35(33): 4287-4294. DOI: 10.1016/j.vaccine.2017.04.052
[13] Hasan SS, Miller A, Sapparapu G, et al. A human antibody against Zika virus crosslinks the E protein to prevent infection[J]. Nat Commun, 2017, 8: 14722. DOI: 10.1038/ncomms14722
[14] Armstrong N,Hou W,Tang Q. Biological and historical overview of Zika virus[J]. World J Virol,2017, 6(1): 1-8. DOI: 10.5501/wjv.v6.i1.1
[15] Mlakar J, Korva M, Tul N, et al. Zika virus associated with microcephaly[J]. N Engl J Med,2016,374(10): 951
[16] Grubaugh ND, Ladner JT, Kraemer MUG, et al. Genomic epidemiology reveals multiple introductions of Zika virus into the United States[J]. Nature, 2017, 546(7658): 401-405. DOI: 10.1038/nature22400
[17] Haddow AD,Woodall JP. Distinguishing between Zika and Spondweni viruses[J]. Bull World Health Organ,2016, 94(10): 711-711A.
[18] Dai L, Song J, Lu X, et al. Structures of the Zika virus envelope protein and its complex with a Flavivirus broadly protective antibody[J]. Cell Host Microbe, 2016, 19(5): 696-704.
[19] Wang A, Thurmond S, Islas L, et al. Zika virus genome biology and molecular pathogenesis[J]. Emerg Microbes Infect, 2017, 6(3): e13. DOI: 10.1038/emi. 2016.141
[20] Chávez JH, Silva JR, Amarilla AA, et al. Domain Ⅲ peptides from flavivirus envelope protein are useful antigens for serologic diagnosis and targets for immunization[J]. Biologicals, 2010, 38(6): 613-618. DOI: 10.1016/j.biologicals.2010.07.004
[21] Beltramello M, Williams KL, Simmons CP, et al. The human immune response to Dengue virus is dominated by highly cross-reactive antibodies endowed with neutralizing and enhancing activity[J]. Cell Host Microbe, 8: 271-283. DOI: 10.1016/j.chom.2010.08.007
[22] Zhao H, Fernandez E, Dowd KA, et al. Structural basis of Zika virus-specific antibody protection[J]. Cell, 2016, 166(4): 1016-1027. DOI: 10.1016/j.cell.2016.07.020
[23] Yang M, Dent M, Lai H, et al. Immunization of Zika virus envelope protein domain III induces specific and neutralizing immune responses against Zika virus[J]. Vaccine, 2017, 35(33): 4287-4294. DOI: 10.1016/j.vaccine.2017.04.052
[24] Wootla B, Denic A, Rodriguez M. Polyclonal and monoclonal antibodies in clinic[J]. Methods Mol Biol, 2014, 1060: 79-110. DOI: 10.1007/978-1-62703-586-6_5
[25] Nakazawa M, MukDmoto M, Miyatake K. Production and purification of polyclonal antibodies[J]. Methods Mol Biol, 2016, 1474: 49-59. DOI: 10.1007/978-1-60761-783-9_5
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
