绵羊脑炎单核增生性李斯特菌LM90 SB2鞭毛基因FlaA的敲除及对毒力影响的研究
2018-03-13,,,,,,,
,,, , , , ,
单核增生性李斯特菌(Listeriamonocytogenes, LM)是人兽共患传染病重要病原之一。由该菌引起感染发病率虽低,但病死率极高。在医学临床中可以引起脑炎、孕妇流产以及败血症等[1]。在兽医临床中牛羊易感,表现为败血症、神经症状即“转圈病”、孕畜流产等,给养殖业的发展带来了一定的损失[2]。LM致病性与其所携带的毒力因子有着密切的关系,如溶血素,肌动蛋白、磷脂酶、毒力因子调节蛋白、内化素、以及鞭毛蛋白等,不同的毒力因子发挥的作用不尽相同[3]。
细菌产生的生物被膜(bacterial biofilm, BF)能够增强细菌生存能力,抵抗环境压力、抗菌药物以及宿主免疫系统的识别和攻击[4]。BF能依靠细菌表面的结构,如糖萼、菌毛、鞭毛等黏附于敏感细胞[5],促进BF的产生,进而直接或者间接地增强了细菌的毒力。细菌的鞭毛是由鞭毛丝亚基蛋白组装而成的细菌运动器官,与细菌的致病力有重要的关系。在对某些大肠杆菌菌株研究时发现缺失编码鞭毛蛋白基因后,细菌丧失了对肠上皮细胞的黏附和侵袭功能,显著下调Ⅰ型菌毛的表达量。同时也证明鞭毛的运动性是大肠杆菌BF形成初期与后期成熟过程中的决定性因素,而且在BF形成初期鞭毛更是作为黏附因子促进细菌的黏附,进而明显增强细菌的毒力[6]。
新疆石河子大学动物科技学院预防兽医学实验室以发生“转圈病”的绵羊病例分离并鉴定到LM,命名为LM90 SB2。该菌携带鞭毛基因(flaA),但flaA对LM90 SB2的致病性和BF形成方面的影响尚未见详细报道。因此本研究以LM90 SB2为研究对象,在构建flaA基因突变株基础上,通过对比野毒株和突变株的BF形成能力,小鼠LD50等变化,分析flaA对LM90 SB2毒力的影响,为LM的致病机制的进一步研究提供有用数据。
1 材料和方法
1.1材料 LM90SB2野毒株由石河子大学动物科技学院预防兽医学实验室保存;pKSV7 穿梭质粒由本实验室保存;Taq DNA 聚合酶、dNTPs等均购自TaKaRa 公司。
1.2引物设计 根据GenBank中的LM 4b血清型的flaA(登录号:HF558398.1)序列为模板,设计实验所需引物:上下游同源臂的扩增引物为ΔflaA-F1,2和ΔflaA-R1,2;SOE-PCR的引物为ΔflaA-F1、ΔflaA-R2;检测引物为ΔflaA-J1,2和ΔflaA-J3,4。引物由北京睿博兴科生物技术有限公司合成,详见表1(下划线分别表示酶切位点EcoRⅠ和BamHⅠ,斜体部分为保护碱基)。
表1 构建LM flaA基因突变株特异性引物
Tab.1 Specific primers for construction of flaA gene deletion strain of LM

Primers5′⁃3′SequenceFragmentsize/bpAnnealingtemperature/℃ΔflaA⁃F1GGAATTCCATCGTATCCAACGTATTTC78655ΔflaA⁃F2TTGTGTTTCCCTCCTACAGATAAATGAATTTGATATGTTAΔflaA⁃R1TAACATATCAAATTCATTTATCTGTAGGAGGGAAACACAA76260ΔflaA⁃R2CGGGATCCTCGTTGCGGACATCCCTTTAΔflaA⁃J1TTGTGAACCTTGCCCGTGTG974/194155ΔflaA⁃J2ATCTTAACTTTGGCTCTGCGΔflaA⁃J3TTTTATTGCCGAGGACTCAC1476/244353ΔflaA⁃J4GATATCCGAAACCATTGTTT
Note: The underscore indicates the restriction sitesEcoR I andBamHI, respectively, and the italicized moiety is the protecting base.
1.3LM90 SB2的flaA基因突变株的构建
1.3.1flaA基因上下同源臂扩增、融合重组穿梭质粒pKSV7-ΔflaA的构建 以LM90 SB2基因组为模板利用设计的引物(表1)ΔflaA-F1,2和ΔflaA-R1,2分别扩增flaA基因的上下游同源臂,利用引物ΔflaA-F1和ΔflaA-R2经过融合后得到融合片段ΔflaA与pMD19-T (simple)连接,EcoRⅠ和BamHⅠ双酶切验证正确后送至北京睿博兴科生物公司测序。将测序正确的融合片段与酶切后pKSV7连接,构建重组穿梭质粒pKSV7-ΔflaA。
1.3.2LM90 SB2基因突变株LM90 SB2-ΔflaA的构建 将纯化后的重组质粒pKSV7-ΔflaA电转入LM90 SB2感受态细胞中,在氯霉素和42 ℃温度压力下传代,经两种检测引物ΔflaA-J1,2(完全重组后产物974 bp,野毒株产物1 941 bp)和ΔflaA-J3,4(完全重组后产物1 476 bp,野毒株产物2 443 bp)分别检测同源重组情况,构建LM90 SB2的flaA基因突变株。
1.4LM90 SB2-ΔflaA部分生物学特性的研究
1.4.1菌落形态、遗传稳定性及生长曲线的测定 将LM90 SB2-ΔflaA与LM90 SB2在BHI平板上划线后观察菌落形态;挑取LM90 SB2-ΔflaA与LM90 SB2的单菌接入BHI培养基,每隔2 h取样稀释涂板,进行菌落计数。
1.4.2运动性的测定 分别将LM90 SB2-ΔflaA与LM90 SB2对数生长期的菌液接种于半固体培养基中,在25 ℃条件下静置培养36 h观察观察菌株的运动性。
1.4.3BF形成能力的形态观察 将LM90 SB2-ΔflaA与LM90 SB2培养至对数生长期(OD600≈0.500)的菌液加入96孔板,分别于2、6、10、12 h时弃去培养板培养液结晶紫染色15 min后在倒置显微镜(300×)下观察BF形成情况。
1.4.4小鼠半数致死量的测定(LD50) 将 LM90 SB2-ΔflaA与LM90 SB2稀释成不同稀释度,腹腔注射6周龄昆明系小鼠。用寇氏改良计算法计算获得LD50的值。
2 结 果
2.1LM90 SB2-ΔflaA突变株的构建
2.1.1ΔflaA融合片段连接pMD19-T和pKSV7质粒结果 通过PCR和融合PCR得到的1 548 bp的融合片段与pMD19-T连接酶切后得到与预期大小为1 548 bp一致的目的条带(图1A)。构建的重组pKSV7质粒酶切后也得到与预期值相符的1 548 bp的条带(图1B)。
2.1.2同源重组构建LM90 SB2-ΔflaA将pKSV7-ΔflaA电转入LM90 SB2感受态细胞中,传代培养后经检测引物ΔflaA-J1、J2(重组后产物974 bp,野毒株产物1 941 bp)和ΔflaA-J3、J4(重组后产物1 476 bp,野毒株产物2 443 bp)检测和测序后得到阳性转化子(图2),成功构建flaA突变株并命名为LM90 SB2-ΔflaA。
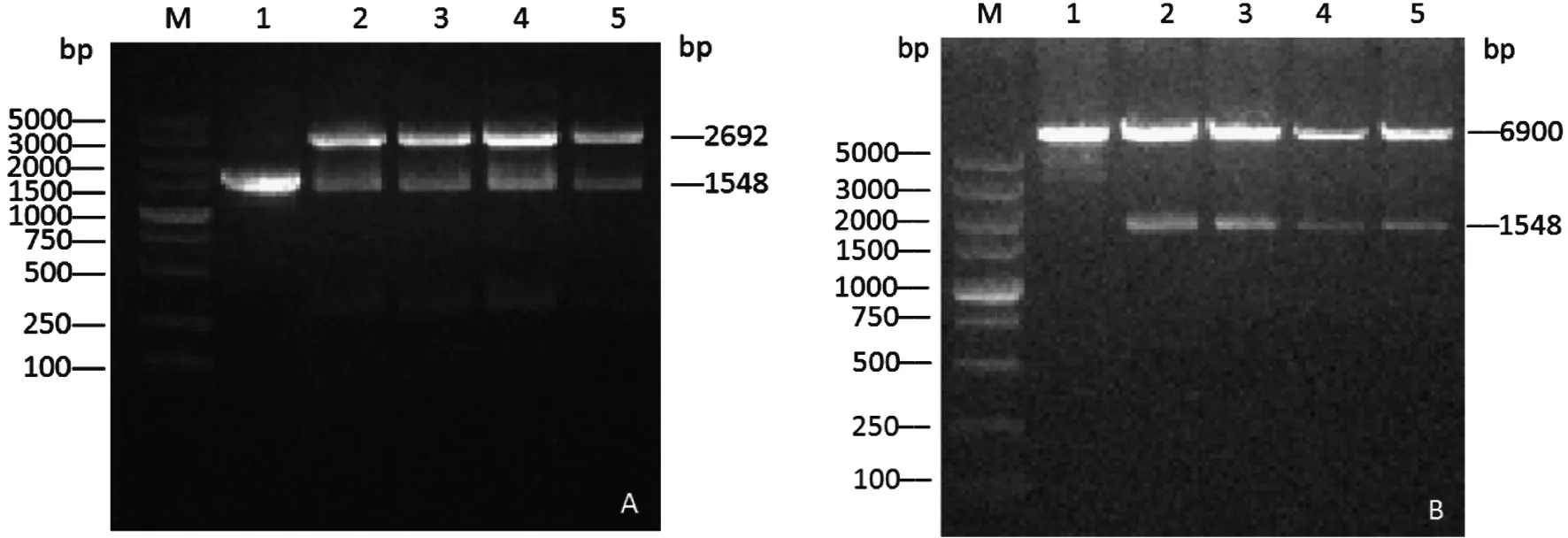
A.M:DL5000 DNA marker;1:target product;2~5:pMD19-T-ΔflaA B.M:DL5000 DNA marker;1:pKSV7;2~5:pKSV7-ΔflaA图1 pMD19-T-ΔflaA与pKSV7-ΔflaA双酶切鉴定结果Fig.1 Identification of pMD19-T-ΔflaA, pKSV7 plasmid and pKSV7-ΔflaA by double enzyme
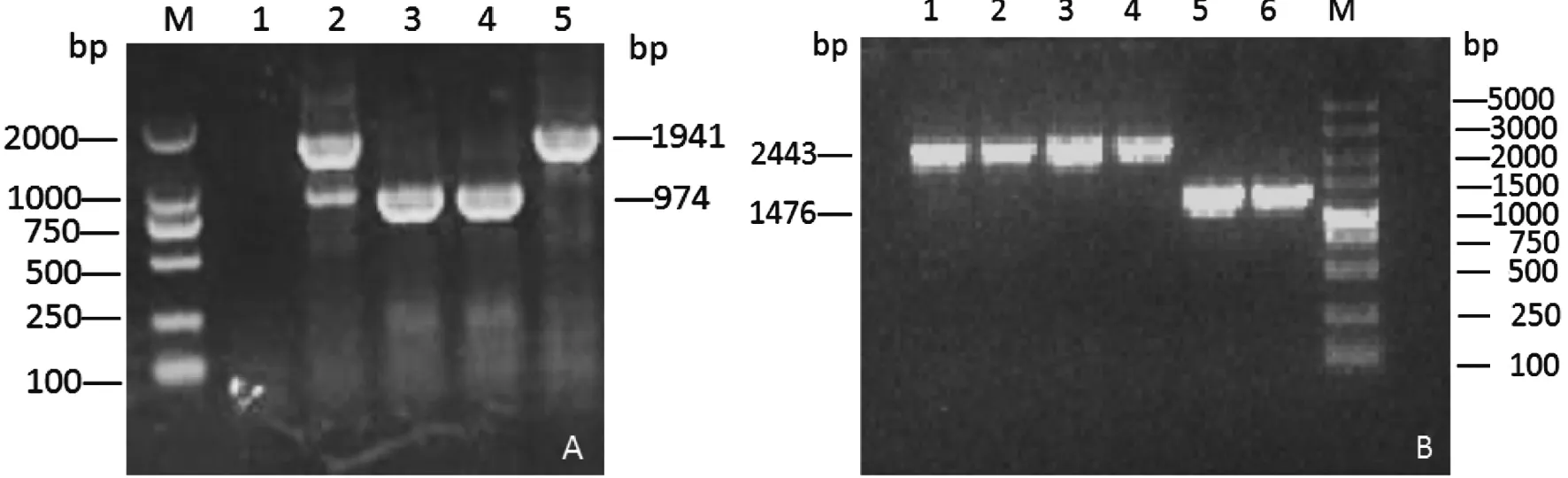
A.(J1,J2) M:DL2000 DNA Marker; 1: Control group; 2: Single exchange strain; 3,4: LM90 SB2-ΔflaA; 5: LM90 SB2 B.(J3,J4) M:DL5000 DNA Marker; 1~4:LM90 SB2-ΔflaA; 5,6:LM90 SB2图2 同源重组菌采用J1、J2和J3、J4引物的PCR鉴定结果Fig.2 PCR results of homologous recombinant strains with primerJ1, J2 and J3, J4
2.2LM90 SB2-ΔflaA部分生物学特性的研究
2.2.1菌落形态、遗传稳定性及生长曲线的测定结果 两种菌落形态相似,均为圆形、直径约1 mm、半透明、边缘整齐的乳白色菌落(图3-A)。在无氯霉素抗性37 ℃传至30代后遗传稳定性良好。LM90 SB2-ΔflaA与LM90 SB2的生长均在8~10 h进入稳定期,但每个时间段LM90 SB2-ΔflaA细菌数量均明显低于LM90 SB2,且差异显著(P<0.05)(图3-B)。

A: ①:LM90 SB2;②:LM90 SB2-ΔflaA B:Growth curves of LM90 SB2 and LM90 SB2-ΔflaA at 37 ℃图3 LM90 SB2和LM90 SB2-ΔflaA在固体培养基上形成的菌落以及37 ℃条件下的生长曲线Fig.3 LM90 SB2 and LM90 SB2-ΔflaA colonies formed on BHI solid culture medium and growth curves at 37 ℃
2.2.2运动性的测定 在25 ℃环境半固体培养基静置培养后,LM90 SB2-ΔflaA的运动能力下降明显(图4),晕圈直径由LM90 SB2的1.38 cm,LM90SB2-ΔflaA为0.50 cm,运动能力下降了63.77%。
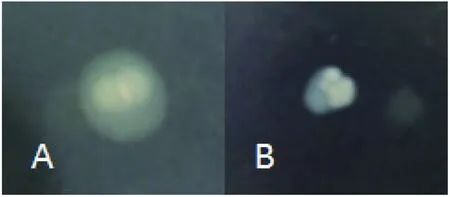
A:LM90 SB2;B:LM90 SB2-ΔflaA图4 在25 ℃条件下LM90 SB2与LM90 SB2-ΔflaA的运动能力测定结果Fig.4 Comparison the LM90 SB2 and LM90 SB2-ΔflaA in kinetic capacity at 25 ℃
2.2.3BF形成能力的显微镜观察 LM90 SB2在2 h时BF初步形成,进入初始粘附期(图5-A);2~6 h BF逐渐形成较为完整的矩阵网格状结构,处于粘附期和持续生长期(图5-B);10 h BF矩阵结构稳定且明显,形成完整的膜样结构,处于稳定期(图5-C);12 h后BF的结构出现松散,网状结构逐渐散落进入BF的散播期(图5-D)。LM90 SB2-ΔflaA在2 h形成的BF只有少量的网状结构(图5-E),2~6 h内BF处于粘附期和持续生长期但BF的生成量较少且松散(图5-F),在10 h时BF形成较稳定但网状结构但致密性差(图5-G),12 h后LM90 SB2-ΔflaA的BF结构逐步松散进入散播期(图5-H)。
2.2.4小鼠半数致死量的测定结果 根据寇氏改良剂算法计算得LM90 SB2-ΔflaA与LM90 SB2的半数致死量分别为4.27×106cfu和1.62×107cfu,半数致死能力下降了3.8倍。
3 讨 论
研究表明细菌的鞭毛在介导黏附感染时既可以通过自身的运动性非特异性增加细菌与受体细胞之间的接触概率促进黏附,达到侵入感染的目的,又可以通过自身的鞭毛蛋白特异性与被感染细胞的鞭毛受体结合来完成细菌的黏附和侵袭[7-8]。痢疾杆菌的flaA基因缺失后运动性降低了62 %,对宿主的毒力也明显降低[9]。缺失F18鞭毛大肠杆菌对IPEC-1和IPEC-J2细胞的黏附能力显著下降,说明鞭毛在F18+大肠杆菌对宿主细胞的黏附过程中同样起重要的作用[10]。本研究通过构建LM90 SB2的flaA基因突变株后发现鞭毛不能正常形成,运动能力下降了63.77%,对环境的适应能力下降。由于LM90 SB2-ΔflaA进入机体后除了自身的运动性降低外,其自身的鞭毛蛋白合成降低,进而不能与宿主细胞上的对应的受体结合反应,进而黏附和侵袭能力降低,是引起LD50升高的原因之一。
此外鞭毛既能使静态或者流动状态的菌体更容易聚集,其带来的运动性又能在BF形成过程中的某些阶段起到关键作用[11-13],BF的形成和发展而产生的耐药性是许多持续性感染和慢性感染的主要因素,因此鞭毛介导的运动性和黏附性能通过促进BF的形成而间接地参与细菌的致病性[6]。曾经的研究表明LM90 SB2能形成完整且致密的BF[14]。而本研究中构建LM90 SB2-ΔflaABF形成规律虽然未发生改变,但每个阶段BF形成量明显减少,且结构更加松散,矩阵状网格结构致密性降低,但BF形成能力并未完全失去。表明flaA基因编码的鞭毛蛋白在LM90 SB2形成BF的各个阶段都发挥着一定的作用。
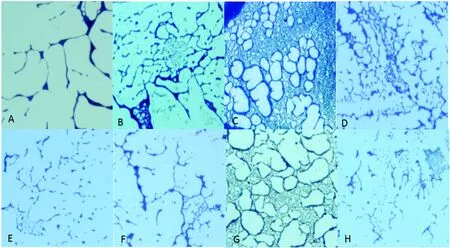
A, B, C, D: LM90 SB2 at 2 h, 6 h, 10 h, 12 h E, F, G, H: LM90 SB2-ΔflaA at 2 h, 6 h, 10 h, 12 h图5 LM90 SB2和LM90 SB2-ΔflaA在不同时间BF结构(300×)Fig.5 BF produced by LM90 SB2 and LM90 SB2-ΔflaA at different time points (300×)
本研究结果表明flaA基因能编码LM90 SB2鞭毛,鞭毛直接或者间接影响了LM90 SB2BF的形成和LD50。这为探索LM90 SB2引起绵羊脑炎致病机制提供了依据。
[1] Allerberger F, Wagner M. Listeriosis: a resurgent foodborne infection[J]. Clin Microbio Infect, 2010, 16(1): 16-23. DOI: 10.1111/j.1469-0691.2009.03109.x
[2] Wang GL, Yin YL, Jiao KH, et al. Diagnosis ofListeriamonocytogenesNTSN[J]. Chin J Zoonoses, 2013, 29(7): 639-645. (in Chinese)
王国梁,殷月兰,焦库华,等.绵羊李斯特菌病病原诊断及其生物学特性研究[J].中国人兽共患病学报, 2013,29(7): 639-645.
[3] Ma YN, Zhao Y, Guo YC, et al. Serological typing and virulence-associated genes analysis ofListeriamonocytogenesisolated from ready-to-eat foods[J]. Chin J Food Hyg, 2017, 29(1): 14-18. (in Chinese)
马彦宁,赵悦,郭云昌,等.即食食品中单核细胞增生李斯特菌的血清学分型和毒力基因分析[J],中国食品卫生杂志,2017,29(1):14-18.
[4] Janissen R, Murillo DM, Niza B, et al. Spatiotemporal distribution of different extracellular polymeric substances and filamentation mediateXylellafastidiosaadhesion and biofilm formation[J]. Sci Rep, 2015, 5: 9856. DOI: 10.1038/srep09856
[5] Tollersrud T, Berge T, Andersen SR, et al. Imaging the surface ofStaphylococcusaureusby atomic force microscopy[J]. APMIS, 2001, 109(7-8): B541-545.
[6] Guo ZY, Zhou MX, Duan QD, et al. Advance on the pathogenicity and immunological application of bacterial flagella—A review[J]. Acta Microbiologica Sinica, 2014, 54(3): 251-260. (in Chinese)
郭志燕, 周明旭, 段强德,等. 细菌鞭毛的致病性及其免疫学应用的研究进展[J]. 微生物学报,2014, 54(3):251-260.
[7] Mohabati Mobarez A, Ahmadrajabi R, Khoramabadi N, et al. Protection against Legionnaire’s disease: recombinant flagellin A ofLegionellapneumophilacan induce protective immunity against bacteremia in a BALB/c murine model[J]. J Mol Microbiol Biotechnol, 2017, 27(2): 110-116. DOI: 10.1159/000460295
[8] Radomska KA, Wosten MMSM, Ordonez SR, et al. Importance ofCampylobacterjejuniFliS and FliW in flagella biogenesis and flagellin secretion[J]. Front Microbiol, 2017, 8: 1060. DOI: 10.3389/fmicb.2017.01060
[9] Nørstebø SF, Paulshus E, Bjelland AM, et al. A unique role of flagellar function inAliivibriosalmonicidapathogenicity not related to bacterial motility in aquatic environments[J]. Microb Pathog, 2017, 109: 263-273. DOI: 10.1016/j.micpath.2017.06.008
[10] Duan DQ. Study on the flagella from F18+Escherichiacolirelated to its pathogenicity[D]. Jiangsu: Yangzhou University, 2012. (in Chinese)
段强德. F18+大肠杆菌鞭毛与其致病相关性的研究[D].江苏:扬州大学, 2012.
[11] Alhede M, Er O, Eickhardt S, et al. Bacterial biofilm formation and treatment in soft tissue fillers[J]. Pathog Dis, 2014, 70(3): 339-346. DOI: 10.1111/2049-632X.12139
[12] Janissen R, Murillo DM, Niza B, et al. Spatiotemporal distribution of different extra cellular polymeric substances and filamentation mediateXylellafastidiosaadhesion and biofilm formation[J]. Sci Rep, 2015, 5: 9856. DOI: 10.1038/srep09856
[13] Renier S, Hebraud M, Desvaux M. Molecular biology of surface colonization byListeriamonocytogens: an additional facet of an opportunistic Gram-positive foodborne pathogen[J]. Environ Microbiol, 2011, 13(4): 835-850. DOI: 10.1111/j.1462-2920.2010.02378.x
[14] Wu Q, Yan YY, Wang Z, et al. Detection on biofilm formation and biofilm-associated genes ofListeriamonocytogenesinducting encephalitis in sheep[J]. Progr Vet Med, 2016, 37(7): 13-16. (in Chinese)
邬琴, 闫圆圆, 王振,等. 绵羊脑炎单增李斯特菌生物膜形成及相关基因的检测[J]. 动物医学进展, 2016, 37(7): 13-16.
