基于“痛泻要方”探讨防风对TNBS 诱导大鼠UC 结肠TLR-4及外周血中TNF-α、IL-1β的影响
2018-03-13郭军雄马丽汪斌闫立国
郭军雄,马丽,汪斌,闫立国
(1.河西学院医学院,甘肃 张掖 734000;2.河西学院中西医结合研究所,甘肃 张掖 734000)
溃疡性结肠炎(Ulcerative colitis,UC)作为一种常见的非特异性肠道炎症性疾病,其病因和发病机制尚不明确,目前研究认为UC的发病主要由免疫反应介导并与遗传和环境因素密切相关[1]。大部分UC可伴终身,严重威肋到患者的生活质量,且有一定的癌变风险,迄今尚无特效的治疗方法,已被世界卫生组织列为现代难治病之一。中医治疗 UC优势明显,其组方中大多注重风药的应用,但治疗机制不明。前期研究表明[2],“痛泻要方”配伍风药具有减轻UC模型大鼠结肠组织炎性反应,减缓黏膜充血水肿来促进实验性UC大鼠溃疡愈合的作用。本课题组拟在前期研究基础上,观察防风、痛泻要方、痛泻要方祛防风对UC大鼠结肠黏膜TOLL 样受体4(TLR-4),血清白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)表达的影响。
1 实验材料
1.1 实验动物
健康SPF级Wistar大鼠72只,雌雄各半,体质量(180±20)g,由甘肃中医药大学科研实验中心提供。动物合格证号:SCXK(甘)2011-0001;动物设施合格证号:SYXK(甘)2011-0001。
1.2 实验药品、试剂
痛泻要方制备:依据《景岳全书·卷五十四》中痛泻要方药物组成及剂量的比例确定。药材由河西学院第二附属医院药房提供,将上述药物洗净,浸泡40 min,加水煎煮两次,合并煎液,过滤,95℃水浴浓缩至每毫升含生药0.75 g。同样的方法制备痛泻要方去防风和防风水煎剂,药物最终浓度相当每毫升含生药0.75 g。以上药物制成后,分装,高压灭菌消毒,4℃冰箱保存备用。
SASP溶液:选取上海信谊天平药业有限公司生产的柳氮磺胺吡啶肠溶片(批号:09140806);规格:0.25 g/片,用研钵研碎,调配至0.03 g/mL浓度的混悬液备用。2,4,6-三硝基苯磺酸(TNBS),批号:2008-16-2,sigma公司,由北京邦定泰克生物技术有限公司提供;无水乙醇,批号:20140501,天津市化学试剂工厂提供;肿瘤坏死因子(TNF-α)放射免疫试剂盒,批号:20151101;白介素-6(IL-6)放射免疫药盒,批号:20151015;白介素-1β(IL-1β)放射免疫药盒,批号:20151101,以上测试盒均购自北京华英生物技术研究所;大鼠抗COX-2免疫组化试剂盒,批号:AE062452;大鼠抗TLR4免疫组化试剂盒,批号:AE080653,以上测试盒均购自北京博奥森生物技术有限公司;SP-9001生物素标记山羊抗兔IgG免疫组化检测试剂盒,批号:15121A01;浓缩型DNA试剂盒,批号:K146712F,以上测试盒均购自北京中杉金桥公司。
1.3 主要仪器
TGL-16G离心机,上海安亭科学仪器厂;XK96-A快速混匀器,北京维欣仪奥科技发展有限公司;GB11240-89 GSY电热恒温水浴锅,北京市医疗设备厂;r-911全自动放免计数仪,中国科技大学实业总公司;BI-2000型医学图像分析系统,成都泰盟科技有限公司;MiE图像处理系统,山东易创电子有限公司;日本OLYMPUS-CX21型显微镜。
2 实验方法
2.1 动物分组造模
将72只大鼠根据体质量随机分为空白对照组、模型组、防风组、痛泻要方祛防风组、痛泻要方组、SASP组,每组12只,雌雄各半。各组大鼠正常饲养1周后,除空白对照组外,其余各组采用TNBS/乙醇溶液灌肠结合束缚和饮食失节法复制肝郁脾虚型UC模型:造模组大鼠每日不定时束缚四肢,限制其自由活动,每日4 h左右,隔日进食。束缚1周后,禁食(不禁水)24 h后用10%水合氯醛腹腔麻醉(0.3 mL/100 g),一次性将TNBS/乙醇液(100 mg/kgTNBS和50%乙醇0.25 mL)溶液,用直径2 mm聚丙烯管缓慢推入距肛门约7~8 cm深的结肠处,再注入约0.4 mL空气,提取大鼠尾巴保持倒立1 min后,平躺至麻醉清醒后正常喂养。空白组大鼠肛门内约8 cm处按照上述方法给予等体积生理盐水灌肠。
2.2 给药及取材
等效剂量以成人痛泻要方常规剂量的10倍计算,各组于造模成功后第2 d开始灌胃,痛泻要方组、痛泻要方祛防风组按生药7.5 g/kg剂量灌胃。空白对照组与模型组每日给予等体积生理盐水,SASP组按0.3 g/kg剂量灌胃,1次/d,连续21 d后取材。各组大鼠禁食不禁水24 h后,乙醚麻醉后于股动脉采血5 mL,37℃水中放置30 min,以3 000 r/min离心10 min,分离血清4℃冰箱保存,待测血清IL-1β、TNF-α。采血后脱颈处死大鼠,快速剖取病变结肠5~8 cm,肉眼观察结肠损伤并评分,部分结肠组织以4%多聚甲醛固定,用于免疫组化法检测TLR4蛋白表达。
2.3 检测指标
血清IL-1β、TNF-α由北京华英生物技术研究所检测;结肠黏膜TLR4采用免疫组化(SP法),严格按试剂盒说明书操作。
2.4 TLR4蛋白表达结果及测量方法
TLR4蛋白表达以核膜或胞浆内有棕黄色颗粒为阳性,阳性染色细胞小于或等于10%定为阴性(-),10%~30%为弱阳性(+),30%~50%为阳性(++),大于50%为强阳性(+++)。并采用BI-2000型医学图像免疫组化分析系统,随机选取5个视野,测量阳性细胞平均积分吸光度,吸光度越大蛋白表达强,反之则表达弱。
2.5 统计方法

3 结果
3.1 实验大鼠一般状态观察
实验大鼠经TNBS/乙醇溶液灌肠当天开始出现稀便,活动逐渐减少,肛周污浊,毛色发黄无泽且被粪便沾染,部分大鼠肉眼可见血便,伴有拖尾、易撕咬、喜扎堆等。防风和痛泻要方祛防风组大鼠症状改善缓慢,毛色仍显晦暗无泽,扎堆、稀便及血便缓解不明显;痛泻要方和SASP组大鼠症状改善明显,肛周干净,毛色光亮,粪便呈灰褐色颗粒状,基本同空白对照组。
3.2 各组UC大鼠血清肿瘤坏死因子-α(TNF-α)含量的比较
模型组大鼠血清TNF-α水平显著高于空白对照组(P<0.01);防风组、痛泻要方祛防风组、痛泻要方组和SASP组TNF-α含量均低于模型组,其中痛泻要方组和SASP组有显著差异(P<0.05)。

表1 各组UC大鼠血清TNF-α含量的比较
注:与空白对照组相比,▲▲P<0.01,▲P<0.05;与模型组比较,ΔP<0.05
3.3 各组UC大鼠血清白细胞介素1β(IL-1β)含量的比较
模型组大鼠血清IL-1β水平显著高于空白对照组(P<0.01);防风组、痛泻要方祛防风组、痛泻要方组和SASP组IL-1β含量均低于模型组,尤以痛泻要方组和SASP组最为显著(P<0.01)。

表2 各组UC大鼠血清IL-1β含量的比较
注:与空白对照组相比,▲▲P<0.01,▲P<0.05;与模型组比较,ΔΔP<0.01
3.4 各组大鼠结肠组织TLR4蛋白免疫组化结果
TLR4蛋白表达于大鼠结肠黏膜及黏膜下层,空白对照组TLR4呈阴性(见图1);模型组TLR4呈强阳性(见图2);防风组TLR4呈阳性(见图3);痛泻要方去防风组TLR4呈阳性(见图4);痛泻要方组TLR4呈弱阳性(见图5);SASP组TLR4呈弱阳性或阴性(见图6)。
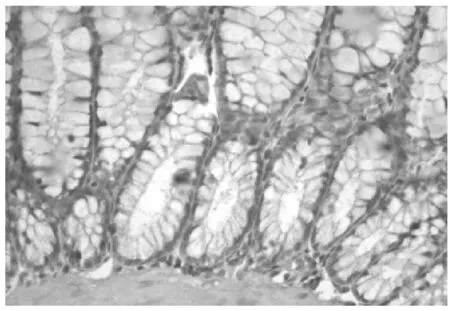
图1 空白对照组结肠(×40)
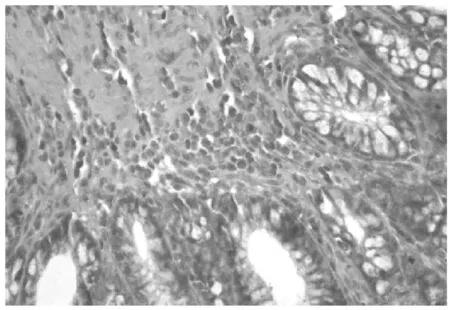
图2 模型组结肠(×40)
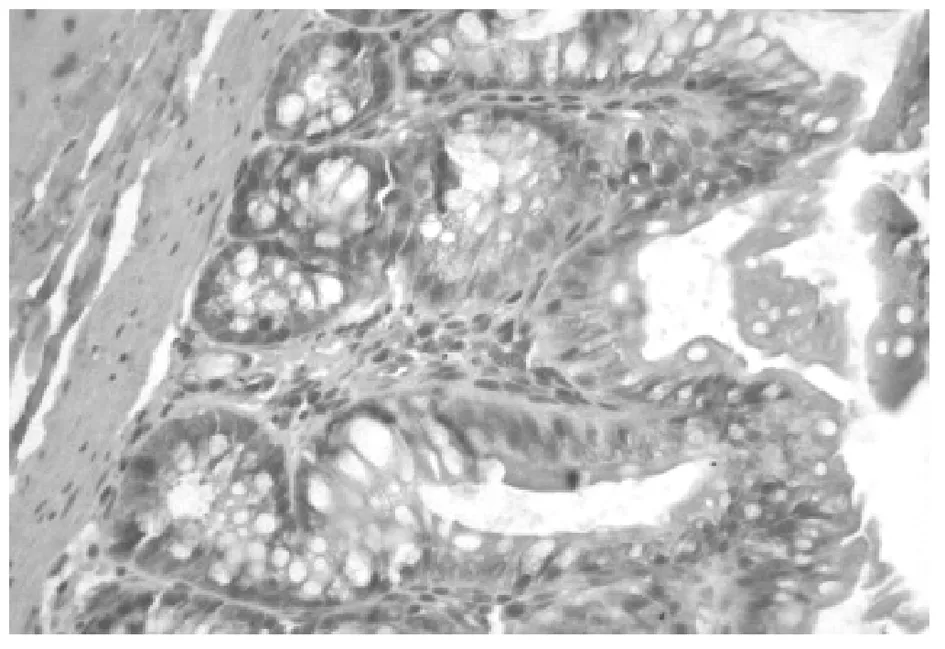
图3 防风组结肠(×40)

图4 痛泻要方去防风组 结肠(×40)
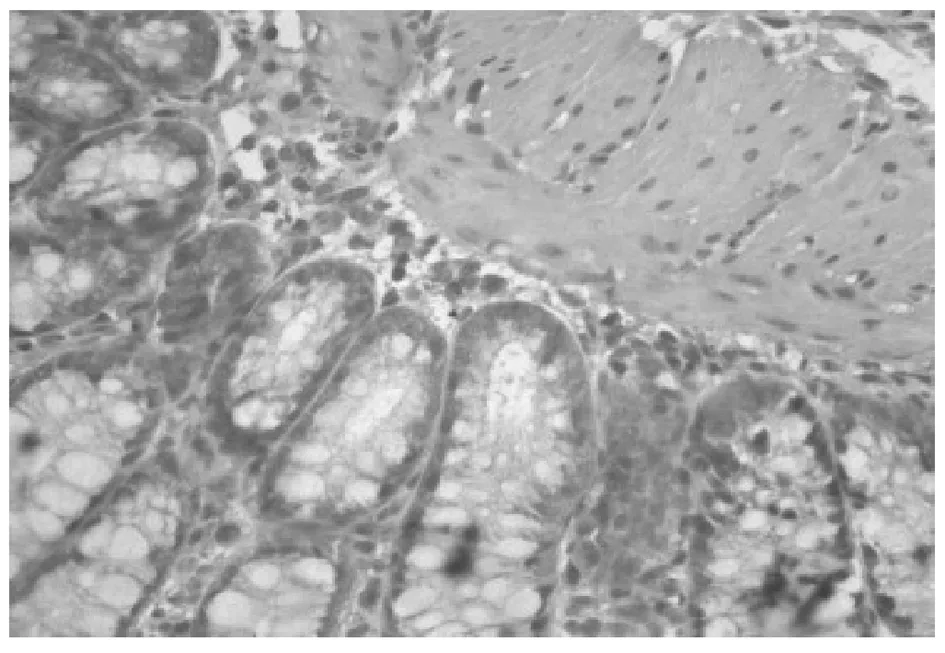
图5 痛泻要方组结肠(×40)
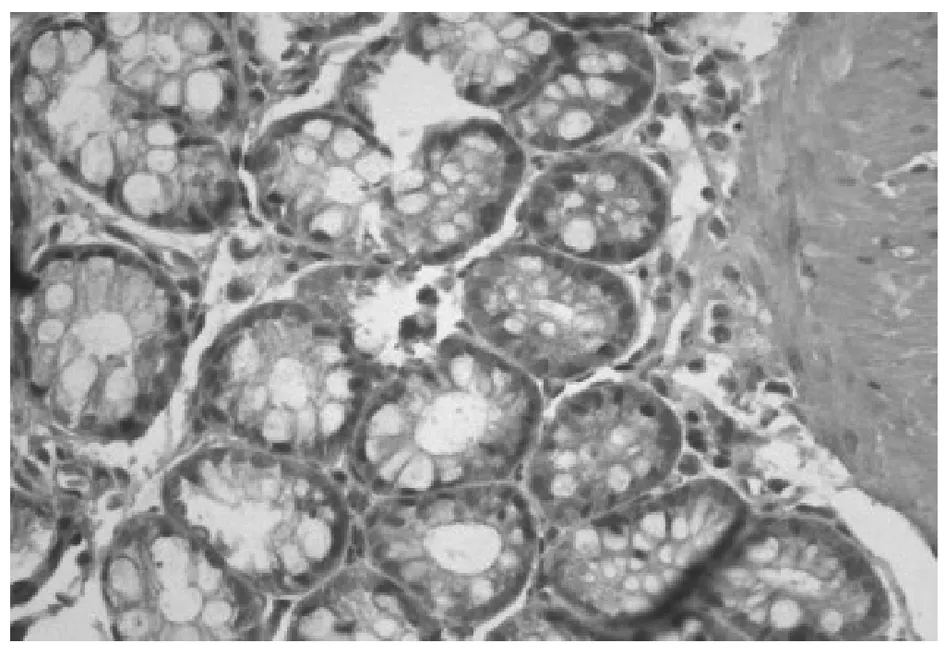
图6 SASP组结肠(×40)
3.5 各组大鼠结肠黏膜TLR4蛋白阳性细胞平均积分光密度比较
模型组大鼠结肠黏膜TLR4蛋白表达阳性细胞平均积分光密度高于空白对照组;防风组、痛泻要方祛防风组、痛泻要方组和SASP组结肠黏膜TLR4蛋白表达阳性细胞平均积分光密度均低于模型组,尤以痛泻要方组和SASP组最为显著(P<0.05)。

表3 各组大鼠结肠黏膜TLR4蛋白表达阳性细胞平均积分光密度值
注:与空白对照组相比,▲▲P<0.01,▲P<0.05;与模型组比较,ΔΔP<0.01,ΔP<0.05
4 讨论
现代医学研究认为UC是一种与免疫直接相关的肠道疾病,主要由免疫反应介导并和遗传、环境因素密切相关。TOLL样受体4(toll-1ike receptor 4,TLR4)是介导天然免疫的重要的跨膜蛋白受体,与宿主细胞对各种微生物致病原的识别有关。TLR4能特异性识别并结合病原相关分子模式(pathogen associated molecular patterns,PAMPs),经激活其下游MyD88依赖性及非依赖性信号传导分子,诱导核因子-κB(NF-κB),转录因子AP-1激活,致使效应细胞分泌IL-1,IL-6,IL-8,TNF-α及IFN-γ等细胞因子,介导肠黏膜的免疫反应[3-4]。同时,IL-1、TNF-α和IFN-γ等又可促使肠上皮细胞的TLR4和其辅助蛋白MD-2的表达增加,进而触发和加重溃疡性结肠炎的发病[5]。故抑制NF-κB信号通路上游TLR4的表达可致下游NF-κB所介导的TNF-α,IL-1β等炎症因子表达和最终合成分泌的减少。有研究证实[6],TLR4在正常的结肠黏膜中呈微量表达,而在UC的结肠黏膜中则呈现异常的高表达。TNF-α是按特定空间排布的3个单体堆叠成的三聚体,是目前已知的与UC发病关系最为密切的细胞因子之一。主要是由受到抗原刺激的单核—巨噬细胞和T淋巴细胞分泌产生,具有广泛生物学活性。TNF-α能通过参与激活中性粒细胞和上调血管内皮细胞黏附分子、促进肉芽肿的形成。同时还能加强单核巨噬细胞的吞噬功能,刺激IL-8,IL-1等细胞因子合成与释放,产生细胞因子的瀑布效应,促进炎症反应的扩大[7]。IL-1β是一种主要由单核—巨噬细胞分泌的多肽类细胞因子,可激活T淋巴细胞和B淋巴细胞,促进IL-2受体表达以及中性粒细胞浸润而上调免疫功能。更为主要的是IL-1β促使中性粒细胞和巨噬细胞活化及脱颗粒,促进炎性细胞释放前列腺素、血栓素、血小板活化因子等,增加上皮细胞和内皮细胞的通透性而炎症活性作用。另外,IL-1β还可通过诱导释放H2O2,影响Ca2+的释放,导致UC患者结肠平滑肌收缩功能紊乱而发生腹泻等症状[8]。
本研究将中医学的诊疗特点辨证论治列入假设范畴,故在采用2,4,6-三硝基苯磺酸(TNBS)/乙醇灌肠法基础上,加入束缚刺激合并饮食失节复合刺激法复制肝郁脾虚型UC大鼠。本研究结果显示:TNBS诱导大鼠UC结肠黏膜TLR4表达及血清TNF-α、IL-1β含量明显增加。运用中医经典名方进行干预治疗,痛泻要方是临床治疗肝旺脾虚所致腹泻的代表方剂,方中白术苦甘而温,补脾燥湿以治土虚,为君药;白芍酸寒,养血柔肝,缓急止痛,为臣药;陈皮辛苦温,理气醒脾和胃,为佐药;配伍少量“风药”防风,专入肝脾二经,辛散肝郁,甘舒脾气,且风药其性轻灵香燥,引导药物到达病变部位,发挥胜湿而止泻之功,故兼俱佐使之用。临床治疗UC,配伍防风和去掉防风疗效大不相同。本研究发现:痛泻要方全方明显减弱大鼠UC结肠黏膜TLR4蛋白表达,减低大鼠血清TNF-α、IL-1β的浓度。因此,我们推测痛泻要方治疗UC的可能机制是通过抑制NF-κB信号通路上游TLR4的表达,介导了下游TNF-α,IL-1β等炎症因子表达和最终合成分泌的减少,达到纠正了机体的异常免疫。本研究也从在一定程度上说明痛泻要方全方对UC大鼠的治疗作用明显优于缺防风方,证实了防风在痛泻要方中发挥着不可替代的佐助作用。
[1] Shih DQ,Targan SR.Immunopathogenesis of inflammatory bowel disease[J].World Journal of Gastroenterology,2008,18(3):390-400.
[2] 马丽,郭军雄,王小莲.风药对肝郁脾虚型UC大鼠结肠黏膜病理损伤的影响[J].中医药学报,2011,39(5):43.
[3] Tanaka K. Expression of Toll-like receptors in the intestinal mucosa of patients with inflammatory bowel disease[J]. Expert Review of Gastroenterology & Hepatology, 2008, 2(2):193-196.
[4] 周秋格,刘畅,刘工辉,等.SIGIRR对IL-1R/TLRs信号通路的负性调控作用研究进展[J].中国畜牧兽医,2016,43(10):2642.
[5] 张志军,刘懿,王磊,等.TLR4mAb对急性期溃疡性结肠炎小鼠结肠黏膜中促炎因子TNF-α、IFN-γ、IL-1β 的影响[J].复旦学报 (医学版),2008,35(2):180.
[6] Titus AR, Alex CC, Charles AP. Neutrophil transepithelial migration: role of toll-like receptors in mucosal inflammation[J]. Memórias do Instituto Oswaldo Cruz,2005,100(Suppll):191.
[7] 王燕,曹燕飞,朱向东,等.四神丸对溃疡性结肠炎模型大鼠血清白细胞介素-1β、-4、肿瘤坏死因子-α的影响[J].中国老年学杂志,2015,35(1):128.
[8] 王觅柱,邬彩虹,陈吉.溃疡性结肠炎患者血清IL-1β、TNF-α和IL-10的表达及其意义[J].国际消化病杂志,2009,29(5):363.
