先天性肺囊性腺瘤样畸形3例及文献复习
2018-03-13陈祎张赟通讯作者曹颖粟凤
陈祎 张赟(通讯作者) 曹颖 粟凤
(贵州省人民医院病理科 贵州 贵阳 550002)
本文报道我院近年诊治2例儿童和1例成人病例并进行相关文献复习来介绍CCAM的临床与病理特点。
1.资料与方法
1.1 临床资料
患者1男,5+月,因反复阵发性咳嗽4+月于2016年4月24日入院,出现发热,最高体温达38.9℃。曾院外予以间断治疗,咳嗽有所好转,但易反复。查体:听诊双肺呼吸音粗,可闻及少许细湿啰音及喘鸣音。辅助检查:血常规示白细胞为23.96×109/L。心脏彩超示先天性心脏病,动脉导管未闭,大血管水平左向右分流。胸部CT检查显示右肺下叶见团片状异常强化灶,大小约44mm×42mm,病灶中心也见多个囊状影,部分呈蜂窝样改变,增强后病灶实性部分不均匀强化。右肺下叶支气管受压狭窄。患者2男,9+月,因其母产检时超声检查发现胎儿左下肺囊性病变1+年于2017年8月14日入院。该患儿无明显症状,一般情况尚可。查体:听诊双肺呼吸音粗。辅助检查:影像学CT提示左下肺多个囊性病灶伴分隔影。患者3女,64岁。因发现左肺下叶占位伴咳嗽、咳痰半年于2017年9月10日入院,于院外服用中西药治疗无明显好转。查体:左下肺叩诊呈浊音,听诊双肺呼吸音粗。外院CT提示左下肺占位。本组病例全部经外科手术切除,左肺下叶2例,右肺下叶1例。
1.2 病理检查
1.2.1 肉眼观患者1送检肺组织一叶,大小6×6×4cm。支气管长0.5cm,直径0.5cm。剖面见一灰白色囊实性包块,大小约为5×5×3.5cm,大部分为实性区域,小部分为囊性区域,囊腔直径0.5~1.3cm,囊内壁光滑,部分囊腔内含淡红色浓稠液体。患者2送检不整形肺组织一块,大小7×5×2cm,剖面见一灰白色包块,大小4.5×3.5×2.8cm,包块切面为多囊性,囊腔直径0.2~1.7cm,囊内壁光滑,未见内容物。患者3送检肺组织一叶,大小15×5×4cm,支气管长1cm,直径2cm,剖面见脏层胸膜下肺组织内见一灰白色灰褐色相间的包块,大小约4×3×3cm,切面大部分实性、质中,局灶见小囊。
1.2.2 病理切片制作取材组织于4%中性甲醛固定12h,经脱水、透明、浸蜡、包埋、切片及HE染色,经3名病理医生在光学显微镜下镜检做出病理诊断。
1.2.3 免疫组化检测患者1 根据镜下病理特征,选取代表性组织行免疫组化标记,采用En-vision法,操作严格按照说明书进行,所用试剂均购自迈新公司。
2.结果
2.1 镜检
患者1和患者3肺内病变区域由较多不规则腺管或微囊组成,囊壁为厚薄不一的纤维组织,内含少许薄层平滑肌,壁间未见软骨、支气管腺体及炭末沉积等,囊壁内衬单层纤毛柱状上皮或立方上皮(图1),囊腔直径约0.05~0.4cm,最大一囊腔直径达1.3cm。壁间较多淋巴细胞、浆细胞及少量中性粒细胞浸润伴组织细胞反应(图2)。患者2 病变区由不规则并背靠背生长的细支气管样囊状结构组成,囊壁内衬覆单层纤毛柱状或立方上皮,局灶为假复层纤毛柱状上皮,未见粘液细胞,囊壁内含少许肺泡管结构,无软骨。囊腔直径0.3~1.7cm(图3)。
2.2 免疫表型
患者1免疫组化标记结果:TTF-1(+)、NapsinA(+)、CK广(+)、CK5/6(少数细胞+)、P63(少数细胞+)、CK7(+)、CK8/18(+)、CD68(+)、EMA(+)、Vim(+)、Ki-67(<1%+)(图4)。
2.3 病理诊断
患者1和3为肺先天性囊性腺瘤样畸形伴感染。患者2为肺先天性囊性腺瘤样畸形。根据Stocker的标准分型,患者1、患者3符合Ⅲ型,患者2符合Ⅱ型。
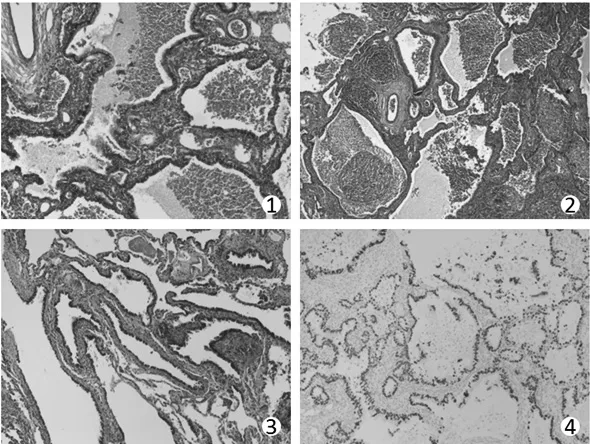
图1 患者1镜下见不规则的腺腔或微囊,内衬单层纤毛上皮或柱状上皮HE×100。图2患者3镜下病变为小微囊组成,囊壁间炎细胞浸润HE×100。图3患者2病变为不规则的细支气管囊状结构内衬覆单层纤毛柱状或立方上皮,局灶为假复层纤毛柱状上皮,囊壁内含少许肺泡管结构HE×100。图4患者1病变囊腔内衬上皮表达甲状腺转录因子-1(TTF-1)IHC×100。
3.讨论
3.1 病因
CCAM的发病原因目前存在争议,部分观点认为[2]CCAM是在胚胎5~10周时,因受到某些未知因素的影响使肺芽进行分枝发生异常,导致支气管闭锁,同时远端支气管分泌物不能排除,集聚形成囊肿。若一个气管芽隔断即形成孤立囊肿,若几个气管芽同时隔断即形成多发性囊肿。另一部分观点认为[3]肺发育过程中细胞增殖凋亡失衡是CCAM的病因。有研究报道[4]转化生长因子β1(transforming growth factor beta,TDF-β)在CCAM的形成中发挥了重要作用。也有学者提出神经胶质细胞衍生神经营养因子的异常表达、甲状腺转录因子-1(thyroid transcriptionfactor-1,TTF-1)同源异型框基因B5(Homeobox geneB5,Hoxb-5)、性别决定区域Y基因2(sex determining region Y-box2,SOX2)的表达均与CCAM的发生发展有关[5-7]。
3.2 临床特征
CCAM是一种少见的支气管-肺先天发育畸形,多见于胎儿及新生儿,罕见于儿童和成人。目前国外CCAM的最初诊断多在出生前,而我国可能因产前诊断技术的局限及某些客观因素造成在胎儿期的诊断较少。本报道中有患者2为胎儿期母亲产检发现。虽然多数CCAM无明显特异症状,但CCAM可引起或胎儿水肿、羊水过多,在婴儿时表现出咳嗽、呼吸窘迫、感染和气胸,并可能伴发恶性肿瘤,如腺癌、鳞状细胞癌、肺母细胞瘤、横纹肌肉瘤等[8]。同时CCAM的患儿还可能伴发其他肺外畸形,如心脏畸形、膈疝、囊性肾病等,本文中患者1 就有心脏彩超提示动脉导管未闭。成人CCAM临床症状可无特异性,患者有反复发作的肺部感染、肺脓肿、气胸及咯血等,多数可无或有轻微症状。成人若出现抗生素不能控制并反复发作的肺部感染时应考虑本病的可能[9]。CCAM通常可依靠影像学诊断,但会误诊,确诊需病理诊断。
3.3 病理特征
先天性囊性腺瘤样畸形多数病变累及单侧肺叶,通常为肺下叶。根据囊的大小和镜下特点,Stocker等[10-11]提出的将CCAM分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ型。0型,囊腔最大径0.5cm,为支气管样结构,囊壁含软骨、平滑肌和腺体,管腔内衬覆假复层纤毛柱状上皮、高柱状上皮、粘液细胞,囊壁厚100~500μm,该型最少见。Ⅰ型,由单个或多个囊组成,囊腔最大径可达10cm,囊呈背靠背生长,管壁含平滑肌、纤维、散在孤立的软骨板,囊腔内衬覆假复层纤毛柱状上皮、高柱状上皮、33%的病变有粘液细胞,囊壁厚100~300μm,此型最多见。Ⅱ型,整个病变由扩张的支气管样结构组成,囊腔直径一般0.5~2.0cm,囊呈背靠背生长,管壁无软骨,间见到少量肺泡管结构,5%的病变囊壁内见横纹肌。囊腔内衬覆纤毛柱状上皮、低柱状上皮,囊壁厚50~100μm,此型发病率仅次于Ⅰ型。Ⅲ型,肉眼为实性,在镜下才可见到病变为微囊或者弯曲的腺管状结构组成,表现为腺泡样或类腺瘤样的病变。囊腔直径一般<0.5cm,囊腔内衬覆立方、低柱状上皮,囊壁厚0~50μm,壁间无软骨和复层肌纤维。Ⅳ型,病变为薄壁的大囊,囊腔直径7cm,囊内壁衬覆肺泡上皮和低柱状上皮。由于0型病变与支气管源性囊肿、Ⅳ型病变和囊性肺母细胞瘤难以鉴别,故这两种分类没有得到大多数人认同[12]。有学者认为因CCAM是一种先天性发育异常,上皮具有不稳定性,造成纤毛柱状上皮易向黏液细胞化生、不典型增生甚至发生细支气管肺泡癌[13]。
3.4 鉴别诊断
(1)肺隔离症:其镜下所见与CCAM较相似,但叶外型肺隔离症在肺叶外,而CCAM位于肺叶内;叶内型肺隔离症虽然与支气管不相通,但是尤其单独的系统动脉供血,影像学检查时即可发现。(2)支气管源性囊肿:多为单囊,壁间有透明软骨、粘液腺体及平滑肌,CCAM常为多囊且缺乏软骨。(3)支气管扩张症:是由于支气管及周围肺组织因炎症及纤维化使管壁结构破坏,导致支气管扩张,管内充满粘稠脓性分泌物。(4)先天性大叶性肺气肿:是由于支气管阻塞造成球阀效应引起肺泡过度充气,镜下见肺泡腔显著扩张,部分融合,囊腔内衬单层扁平上皮。(5)胸膜肺母细胞瘤Ⅰ型:好于婴幼儿的罕见恶性肿瘤,为肺的囊性病变,囊内壁被覆呼吸上皮,上皮下为密集的原始间叶恶性细胞,似葡萄状肉瘤生发层细胞,灶性区域可见小细胞横纹肌母细胞分化[14]。
3.5 预后与治疗
取决于CCAM的病理类型、病变的体积、感染程度、是否伴发其他严重畸形等,一般Ⅰ型预后良好,Ⅲ型因常伴有心血管畸形故预后不良。有国外报道[15]在超声引导下对CCAM并发水肿的胎儿行经皮激光消融术,近期效果好。对于儿童的治疗有研究提出有症状的患儿建议生后3个月内手术,无明显症状的在3~6个月内手术[16]。治疗术式普遍采用囊肿摘除或肺叶切除。成人病例报道较少,尚无统一的治疗指南,有症状的推荐手术,而无症状的患者是选择随访还是手术尚存争议,有研究认为[8]CCAM长期存在易感染且可能发生恶性肿瘤,那么无论有无症状,一经发现需尽快手术切除。本文报道的3例患者,分别随访18个月、3个月、2个月,目前情况良好。
[1]Chikkannaiah P,Kangle R,Hawal M.Congential cystic adenomatoid malformation of lung:report of two cases withreviewofliterure[J].LungIndia,2013,30(3):215-218.
[2]洪淳,俞刚,张佳立,等.先天性肺囊性腺瘤样畸形的超微结构与组织分型对照分析[J].中华实用儿科临床杂志,2016,31(10):769-772.
[3]潘知焕,金微瑛,翁翠叶,等.先天性肺囊性腺瘤样畸形15例临床、影像及病理特点[J].中华实用儿科临床杂志,2016,31(4):299-301.
[4]王利群,蔡凤梅,周玲玲,等.先天性肺囊性腺瘤样畸形中TGF-β1的表达及意义[J].肿瘤防治,2012,24(5):372-375.
[5]Shanmugam G,Macarthur K,Pollock JC.Congential lung malformations-antenata5 and postnatal evaluation and management[J].Eur J Cardiothorac Surg,2005,27(1):45-52.
[6]Kulwa E,Tharakan T,Baxi L. Congential cystic adenomatoid malformations in the fetus:a hypothesis of its development[J].2005,20(5):472-474.
[7]Joshua K.Ochieng,Kim Schilders,Heleen Kool,et al.Sox2 Regulates the emergence of lung Basal Cells by Directly Activating the Transcaription of Trp63[J].American Journal of Respiratory Cell and Molecular Biology,2014(51):311-322.
[8]刘倩,李丹,丁兀兀,等.成人先天性肺囊性腺瘤样畸形临床病理观察[J].华西医学,2016,31(4):710-713.
[9]陈露露,苗立云,张德平,等.以双侧纵隔旁网格样影为表现的成人先天性肺囊性腺瘤样畸形一例[J].2013,12(4):409-411.
[10]Stocker JT,Madewell JE,DrakeRM.Congential cystic adenomatoid malformation of the lung .Classification and morphologic spectrum [J].Hum Pathol,1977,8(2):155-171.
[11]Stocker JT.Cpngenital and developmental diseases[M]//Dail DH,Hammer SP.Pulmonary pathology.2nd ed.New York:Springger-Verlag,1994:177.
[12]Collins AM,Ridgway PF,Killeen RP,et al,Congentital cystic adenomatoid malformation of the lung:hazards of delayed diagnosis [J].Respirology,2009,14(7):1058-1060.
[13]常占平,金锦善,金研,等.成人肺先天性腺瘤样畸形伴发肺癌[J].诊断病理学杂志,2003,10(5):284-286.
[14]王雪莉,奚政君,史青,等.小儿胸膜肺母细胞瘤4例临床病理分析[J].临床与实验病理学杂志,2011,27(4):372-375.
[15]Ruao R,Silva MM,Salustiano EM,et al.Percutaneous Laser ablation under ultrasound guidance for fetal hyperechogenic microcystic lung lesious with hydrops:a single center cohort and a literature review[J].Prenat Diagn,2012,32(12):1127-1132.
[16]王雪莉,奚政君,史青,等.儿童肺先天性腺瘤样畸形23例临床病理分析[J].临床儿科杂志,2012,30(11):1040-1043.
