可视化硬通道微创术对基底节脑出血的治疗
2018-03-12姚瀚勋王文波沈书颖肖晶彭志柱
姚瀚勋 ,王文波 ,沈书颖 ,肖晶 ,彭志柱
(1.湖州市中心医院,浙江 湖州 313000;2.桂林医学院附属医院,广西 桂林 541001;3.德清县人民医院,浙江 湖州 313200)
脑出血是指原发于脑实质内的非外伤性出血,常形成大小不等的脑内血肿,多数位于基底节[1]。可视化硬通道技术是近年来新兴的手术方法,创伤小、视野清晰,可近距离观察病变的特点。磁共振弥散张量纤维束成像是弥散张量成像 (diffusion tensor imaging,DTI)技术的拓展,能帮助早期识别运动纤维的损伤[2]。可视化硬通道技术是否能较好地减少手术损伤及保护患者运动纤维仍有待评估。本研究采用弥散张量纤维束成像评价不同术式对基底节脑出血的疗效,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2017年9月-2018年6月收治的82例基底节脑出血患者,按照手术方式分为可视化硬通道组和开颅组。纳入标准:(1)有明确高血压病史;(2)头颅CT检查明确脑出血;(3)出血部位在基底节;(4)于发病48小时内接受手术治疗;(5)出血量≤30~60mL;(6)脑疝前期,无需行去骨瓣减压术;(7)手术前GCS评分≥8分;(8)年龄<72 岁。 排除标准:(1)合并各种原因导致的继发性脑出血;(2)合并脑干出血及脑干功能衰竭者;(3)继发于脑梗死的出血;(4)血肿主要位于脑室,仅需行脑室外引流者;(5)伴有心、肺、肝、肾等其他重要器官功能障碍者[3]。可视化硬通道组共纳入37例(31例来自桂林医学院附属医院,5例来自湖州市中心医院,1例来自德清县人民医院。开颅组共纳入45例,34例来自桂林医学院附属医院,10例来自湖州市中心医院,1例来自德清县人民医院)。患者手术前后均行DTI检查,两组一般资料差异无统计学意义(P>0.05),详见表 1。
表1 两组一般资料比较(±s)
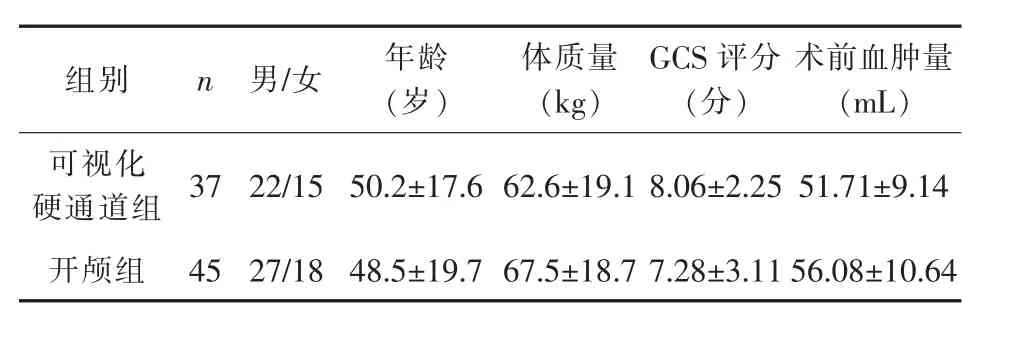
表1 两组一般资料比较(±s)
术前血肿量(m L)可视化硬通道组 3 7 2 2/1 5 5 0.2±1 7.6 6 2.6±1 9.1 8.0 6±2.2 5 5 1.7 1±9.1 4开颅组 4 5 2 7/1 8 4 8.5±1 9.7 6 7.5±1 8.7 7.2 8±3.1 1 5 6.0 8±1 0.6 4组别 n 男/女 年龄(岁)体质量(k g)G C S评分(分)
1.2 方法
1.2.1 影像学资料及DTI检查 入院前均完成CT检查,并计算血肿量,计算方法:通过CT软件(Neusoft PACS/RIS影像诊断子系统version 3.1,东软集团)在计算机上逐层勾画血肿轮廓后软件自动测出每个血肿层面的血肿面积,血肿体积=所有层面血肿面积之和×层厚。术前及术后2周均行DTI检查,采用GE公司3.0 T磁共振成像设备,DTI检査釆用弥散加权平面回波序列,应用Volumeonel.72下的Dtv.II.R2软件处理DTI图像。将各向异性最小阈值设置为0.18,显示各向异性分数图像及彩色各向异性方向图像,并在彩色图的基础上重建出上下行走的3D图像。测量双侧皮质脊髓束(eortieospinal tract,CST)的各向异性值,CST感兴趣区 (region of interest,ROI)定位于中央前回、内囊后肢前部、中脑大脑脚,由软件计算获得由ROI选取的种子数,并自动示踪计算出患侧CST纤维束数目[4]。
1.2.2 手术方法 (1)可视化硬通道组:根据术前头颅CT选择血肿腔长轴最长的层面,沿血肿腔长轴的延长线与额部或枕部的交点作为手术入路的定位点(若血肿距离额部较近,则选择额部入路;若血肿距离枕部较近,则选择枕部入路)。以定位点为圆心于半径4cm的范围内备皮消毒。在定位点处作一长度约4cm直切口,颅骨钻孔后扩大骨孔至直径约2cm,“十”字形切开硬脑膜。用新型内镜导引器+导航手术器械适配器沿血肿腔长轴进行穿刺,确认导引器顶端到达血肿腔后三分之一处,将管芯连拔出,导引器则留置于血肿腔内。导引器的管壁是透明的,便于术者确认管壁周围的血肿和出血点以及判断血肿清除程度。用蛇形牵开器固定导引器,置入神经内镜,在内镜直视下逐步向外退出导引器的同时清除血肿,并使用与内镜配套的双极电凝镊电凝止血。确认无活动性出血后用手术止血纱贴敷血肿残腔。(2)开颅组:选择血肿距离皮层最近的额颞部备皮消毒,作马蹄形切口,铣开骨窗,剪开硬脑膜,经穿刺抽吸确认血肿腔后置入手术显微镜。在显微镜下行脑皮质造瘘到达血肿腔,清除血肿并电凝止血[5]。
1.2.3 观察指标 (1)血肿清除率:术后24小时复查头颅CT,计算术后残余血肿量,计算方式同术前。血肿清除率=(手术前体积-手术后体积)/手术前体积×100%。(2)Fugl-Meyer运动功能评定量表[6]评分(以下简称“FM评分”):于手术前及术后6个月,分别观察上肢(坐位)、下肢(仰卧位、坐位、站位)的运动功能与反射活动,观察项目共50项(其中上肢33项,下肢17项),各项最高分为2分,总分为100分。得分越高运动功能越好。
1.3 统计学处理 应用SPSS 19.0统计软件对数据进行处理分析。计量资料采用(±s)表示,组间比较采用t检验,同组间治疗前后比较采用配对t检验;计数资料用百分率或构成比表示,组间比较采用 χ2检验。
2 结果
2.1 血肿清除率 可视化硬通道组术后血肿清除率(87.48±3.60)%较开颅组(70.55±7.04)%提高,差异有统计学意义(P<0.05)。
2.2 CST条目数及FM评分 术后2周可视化硬通道组CST条目数高于术前(图1),而开颅组CST条目数低于术前 (图2),差异有统计学意义 (均P<0.01);术后2周,组间比较提示可视化硬通道组CST条目数高于开颅组,差异有统计学意义(P<0.01)。可视化硬通道组术后6个月FM评分高于术前,差异有统计学意义(P<0.01);开颅组术后6个月FM评分与术前比较,差异无统计学意义(P>0.05);术后6个月组间比较发现可视化硬通道组FM评分高于开颅组,差异有统计学意义(P<0.01)。 详见表2。
表2 两组手术前后CST条目数及FM评分比较(±s)
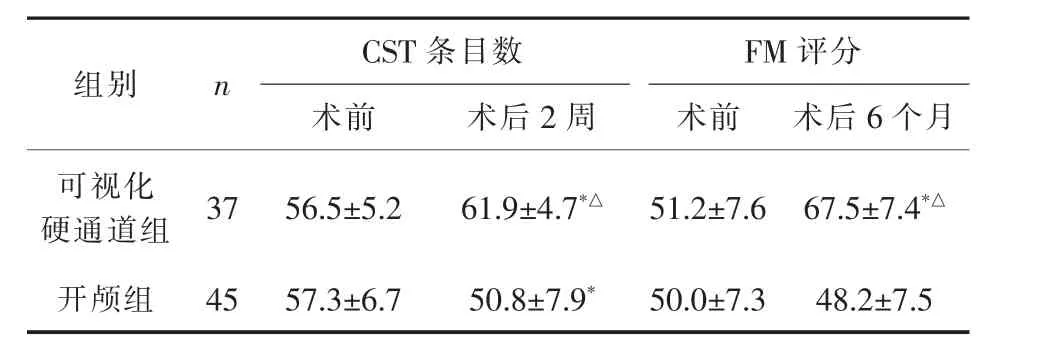
表2 两组手术前后CST条目数及FM评分比较(±s)
与术前比较 *P<0.01;与开颅组比较△P<0.01
组别 n C S T条目数术前 术后2周F M评分术前 术后6个月可视化硬通道组 3 7 5 6.5±5.2 6 1.9±4.7*△ 5 1.2±7.6 6 7.5±7.4*△开颅组 4 5 5 7.3±6.7 5 0.8±7.9* 5 0.0±7.3 4 8.2±7.5
3 讨论
DTI是判断运动神经纤维完整性的一种有效检查手段。该手段利用组织中水分子扩散运动存在各向异性原理,在多个方向加权图像,由Dtv.Ⅱ软件后处理产生神经纤维束条目数。处理后产生的纤维条目数可以作为一个较为精细的量化指标进行评估,该数目与真正解剖意义上的神经纤维根数有差别,但能提示影响水分子弥散的特定空间位置的纤维束相对数量,可定量反映纤维束的组织结构状况。
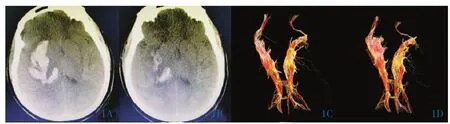
图1 可视化硬通道微创手术治疗右侧基底节脑出血。1A:术前CT影像;1B:术后CT影像;1C:术前弥散张量纤维束成像,示患侧皮质脊髓束受压、部分断裂;1D:术后2周患侧皮质脊髓束恢复较完整。
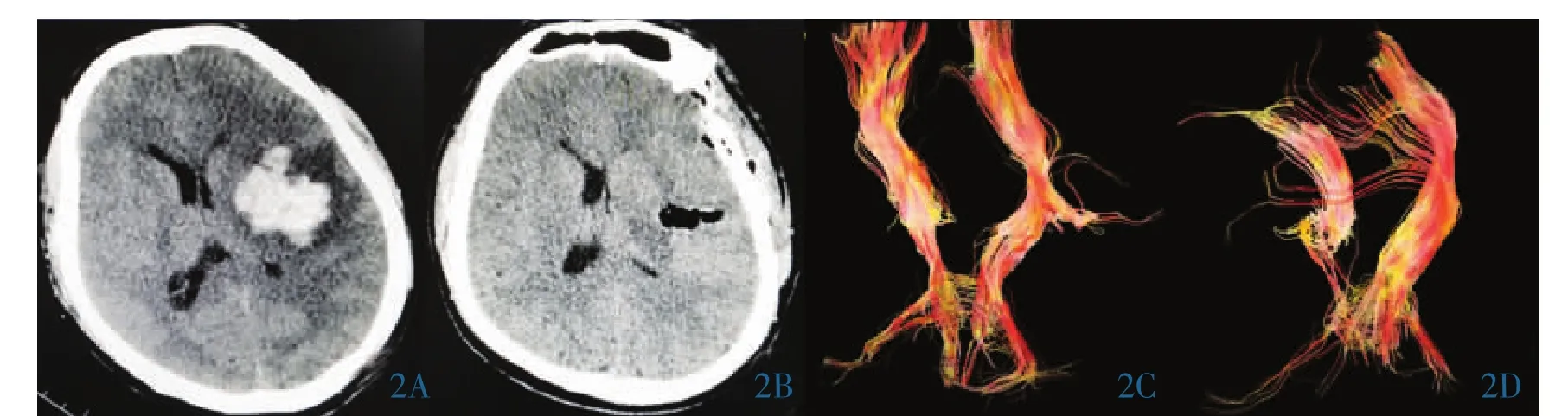
图2 开颅血肿清除手术治疗左侧基底节脑出血。2A:术前CT影像;2B:术后CT影像:2C:术前弥散张量纤维束成像,示患侧皮质脊髓束受压、部分断裂;2D:术后2周患侧皮质脊髓束较术前断裂程度加重。
CST是脑组织中最重要的下行神经纤维束,脑出血后,血肿会造成CST的移位或损伤,减少CST数量,即支配运动功能的神经纤维束条目数减少,这是导致脑出血患者出现不同程度肢体运动功能障碍的基础,而且其运动功能不全的程度与CST条目数减少较为一致[7]。通过计算发病后3-5天的相对剩余CST条目数可用于评估急性期脑出血的运动功能预后[2,8]。
基底节高血压脑出血外科治疗的传统术式包括大骨瓣开颅血肿清除并去骨瓣减压术、小骨窗开颅显微镜下血肿清除术及软通道血肿穿刺引流术等,其中小骨窗开颅显微镜下血肿清除术为本研究中开颅组的手术方式,该方式是手术显微镜普及之后被广泛用于治疗幕上高血压脑出血的术式。与传统的大骨瓣开颅血肿清除术相比,其较小的皮质切口使手术创伤更小,出血相对较少。然而,由于手术入路的方向与CST的伸展方向垂直,会造成CST断裂。而且,较小的手术切口使视野局限,血肿腔深部易被侧方的脑组织遮挡,难于彻底清除及止血,且术中需牵拉脆弱的脑组织,进一步损伤CST[9]。
可视化硬通道技术是治疗基底节高血压脑出血的新方法,该手术方式疗效确切,与传统硬通道相比更为安全[10]。传统的非透明硬质鞘管无法有效观察管壁侧方的血肿和出血点,故而血肿清除率较低,常需要留置引流管并在术后多次向血肿腔注射尿激酶,需要数天才能完全消退血肿。而硬通道操作的固有优势在于可最大程度减少对脑组织的牵拉,可视化硬通道技术借助透明管壁的硬质穿刺导引管[11],术者能够清楚地看到透明管壁周围的血块与脑组织的分界线以及出血点,直视下清除血肿和止血,该术式由桂林医学院附属医院神经外科自2015年9月首创[12]。作者临床实践发现,与传统开颅手术相比,可视化硬通道技术采用透明鞘管一次性穿刺到位的方法,无需显微镜下分离侧裂血管,操作便捷,血肿清除效率更高。该技术还可快速解除血肿对内囊区CST的压迫,避免术中牵拉以减少CST纤维的术中损伤,有利于患者术后运动功能的恢复,明显改善患者预后。本文结果也证实可视化硬通道组术后6个月运动功能较术前明显提高(P<0.01),且较开颅组有明显改善(P<0.01)。
综上所述,与传统开颅手术相比,可视化硬通道术能够更好地清除颅内血肿,且较好地保护术中CST,有助于患者术后的运动功能恢复。该技术可在最短的时间内解除血肿腔对CST的压迫,且手术入路与CST伸展方向平行,可以有效避开大部分的CST纤维,避免其断裂、缺失[13],保证其疗效。
