miR-126调控肺鳞癌细胞增殖的作用及机制研究
2018-03-11杨丽刘雪萍贺斌峰孙晓蓉张颖郭雪梅王霞
杨丽 刘雪萍 贺斌峰 孙晓蓉 张颖 郭雪梅 王霞
肺癌是严重威胁人类生命健康的主要疾病之一,其5年生存率低于30%。研究表明80%的肺癌为非小细胞肺癌(non small cells lung cancer, NSCLC),其中肺鳞癌占NSCLC的30%[1-3]。目前由于肺鳞癌没有特异性的治疗靶点(如EGFR突变,VEGF),因此肺鳞癌的治疗策略并没有像治疗肺腺癌一样有明显的提高。故亟待探索新的靶点、策略来治疗肺鳞癌。
microRNA(miRNAs)是一类仅有18-23 nt,不能编码蛋白的RNA分子,其通过绑定靶mRNA的3’-非编码区(untranslated region, UTR)或者5’ UTR,阻止mRNA的翻译或者降解mRNA,进而下调靶蛋白的表达。研究表明miRNA通过调节其靶点的表达可影响肿瘤的生命活动,包括肿瘤的发生、细胞增殖和分化、迁移侵袭等[4]。既往研究表明miR-944参与了肺癌细胞的分化,可作为诊断肺鳞癌的分子标志物[5]。Suetsugu 等[6]发现miR-150-5p通过抑制基质金属蛋白酶(matrix metalloproteinase, MMP)14,进而抑制肺鳞癌的进展。我们前期通过基因芯片发现miR-126等在肺鳞癌组织中较癌旁组织中有显著的下调,但其在肺鳞癌进展中发挥怎样的作用尚不清楚。因此,本文旨在探索miR-126在肺鳞癌进展中的作用并探索其相关机制。
材料与方法
一、主要材料
SK-MES-1细胞购自中科院上海细胞库。MEM培养基、胎牛血清、培养基添加物GluMAX和丙酮酸钠(Sodium Pyruvate) 购自GIBCO公司;TRIzol regent 购自上海sigma公司。定量PCR检测试剂盒、荧光素酶报告基因检测试剂盒、转染ViaFect试剂,MTS细胞增殖检测试剂盒、逆转录试剂盒购自promega公司;pMIR-REPORTTMluciferase和pRL-TK 质粒载体购自ABI生物技术公司;荧光素酶报告基因检测试剂盒购自peromega公司。T4连接酶、HindⅢ和Spe Ⅰ限制性内切酶购自NEB公司。阴性对照(negative control, NC)、miR-126-5p模拟物(miR-126 mimic)、ARNT siRNA、兔源抗人β-actin抗体以及HRP标记山羊抗兔IgG(H+L)二抗、cmv-3xFlag-NCoA7购自购自上海梦至生物科技公司。组织/细胞蛋白裂解液、NCoA7抗体、ARNT抗体、Flag抗体、琼脂球(Beads)购自CST公司。miRNA逆转录试剂盒(加尾法)购自上海生工。
二、实验方法
1. 肺鳞癌细胞SK-MES-1的培养: SK-MES-1细胞培养于含有10%胎牛血清的MEM培养基(加入1% GluMAX和1% 丙酮酸钠)中。细胞置于37 ℃、5% CO2、饱和湿度下的培养箱中传代培养,取对数生长期的细胞进行实验。
2. 肺鳞癌组织中miR-126的检测: 取10对手术切除的肺鳞癌和癌旁组织各100 mg,加入1 ml TRIzol regent后用组织匀浆器匀浆,之后冰上裂解30 min。按照TRIzol提取总RNA试剂盒说明书提取细胞的总RNA。应用miRNA逆转录试剂盒(加尾法)进行逆转录。cDNA稀释50倍后,采用BIO-RAD CFX96系统进行实时荧光定量PCR检测miR-126的表达,以U6作为内参。miR-126的上游引物: 5’-ACGCCATTATTACTTTTGGTACGCG-3’。每个待测基因设4个复孔。数据通过BIO-RAD CFX96系统进行处理,按照公式RQ=2-△△CT计算各组间的倍数关系。
3. miR-126 mimic、NC、ARNT siRNA以及cmv-3xflag-NCoA7的转染: 将miR-126 mimic、NC以及ARNT siRNA干粉用RNase-free H2O 配制成20 μmol/L的储存液后,分装、冻存备用。将SK-MES-1细胞消化后铺在直径6 cm的培养皿中,过夜后融合度达到60%~70%。弃去培养基后加入无血清的MEM培养基,再加入终浓度100 pM的miR-126 mimic和 20μl的转染试剂,充分混匀后孵育6~8 h。弃去培养基,换成完全培养基后继续培养48 h。NC以及ARNT siRNA的转染同miR-126 mimic的转染步骤。
4. MTS检测细胞增殖: 将SK-MES-1细胞消化并制成细胞悬液,以5×103/孔的密度将细胞接种到96孔板。细胞经过转染后,继续培养0、12、24、48 h后,弃去培养基,加入100 μl新鲜的培养基以及20 μl的MTS试剂。37 ℃ 孵育3 h后,用酶标仪在450 nm处检测各孔的吸光度值(OD值),空白孔调零。
5. IP以及Western blot检测: 将转染flag-NCoA7质粒的细胞收集后,加入蛋白裂解液在冰上裂解30 min,加入Flag抗体(1︰50)后4 ℃震摇过夜。之后加入琼脂球(beads)室温孵育2 h, 3 000 rpm离心收集琼脂球。加入2xloading buffer后沸水中煮10 min,之后进行western blot,具体方法同文献[7]。
6. 荧光素酶报告基因检测
①利用点突变技术扩增出含有HindIII和Spe I酶切位点的NCoA7突变位点的3’UTR; ②分别将野生型和突变型NCoA7 3’UTR 插入pMIR-REPORTTMluciferase vector载体;③分别将含有野生型和突变型NCoA7 3’UTR的 pMIR- luciferase质粒载体与pRL-TK质粒共转染进入SK-MES-1细胞,然后分别将等量的miR-126 mimic和NC再转染进入SK-MES-1细胞;④转染48 h后,利用双荧光素酶报告基因检测试剂盒检测萤火虫和海肾荧光素酶活性。
三、统计学方法
使用SPSS 17.0对数据进行分析,各实验至少重复3次,数据呈正态分布,两组间进行t检验,多组之间进行单因素方差分析,P<0.05为有统计学意义。
结 果
一、miR-126在肺鳞癌组织中表达下调
结果显示,肿瘤组织的miR-126相对表达水平为0.38±0.27,癌旁组织的miR-126相对表达水平为1.38±1.04。肺鳞癌组织中miR-126的表达水平显著低于癌旁组(P<0.05)。提示下调miR-126可能参与了肺鳞癌的发生、进展,见图1。

图1 qPCR检测肺鳞癌及癌旁组织中miR-126的表达水平
二、上调miR-126抑制肺癌细胞SK-MES-1的增殖
结果显示SK-MES-1细胞转染miR-126 mimic后12、24、48 h miR-126的相对表达水平分别是0 h的1.67、5.92和8.35倍,显著高于0h组(P<0.05)。通过MTS分析细胞活力显示,miR-126 mimic组在24 h、48 h的值为0.71±0.007和0.66±0.03,而NC组为1.50±0.04和2.45±0.33 (P<0.05)。上述结果提示上调miR-126抑制肺癌细胞SK-MES-1的增殖,见图2。


图2 上调miR-126对SK-MES-1细胞增殖的影响;注:A:qPCR检测SK-MES-1细胞转染miR-126 mimic后不同时间点miR-126的表达水平;B:MTS检测转染miR-126 mimic和NC后不同时间点细胞活力的变化。*,与0 h组比较P<0.05
三、NCOA7是miR-126的下游靶点
通过miRNA预测软件Targetscan以及MIRDB进行分析,推测NCoA7为miR-126的靶基因。荧光素酶报告基因实验结果显示,野生型(Wild type, WT)NCoA7 3’UTR质粒和miR-126 mimic共转染组,其荧光素酶活性显著低于野生型NCoA7 3’UTR质粒和NC共转染组(P<0.05)。而突变型(mutation, Mut) NCoA7 3’UTR质粒和miR-126 mimic共转染组与突变型 NCoA7 3’UTR质粒和NC共转染组的荧光素酶活性无显著差异(P>0.05),说明NCoA7是miR-126的直接靶点(见图3A)。此外,分析了上调miR-126后不同时间点NCoA7 mRNA和蛋白表达的变化。结果显示,miR-126 mimic转染12 h、24 h和48 h后NCoA7 mRNA和蛋白表达水平较0 h组显著降低(P<0.05)(见图3B和3C),进一步说明NCoA7 是miR-126的直接靶点。
四、NCoA7与ARNT相互作用调控SK-MES-1细胞的增殖
为了分析NCoA7调控SK-MES-1细胞的增殖的机制。将flag-NCoA7转染到SK-MES-1细胞后,再进行Co-IP检测,发现ARNT与NCoA7蛋白之间存在相互作用(见图4A)。结果发现应用miR-126 mimic上调后ARNT的表达在12、24和48 h时间点较0 h 组明显下调(见图4B)。将NC以及三条ARNT siRNA转染SK-MES-1细胞48 h后检测发现S1、S2、S3三条siRNA较NC组可显著下调ARNT mRNA和蛋白的表达,其中S1和S2 siRNA序列的抑制效果较为明显(见图4C和4D)。此外,用S1和S2两条siRNA转染SK-MES-1细胞后,我们发现12、24和48 h时S1和S2组细胞活力显著低于NC组(见图4E)(P<0.05)。提示抑制ARNT可显著抑制SK-MES-1细胞的增殖。
讨 论
miR-126是由表皮生长因子样域(epidermal growth factor-like domain 7, EGFL7) 基因的 pre-mRNA拼接和加重而形成的。EGFL7基因在血管系统发育和血管功能中发挥重要作用[8]。既往研究表明,miR-126在包括肺癌、胃癌、白血病、甲状腺癌多种肿瘤中表达下调[9-13]。Felli等[14]在对黑色素瘤细胞的研究中指出miR-126通过直接/间接方式调控ADAM9 和MMP7的表达,进而发挥抑制肿瘤的作用。同样,本研究明确了miR-126在肺鳞癌组织中的表达较癌旁组织是下调的。通过miR-126 mimic上调肺鳞癌细胞株SK-MES-1中miR-126的表达后,可显著抑制细胞的增殖,说明miR-126在肺鳞癌中发也同样发挥抑制肿瘤的作用。

图3 NCOA7是miR-126的下游靶点;注: A:荧光素酶报告基因实验检测miR-126与NCoA7 3’UTR端结合。*,与NC组比较P< 0.05。B和C:qPCR和western blot检测上调miR-126后NCoA7 mRNA和蛋白的表达水平。*,与0 h组比较P<0.05
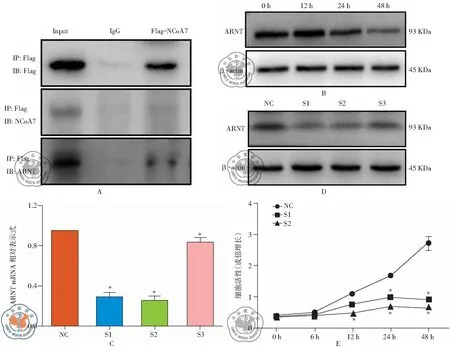
图4 NCOA7通过ARNT 相互作用发挥调控细胞增殖的作用;注:A:coIP检测NCoA7与ARNT蛋白的相互作用;B:western blot检测上调miR-126后不同时间点ARNT 蛋白的表达水平; C和D:应用三条ARNT siRNA转染SK-MES-1细胞后qPCR和Western blot检测ARNT的表达水平; E:转染ARNT siRNA后MTS检测细胞活力的变化;*,与NC组比较P<0.05
NCoA7,也称作ERAP140。最初发现NCoA7中心域中非经典LXXLL模体(motif)与ERα有相互的作用。进一步研究发现其与TRβ、PPARγ 和RARα也存在相互作用[15]。此外,NCoA7还包含一个与抗氧化蛋白(oxidation resistance protein, OXR)1 类似的TLDc域。因此,NCoA7也可以发挥抵抗细胞氧化应激及其介导的DNA损害[16-17]。近期研究发现NCoA7不仅可以调节全反式维甲酸(all-trans-retinoic acid, ATRA)介导的神经元分化,而且可作为神经细胞瘤预后的分子标志物[18]。Xie等[19]的研究发现过表达NCoA7可以促进口腔鳞癌细胞的增殖。本研究发现NCoA7是miR-126的靶点,并且上调miR-126可显著抑制NCoA7的表达。基于上述结果,我们推测miR-126可能通过抑制NCoA7的表达,进而发挥抑制肺鳞癌细胞增殖的作用。
为了进一步探索NCoA7发挥调控细胞增殖作用的机制,我们通过生物信息学网站发现NCoA7可能与ARNT蛋白有相互作用。ARNT是碱性螺旋-环-螺旋(basic- helix- loop- helix, b HLH)转录因子超家族成员。既往研究表明ARNT与芳烃受体 (aryl hydrocarbon receptor, AhR)或者低氧诱导因子(hypoxia-inducible factor, HIF)1α/2α形成异二聚体[20-21],绑定靶基因启动子区域的异生物质反应元件(xenobiotic response elements, XREs)或二氧(杂)芑反应元件(dioxin responsive elements, DREs),发挥调控p53、p21等基因表达的作用[22]。我们应用co-IP检测发现,在SK-MES-1细胞中NCoA7与ARNT蛋白存在相互作用,并且上调miR-126也可以下调ARNT的表达。此外,我们应用ARNT siRNA抑制ARNT的表达后,发现可显著抑制SK-MES-1细胞的增殖。因此,我们推测miR-126可能通过抑制NCoA7,影响ARNT的表达,进而抑制了肺鳞癌细胞的增殖。但ARNT如何调控SK-MES-1的增殖需要进一步的研究。
综上所述,本文结果证实miR-126在肺鳞癌中的表达水平较低。在肺鳞癌细胞SK-MES-1中上调miR-126表达后,通过下调靶点NCoA7的表达,进而抑制ARNT介导的细胞增殖。miR-126可作为潜在的治疗肺鳞癌的靶点。
