老年重症急性胰腺炎病人急性肺损伤的危险因素分析
2018-03-10魏焱陈炯陈秋星
魏焱 陈炯 陈秋星
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症之一,重症急性胰腺炎(severe acute pancreatitis, SAP)是AP中严重的类型,其进展迅速,易导致多脏器功能障碍综合征和多脏器功能衰竭,病死率高[1],肺脏是早期最易受累的脏器[2],有统计[3]1周内死亡的SAP病人大约60%伴有急性肺损伤(acute lung injury, ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。因老年人脏器功能的特殊性,容易出现全身并发症,死亡风险高[4],在急性反应期重视ALI的发生十分重要。本研究回顾性分析本院2010年1月至2016年6月收治的95例老年SAP病人的临床资料,探寻SAP急性反应期发生ALI的独立危险因素,现报告如下。
资料与方法
一、一般资料
95例老年(≥60岁)SAP病人中男性56例,女性39例,平均年龄(70.2±7.4)岁。95例SAP病人中并发ALI 39例(41.1%):发生ARDS 16例(16.8%),继发多器官功能障碍综合征者6例;其中死亡4例,病死率为4.2%;未发生ALI 56例(58.9%)。SAP病因中,胆源性51例(53.7%),高脂血症性23例(24.2%),酒精性13例(13.7%), 其他8例(8.4%)。
二、诊断标准
病人入院后均经实验室及影像学检查确诊。AP的诊断依据中华医学会消化病学分会胰腺疾病学组2013年提出的《中国急性胰腺炎诊治指南》[5]。ALI/ARDS诊断依据中华医学会重症分会2006年提出的《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南》[6]。胰腺CT分级参考Balthazar CT分级系统[7]。参照Knaus等[8]提出的急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation,APACHEⅡ)评分系统进行APACHE Ⅱ评分。排除标准:既往存在慢性肺部疾病及心功能不全者,糖尿病病人。
三、研究方法
所有纳入研究中的病人入院后均按照SAP治疗原则处理。根据SAP急性反应期是否发生ALI分组:发生者为APALI组;未发生者为N-APALI组。本研究详细整理SAP急性反应期(入院24 h内)两组的各项临床资料,分别进行单因素及多因素分析探寻SAP急性反应期导致ALI的危险因素。
四、统计学方法

结 果
一、SAP并发肺损伤的单因素分析
APALI组39例,N-APALI组56例。老年SAP病人并发肺损伤与年龄、胸腔积液、腹腔感染、体质量指数(BMI)、基础病个数、急性胰腺炎的CT严重度指数(CTIS)、APACHE Ⅱ分值、严重度床边指数(BISAP)评分、中心静脉压(CVP)、红细胞压积(HCT)、血肌酐(SCr)、C反应蛋白(CRP)、血渗透压、降钙素原(PCT)、Ca2+浓度、白蛋白浓度(ALB)、血糖浓度(GLU)具有明显相关性(表1),两组比较差异均具有统计学意义(P均<0.05),其中APALI组的年龄、胸腔积液、腹腔感染、BMI、基础病个数、CTIS、APACHE Ⅱ分值、BISAP评分、HCT、SCr、CRP、血渗透压、PCT、GLU高于N-APALI组,而CVP、Ca2+浓度、ALB浓度低于N-APALI组;中性粒细胞(PMN)、丙氨酸转氨酶(ALT)、血清总胆红素(TBIL)等其他指标两组比较差异均无统计学意义(P均>0.05)。(表1)
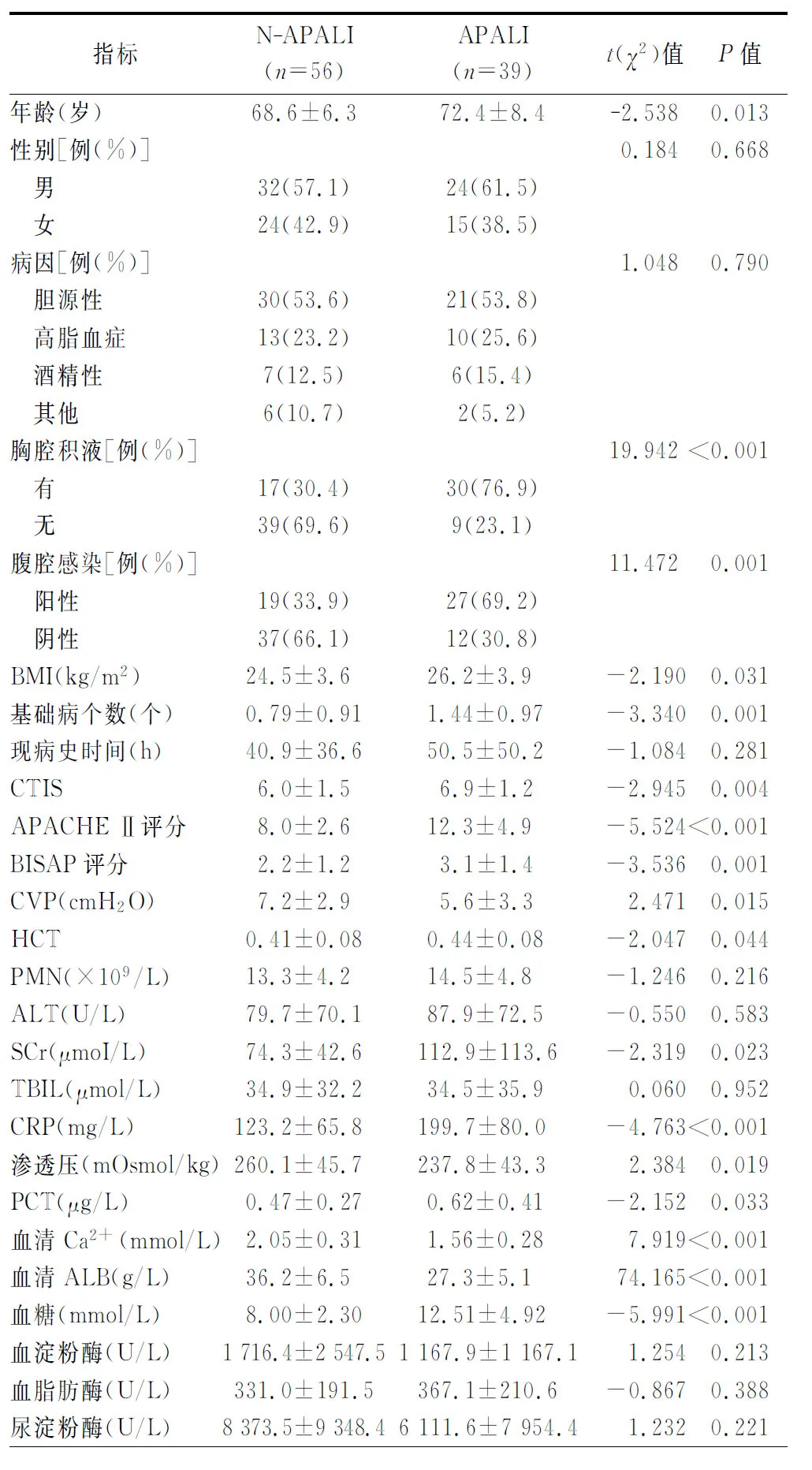
表1 两组病人临床指标单因素分析结果
二、影响APALI的独立危险因素多变量分析结果
通过多因素的Logistic回归分析,CRP、Ca2+、GLU是老年SAP并发ALI的独立危险因素。根据ROC曲线分析,CRP、Ca2+、GLU影响APALI的临界值分别为153.0 mg/L、1.81 mmol/L、9.15 mmol/L。CRP>153.0 mg/L、Ca2+<1.81 mmol/L、GLU>9.15 mmol/L的RR值分别为:7.250、22.500、7.636。详见表2~4。
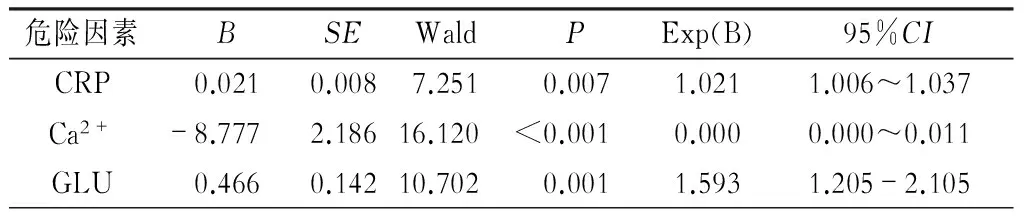
表2 APALI的独立危险因素Logistic回归分析结果
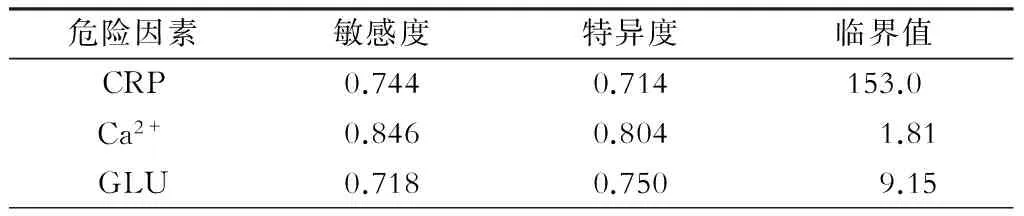
表3 独立危险因素ROC曲线图对临界值的判定
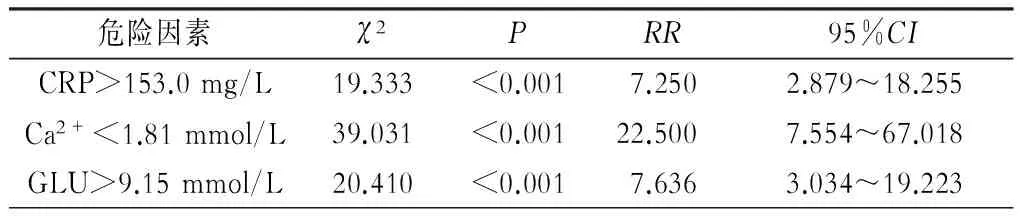
表4 独立危险因素影响APALI发生的相对危险度
讨 论
SAP导致的ALI是极其严重的急性肺部综合征,目前其发病机制尚不明确,且治疗手段的选择是有限的,主要是支持对症性疗法。普遍认为[9]胰腺自我消化在局部产生诸多炎症介质或细胞因子间相互激活,导致肺灌注失常,肺表面活性物质减少,引起肺的微循环障碍,造成弥漫性肺间质和肺泡水肿,产生ALI。另外肠源性感染及内毒素的产生,进入肺毛细血管网激活组织和免疫细胞,低血容量休克使肺毛细血管和肺泡产生缺氧性损伤等,最终形成ALI[10]。老年病人因其体质的特殊性,机能退化,合并症多;APALI的发生具有自身特点,所以老年病人预后情况差于青壮年病人[11]。因此临床诊疗时在老年SAP病人的发病早期,发现引起APALI的危险因素,采取积极干预措施有利于疾病的救治。
本研究资料显示,95例老年SAP病人发生ALI/ARDS共39例(41.1%),其中ARDS发生16例,占ALI的41.0%。通过对单因素分析,ALI/ARDS易患的临床因素较多,主要有年龄、胸腔积液、BMI、CT评分、基础疾病、血糖、Ca2+、BISAP评分、CVP、HCT、SCr、CRP、白蛋白、PCT、渗透压、APACHEⅡ分值等为常见。进行多因素回归分析显示CRP升高、钙离子浓度降低、血糖浓度升高是老年SAP病人发生ALI/ARDS的独立危险因素。
目前 SAP导致ALI的发病机制暂未阐明,公认的可能机制是胰酶的激活导致细胞因子及炎症介质的释放,启动全身炎症反应综合征(SIRS)进一步激活机体炎症细胞因子过度释放,肺内炎性介质和抗炎介质的平衡失调,使得肺泡毛细血管通透性增加,肺泡腔内大量液体积聚,导致肺脏损害[12]。目前国内外均有研究[13-14]显示CRP作为炎症急性时相反应的一个灵敏的指标,可作为预测ALI/ARDS。本研究结果N-APALI组与APALI组的CRP值分别为(123.2±65.8) mg/L、(199.7±80.0) mg/L,两组比较差异具有统计学意义(P<0.05)。 CRP升高>153.0 mg/L时ALI/ARDS的发生危险度是CRP≤153.0 mg/L的7倍多。CRP是在感染和组织损伤时血浆浓度快速、急剧升高的主要的急性期蛋白,当SAP发生时SIRS启动,CRP升高,检测CRP 的水平高低能够间接反映AP的严重程度以及评估其预后[15-16],CRP的升高是SAP炎症反应的综合结果,本研究证实其为ALI/ARDS发生的独立危险因素,而往往持续升高的CRP值表示炎症无好转,常是治疗失败和预后差的提示,所以SAP脏器功能支持时控制炎症反应的发展是一个必要手段,并且针对急性胰腺炎免疫状态所提出的免疫调节治疗有望提高急性胰腺炎预后[17]。
陈秋星等[18]研究表明血钙离子浓度的降低是APALI的独立危险因素,通过本研究分析在老年SAP病人并发ALI结论与之相符,Ca2+<1.81 mmol/L并发ALI的危险性是Ca2+≥1.81 mmol/L的22.5倍。考虑其机制[19-20]:细胞内一般为低钙稳态,依靠胞膜及细胞器如内质网、线粒体等调节Ca2+转运。SAP时大量胰酶及内毒素释放经网膜吸收进入血液,随循环系统到达肺脏,直接破坏肺泡细胞膜和膜上Ca2+-ATPase受抑,导致大量Ca2+内流造成钙超载,故而血清钙离子下降,进一步激活磷脂酶、核酸内切酶、自由基等损害肺脏组织结构,再者Ca2+内流还可导致ATP能量耗竭,从而引起ALI。
本研究结果显示N-APALI组与APALI组血糖分别是(8.00±2.30) mmol/L、(12.51±4.92) mmol/L,两组差异具有统计学意义(t=-5.991,P<0.05),随着血糖的升高,ALI/ARDS的发生率升高,临界值为9.15 mmol/L,RR值7.636。急性胰腺炎时胰岛细胞分泌异常:β细胞分泌与排泄胰岛素减少、α细胞分泌胰高血糖素增多,促进糖原分解和糖异生作用,机体应激反应产生胰岛素抵抗,血糖呈一过性升高。血糖升高引起糖化血红蛋白形成增多,氧合血红蛋白解离困难,从而使SAP时组织器官缺氧加重[21-22]。另外血糖水平与AP过程中的炎症反应关系密切,可通过激发体内的炎症反应进而影响病情的发展[23],故而持续高血糖状态影响SAP病人各脏器的功能状态。大多数研究表明,持续的高血糖状态恶化病情,病死率更高,预后更差,高血糖也是SAP发生多脏器功能衰竭的独立危险因素[24-25]。临床治疗中控制血糖水平是一项重要的工作。
SAP时ALI的发病机制是非常复杂的,老年SAP病人由于本身体质的原因,影响因素较多,临床工作中重视急性期ALI的独立危险因素有助于SAP的治疗和恢复。
1 Vege SS,Gardner TB,Chari ST,et al.Low mortality and high morbidity in severe acute pancreatitis without organ failure:a case for revising the Atlanta classification to include"moderately severe acute pancreatitis".Am J Gastroenterol,2009,104:710-715.DOI: 10.1038/ajg.2008.77.
2 Marsboom G,Janssens S.Endothelial progenitor cells:new perspectives and applications in cardiovascular therapies.Expert Rev Cardiovasc Ther,2008,6:687-701.DOI:10.1586/14779072.6.5.687.
3 Akbarshahi H, Rosendahl AH, Westergren-Thorsson G,et al.Acute lung injury in acute pancreatitis--awaiting the big leap. Respir Med,2012,106:1199-1210.DOI: 10.1016/j.rmed.2012.06.003.
4 殷静静,郑瑞强,林华,等.老年重症急性胰腺炎的病因及严重程度的早期评估.医学伦理与实践,2016,29:3037-3039.DOI: 10.19381/j.issn.1001-7585.2016.22.007.
5 中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(2013,上海).中华消化杂志,2013,33:217-222.DOI: 10.3760/cma.j.issn.0254-1432.2013.04.001.
6 中华医学会重症医学分会.急性肺损伤/急性呼吸窘迫综合征诊断及治疗指南.中国危重病急救医学,2006,18:706-710.
7 Balthazar EJ,Robinson DL,Megibow AJ,et al.Acute pancreatitis:value of CT in establishing prognosis.Radiology,1990,174:331-336.DOI:10.1148/radiology.174.2.2296641.
8 Knaus WA,Draper EA,Wagner DP,et al.APACHE Ⅱ: a severity of disease classification system. Critical Care Med,1985,13:818-829.
9 Fedorkiv MB,Hudz IM,Shevchuk IM,et al.Prognostication of acute-pancreatitis associated pulmonary injury based ondetermination 0f cytokines levels.Klin Khir,2013,7:28-30.
10AS Elder,GT Saccone,DL Dixon.Lung injury in acute pancreatitis: Mechanisms underlying augmented secondary injury.Pancreatology,2012,12:49-56.DOI:10.1016/j.pan.2011.12.012.
11章小山.重症急性胰腺炎病人发生急性期急性肺损伤的危险因素分析.中国临床新医学,2016,9:900-903.DOI:10.3969/j.issn.1674-3806.2016.10.17.
12williams AE,Chambers RC. The mercurial nature of neutrophils:still an enigma in ARDS?.Am J Physiol Lung cell MolPhysiol,2014,306:1217-230.DOI:10.1152/ajplung.00311.
13欧阳艳红,宋维,刘元税.乌司他汀辅助治疗重症肺炎的临床评价.中国微生态学杂志,2011,8:65-67.
14Fang Y,Xu P,Gu C.Ulinastatin improves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory responsel.J Trauma,2011,71:1297-1304.
15Nistal M, Zoltani M, Lohse AW, et al. Analysis of the power of common diagnostic tools in the management of acute pancreatitis. Gastronomical Res Pract,2014,2014: 438697.DOI:10.1155/2014/438697.
16张翔,陈洪娇,王雅纯,等.重症急性胰腺炎后期感染性胰腺坏死危险因素的临床研究.中国现代医学杂志,2016,26:115-118. DOI:10.3969/j.issn.1005-8982.2016.04.025.
17曹军强,汤礼军.全身炎症反应综合征在急性胰腺炎肺损伤中的研究进展.中华消化外科杂志,2015,14:975-979.DOI: 10.3760/cma.j.issn.1673-9752.2015.11.019.
18陈秋星,吕德超,曹斌,等.重症急性胰腺炎并发急性肺损伤危险因素的临床分析.肝胆胰外科杂志,2012,24:451-454,458.DOI: 10.3969/j.issn.1007-1954.2012.06.004.
19张喜平,吴承军,李志军.重症急性胰腺炎并发肺损伤的研究进展.世界华人消化杂志,2008,16:299-306.DOI: 10.3969/j.issn.1009-3079.2008.03.013.
20尚涛,李立萍,张建新.线粒体与急性肺损伤.河北医药,2007,29:367-369.
21潘涛,黄蕾,冉红梅,等.重症急性胰腺炎并发胰腺炎关肺损伤的危险因素分析.实用医院临床杂志,2013,10:91-94.
22李祖铭.急性胰腺炎病人血清白蛋白、葡萄糖、钙水平的变化及临床意义.内科急危重症杂志,2010,16:149-150.DOI:10.3969/j.issn.1007-1024.2010.03.013.
23刘娜娜,李静,安鼎.急性胰腺炎病情发展与血糖水平的相关性.医学与哲学,2015,36(5B):36-38.
24路琴,付万发.老年急性胰腺炎160例病人预后及其危险因素分析.中华老年多器官疾病杂志,2013,12:60-62.DOI:10.3724/SP.J.1264.2013.00016.
25余贤恩,黄培宁,王三亨.肥胖和入院时高血糖对急性胰腺炎发生器官衰竭的预测作用.胃肠病学和肝病学杂志,2011,20:187-189.
