结直肠腺瘤基因低甲基化谱分析及其标记物的筛选研究*
2018-03-09何纯刚黄沁园钟世彪陈利生肖和卫
何纯刚 黄沁园 钟世彪 陈利生 肖和卫 李 雷
(1广西壮族自治区人民医院 广西南宁 530021;2广西医科大学护理学院 广西南宁 530021;3广西壮族自治区民族医院 广西南宁 530021;4广西医科大学第一附属医院 广西南宁 530021)
目前公认“正常黏膜—结直肠腺瘤—结直肠癌”是散发性结直肠癌的发病机制之一,甲基化(包括高甲基化及低甲基化)是肿瘤中表观遗传学改变最常见的类型之一,目前研究最深入的是抑癌基因启动子甲基化的研究,但关于基因低甲基化在结直肠腺瘤中的作用机制尚未完全明确。因此,本研究采用全基因组甲基化芯片分析结直肠腺瘤低甲基化谱,并寻找基因低甲基化标记物,为进一步研究结直肠腺瘤发生发展的分子机制及早期诊断提供依据,现报告如下。
1 资料与方法
1.1 研究对象 本研究中,组织标本源自2013年1月至2014年12月于广西医科大学第一附属医院结直肠肛门外科及广西壮族自治区人民医院住院患者,共收集29例标本:包括9例内镜下切除的结直肠腺瘤标本(直径≥2 cm)及20例结直肠黏膜标本(经肠镜排除炎症性肠疾病、癌前病变及癌)作正常对照组。在9例腺瘤患者中男性4例,女性5例,中位年龄53岁;部位:结肠7例,直肠2例;病理类型:绒毛状腺瘤2例,管状绒毛状腺瘤3例,管状腺瘤4例,均无癌变。收集的标本直接放入-80℃冰箱中保存。本研究收集标本已获得患者同意,研究获得广西壮族自治区人民医院伦理委员会批准。
1.2 DNA提取及亚硫酸氢盐修饰转化 组织DNA的提取按照 QIAamp DNA mini kit(Qiagen,Hidden,Germany)试剂盒说明书进行,提取的DNA质量检测、定量、DNA亚硫酸氢盐修饰转化按照Zymo EZ DNA Methylation kit(Zymo Research,CA,USA)说明书进行。
1.3 450K甲基化芯片分析 所有经亚硫酸氢盐修饰的DNA样本均采用450K甲基化芯片(Illumina,San Diego,Ca,USA)按操作说明进行。每个样本重复三次,芯片用Illumina HiScan SQ scanner进行扫描。
1.4 统计分析
1.4.1 结直肠腺瘤甲基化芯片原始数据处理及差异低甲基化谱分析 采用genomestudio(genomestudio software 2011.1,Illumina)软件进行芯片原始数据的提取、质量控制分析、校正。每个CpG位点的甲基化程度用 AVG_Beta值(数值为 0~1)来表示,Δβ代表腺瘤与正常对照组CpG位点的差异甲基化程度(数值为-1~1),Δβ大于0.17视为高甲基化,小于-0.17视为低甲基化,Δβ绝对值越大,其差异甲基化程度越高。对筛选出来的低甲基化标记物在基因组中的分布进行描述性分析。
1.4.2 差异低甲基化基因的功能分析 GO包括三大功能注释类别:生物过程、细胞成分、分子功能。采用DAVID在线分析的方法(https://david.ncifcrf.gov/home.jsp)[1-2]对差异低甲基化基因进行GO分析,统计每个GO条目中所包括的差异基因个数,并用统计检验的方法计算每个GO条目中差异基因富集的显著性。计算的结果会返回一个富集显著性的P值,P<0.05表示差异基因在该GO条目中出现了富集。通过KEGG_pathyway分析,统计每个信号通路条目中所包括的差异基因个数,并用统计检验的方法计算每个信号通路条目中差异基因富集的显著性,P<0.05提示差异基因在该信号通路中出现富集,可能参与了该信号通路的作用。
1.4.3 差异低甲基化基因标记物的筛选 为从庞大的差异甲基化位点中筛选出具有可重复性研究、具有一定功能及诊断价值的差异低甲基化基因作为标记物,参照文献[3],结合本实验甲基化芯片数据,按如下条件筛选低甲基化基因标记物:腺瘤与正常组差异甲基化程度Δβ≤-0.4,腺瘤组中平均甲基化水平β≤0.2,标记物基因位于GO分析及KEGG_pathyway分析任意前三位条目之一。
2 结 果
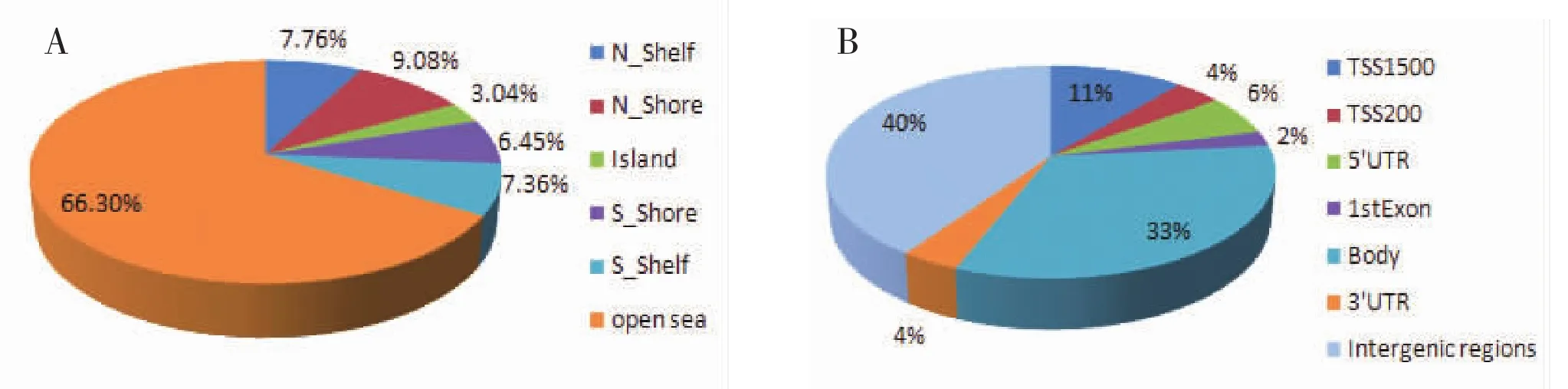
图1 低甲基化标记物在CpG岛相关区域及基因结构中的分布

表1 结直肠腺瘤中差异低甲基化基因GO分析
2.1 结直肠腺瘤差异低甲基化谱分析结果 在本研究中,450K甲基化芯片共可检测的甲基化位点为485 577个,根据|Δβ|≥0.17视为差异甲基化标记物,整个基因组中共发现65 535(13.6%)个差异甲基化位点,40 071(61.14%)个为低甲基化位点,其中66.3%的低甲基化位点主要分布于CpG岛相关区域以外的区域 (Open sea)(图1-A),在基因结构分析中,40%、37%、33%的低甲基化位点分别分布于基因间隔区域(Intergenic region)、基因内区域(Body 及3'UTR) 及启动子区 (包括TSS1500,TSS200,5'UTR及 1stExon)(图 1-B)。
2.2 GO分析及KEGG_pathyway分析结果 考虑|Δβ|≥0.17筛选出来的差异甲基化标记物较多,本研究参照文献[4]进一步设Δβ≤-0.4,在腺瘤组织中共发现912个差异低甲基化标记物,其中包含584个差异低甲基化基因。对上述基因进行GO分析结果提示在生物进程功能注释类别中,差异低甲基化基因主要富集前3位条目的有细胞粘附、与化学刺激有关的嗅觉觉察及化学突触传递;在分子功能注释类别中,差异低甲基化基因主要富集前3位条目的有钙离子结合、G蛋白偶联受体活性及嗅觉受体活性;在细胞成分注释类别中,主要富集前三位条目的有质膜、蛋白质的细胞外基质及质膜的整体组成部分,见表1。KEGG_pathyway分析结果表明,差异低甲基化基因主要主要在嗅觉转导、逆行内源性大麻素信号、神经活性配体-受体相互作用等信号转导通路中出现富集,见表2。
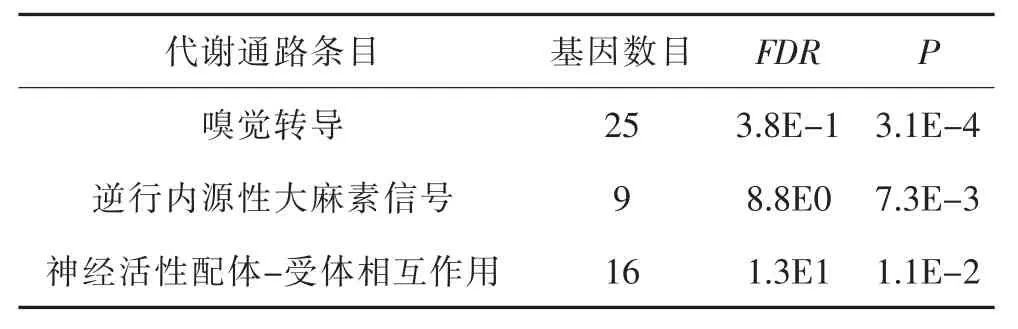
表2 结直肠腺瘤中差异低甲基化基因KEGG_pathyway分析
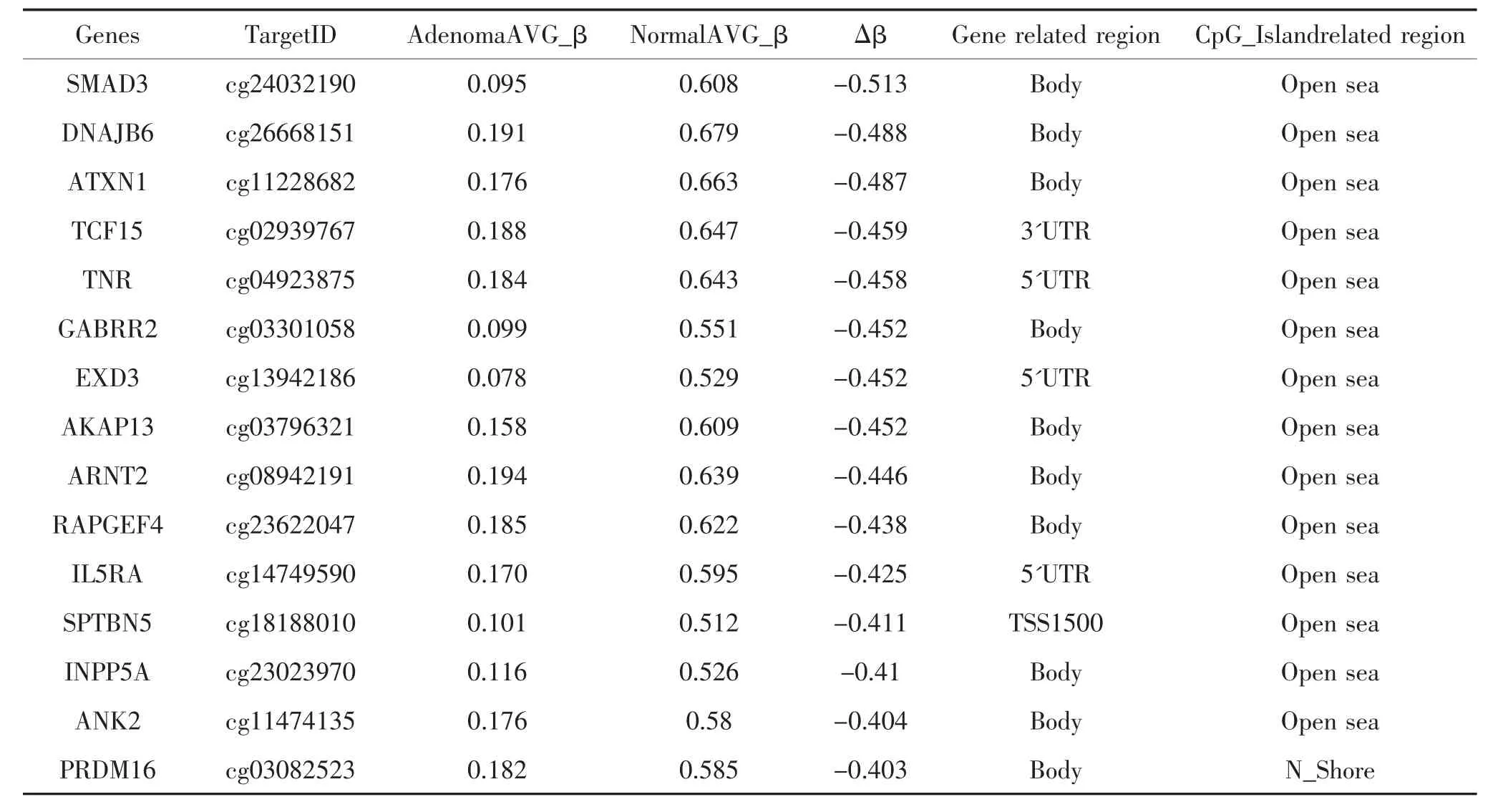
表3 筛选出来的低甲基化基因标记物
2.3 低甲基化基因标记物的筛选 在Δβ≤-0.4的912个差异低甲基化CpG位点中,考虑到具有诊断价值的标记物需要满足|Δβ|尽可能大,腺瘤组β尽可能最小,同时基因标记物需要具有一定功能或可能参与某些信号通路。基于上述条件,我们进一步按腺瘤组中平均β≤0.2共筛选出28个低甲基化基因;具有GO、KEGG_pathyway分析符合任何前3个条目之一的标记物一共有15个基因,分别是:SMAD3、DNAJB6、ATXN1、TCF15、TNR、GABRR2、EXD3、AKAP13、ARNT2、RAPGEF4、IL5RA、SPTBN5、INPP5A、ANK2、PRDM16,见表 3。
3 讨 论
研究表明,结直肠癌是发达国家最常见的恶性肿瘤之一,中国结直肠癌新发病例占全球的18.6%,结直肠癌居中国人群恶性肿瘤死因顺位第五位[4]。在过去数十年,研究发现一系列的基因遗传学、表观遗传学改变导致了结直肠癌的发生发展[3]。研究表明,“正常黏膜—腺瘤—癌—癌转移”是散发性结直肠癌发生发展的主要途径,同时在这个过程中发生一系列基因及表观遗传学改变事件累积作用的结果[5-6]。研究表明,DNA异常甲基化 (包括高甲基化及低甲基化状态)在结直肠腺瘤中广泛存在,随着众多异常甲基化基因被发现,表明基因表观遗传的改变作为频发的早期事件可能影响了结直肠腺瘤向癌转变,同时也可能成为早期诊断的标记物[5,7-9]。然而传统的研究方法主要局限于单个基因的发现及检测,无法了解整个基因组的甲基化状态,目前对于结直肠腺瘤及癌的发病机制、早期诊断、风险评估均存在不足[3]。近年来研究表明,甲基化芯片 (Illumina Infinium 450K)检测技术是一种基于全基因组甲基化检测分析方法,其检测功能强大,具有高通量、高灵敏度的特点,检测范围涵盖了485 000个CpG位点,同时具有精确度高、重复性好的优点[10-11]。目前已有文献报道采用Illumina Infinium 450K甲基化芯片在结直肠腺瘤及癌中检测,获得了许多新的甲基化标记物[3]。
目前对于甲基化在肿瘤中的研究最深入的是抑癌基因启动子甲基化的研究,启动子高甲基化可以影响很多种细胞通路,在肿瘤的发生发展中起重要作用[11]。虽然有文献报道在散发性结直肠癌及腺瘤组织中广泛观察到基因组DNA低甲基化[3]、低甲基化与预后不良有关[13],在基因CpG岛DNA低甲基化可能诱导基因异常表达并有助于在结直肠癌中获得侵袭性的肿瘤行为[14],但对于低甲基化在结直肠腺瘤向癌转变过程中的作用机制目前研究仍甚少。
本研究通过芯片数据结合生物信息学的分析方法,重点分析了结直肠腺瘤中的低甲基谱,与正常组对比,共发现40 071个差异低甲基化位点,主要分布于CpG岛以外的区域或位于非启动子区,与文献报道相符[4],提示异常低甲基化状态可能参与了结直肠腺瘤的发病过程。将腺瘤与正常组比较的差异甲基化程度Δβ≤-0.4后,发现912个差异低甲基化位点,涵盖584个基因,对上述基因进行GO分析、KEGG_pathyway分析发现,差异低甲基化基因涵盖了许多不同的功能群落(见表1),并在多种信号通路中出现富集(见表2),提示在腺瘤的发生及发展中,有多种类型的基因参与多种信号转导通路调控,但具体机制有待进一步深入研究。本实验进一步筛选出了15个具有功能的低甲基化相关基因作为标记物,其在腺瘤组中甲基化程度非常低,在正常组中甲基化程度较高(见表3),提示有可能作为甲基化标记物用于结直肠腺瘤的早期诊断。
综上所述,使用全基因组甲基化芯片来探究结直肠腺瘤相关的新型甲基化标志物,可能有助于提高对异常低甲基化和其分子机制在结直肠腺瘤发病机制中的作用的理解。下一步我们对其差异甲基化水平将采用焦磷酸测序的方法在结直肠腺瘤组织中做进一步鉴定,为结直肠腺瘤发病机制的研究及早期诊断提供更多线索。
[1]HUANG DA W,SHERMAN B T,LEMPICKI R A.Bioinformatics enrichment tools:paths toward the comprehensive functional analysis of large gene lists[J].Nucleic acids research, 2009,37(1):1-13.
[2]HUANG DA W,SHERMAN B T,LEMPICKI R A.Systematic andintegrativeanalysisoflargegenelistsusingDAVIDbioinformatics resources[J].Nature protocols,2009;4(1):44-57.
[3]NAUMOVVA,GENEROZOVEV,ZAHARJEVSKAYANB,et al.Genome-scale analysis of DNA methylation in colorectal cancer using Infinium HumanMethylation450 Bead-Chips[J].Epigenetics,2013,8(9):921-934.
[4]冯雅靖,王宁,方利文,等.1990年与2013年中国人群结直肠癌疾病负担分析[J].中华流行病学杂志,2016,37(6):768-772.
[5]ALEXANDER M,BURCH J B,STECK S E,et al.Casecontrol study of candidate gene methylation and adenomatouspolypformation[J].Internationaljournalofcolorectaldisease, 2017,32(2):183-192.
[6]CARETHERS J M, JUNG B H.Genetics and Genetic Biomar-kers in Sporadic Colorectal Cancer[J].Gastroenterology,2015,149(5):1177-1190.
[7]LEE B B, LEE E J, JUNG E N, et al.Aberrant methylation of APC, MGMT, RASSF2A, and Wif-1 genes in plasma as a biomarker for early detection of colorectal cancer[J].Clinical cancer research:an official journal of the American Association for Cancer Research,2009,15 (19):6185-6191.
[8]LAO V V,GRADY W M.Epigenetics and colorectal cancer[J].Nature reviews Gastroenterology&hepatology, 2011,8(12):686-700.
[9]HE C G, HUANG Q Y, CHEN L S,et al.p33ING1b methylati-on in fecal DNA as a molecular screening tool for colorectal cancer and precancerous lesions [J].Oncol Lett,2014,7(5):1639-1644.
[10]DEDEURWAERDER S, DEFRANCE M, CALONNE E,et al.Evaluation of the Infinium Methylation 450K technology[J].Epigenomics,2011,3(6):771-784.
[10]SANDOVAL J, HEYN H, MORAN S, et al.Validation of a DNA methylation microarray for 450,000 CpG sites in the human genome[J].Epigenetics,2011,6(6):692-702.
[12]陈伟,王磊,叶俊文,等.基于生物芯片检测结直肠癌相关基因的甲基化[J].中山大学学报(医学科学版),2014,35(6):920-924.
[13]OGINO S,NOSHO K,MEYERHARDT J A,et al.Cohort study of fatty acid synthase expression and patient survival in colon cancer[J].Journal of clinical oncology:official journal of the American Society of Clinical Oncology,2008,26(35):5713-5720.
[14]KATO K, MAESAWA C, ITABASHI T, et al.DNA hypomethylation at the CpG island is involved in aberrant expression of the L1 cell adhesion molecule gene in colorectal cancer[J].Int J Oncol,2009,35(3):467-476.
