蛋白质组学技术的合理运用于食管癌治疗的双盲性临床价值
2018-03-08郝婷婷刘修莉
杨 宏 周 俊 郝婷婷 刘修莉
食管癌是原发于食道的恶性肿瘤,以鳞状上皮癌最为多见,癌前病变具有双向发展的不稳定性生物学特征[1],但由于早期症状的不明显,确诊时候已经到达了中晚期的程度。西妥昔单抗作为蛋白质组学技术的新兴产物,是一种人/鼠嵌合型IgG单克隆抗体[2],通过特异性结合于表皮生长因子(EGF),从而阻止配体与其结合而阻断受体二聚化和信号传导来抑制肿瘤的增殖、转移,促进肿瘤细胞衰亡,已在临床取得卓越的效果。本文通过对比观察滴注西妥昔单抗和顺铂治疗后的缓解率以及血清指标,希望可以提供有用的临床价值。
1 材料与方法
1.1 临床资料
选取2016年4月到2016年10月我院收治的且经过临床病理检查证实且需要接受治疗的33例食管癌患者,男性23例,女性10例,年龄38~62岁,平均年龄(52.63±2.5)岁,10例患者肿瘤仅浸润浅层肌、黏膜层或黏膜下层,12例患者肿瘤浸润固有肌层,11例患者肿瘤浸润纤维膜;患者中出现淋巴结转移18例,无淋巴结转移15例;病理分级:低分化型10例,中分化型14例,高分化型9例;病理分期按照国际TNM临床分期[3]:Ⅰ期10例,Ⅱ期14例,Ⅲ期9例。按1∶2的比例将患者随机分配至顺铂治疗对照组和西妥昔单抗治疗试验组。对照组11例,男性5例、女性6例,平均年龄(51.23±4.2)岁;病理分期:Ⅰ期4例,Ⅱ期5例,Ⅲ期2例。试验组22例,男性18例、女性4例,平均年龄(55.17±2.4)岁;Ⅰ期6例,Ⅱ期9例,Ⅲ期7例。2组患者的基本资料经过统计学处理,无明显差异,具有可比性。该实验已征得我院伦理协会同意,患者及家属知情同意并签字。
1.1.1 纳入标准 经过病理检查确诊患有食管癌,KPS评分≥60分,预计生存时间≥5个月,病理分期Ⅰ期~Ⅲ期,依从性高,有可评估和和可测量病灶,肝肾功能以及骨髓储备正常,可随访,同意随机分组,签订正式知情同意书的患者。
1.1.2 排除标准 有且仅有不可测量病灶,食管多中心病变,无自知力脑转移患者,依从性差,患有第二原发恶性肿瘤并未愈合者,具有严重无法控制的内科疾病,肝肾功能异常者,已进行过手术或放疗,怀孕期或泌乳期,无法签订正式知情同意书的患者。
1.2 研究方法
根据双盲实验分组法则按1∶2的比例随机分为2组:顺铂联合5-fu治疗组(对照组11例),西妥昔单抗治疗组(22例),2组均治疗3周。2组患者治疗前后均接受模拟CT和食管钡餐X片;并于治疗前和治疗后5天空腹状态下采血,分离血清测定CYFRA21-1和SCC,并观察分析2组数据。
1.3 治疗方法
对照组给予顺铂30 mg/m22 h,d1,5-fu 500 mg/m2,静脉推注d1~d5,21 d为1个周期[4]。
试验组给予西妥昔单抗400 mg/m2(静脉滴注120 min),其后每周给药250 mg/m2,每次给药前常规给予西咪替丁0.4 g静脉滴注或非那根25 mg肌肉注射,地塞米松5 mg静脉滴注以预防过敏反应[5]。
1.4 检查方法
本组病例各项检查采用双盲法,即EUS检查者、治疗者、病理检查者均独立操作并做出诊断以保持客观性。患者于治疗前后空腹采血后测量血清SCC并通过微粒子酶联免疫测定法测定治疗前后的数据,治疗前后空腹采血后测量CYFRA21-1并采用罗氏电化学发光免疫分析法[6]分析治疗前后的数值。使用低温医用热塑记忆体膜固定体位后在增强扫描和定位时使用模拟CT以5 mm层厚连续扫描由下颌至肝部上缘并配合食管钡餐正侧点位X光片分别测出肿瘤的直短径以及肿瘤基线,以直短径的乘积确定肿瘤体积的大小。
1.5 观察指标
根据WHO的实体肿瘤客观疗效标准评价西医疗效[7]:对比分析2组的影像学报告判断肿瘤的体积大小、边界和是否出现周围浸润和淋巴结转移以及远端转移,检测治疗前后血清SCC以及CYCYFRA21-1值来观测治疗的具体效果。
1.6 疗效标准
参照WHO西医疗效评价标准[8]:通过模拟CT和食管钡餐X片测定肿瘤直径和短径的乘积判断肿瘤的大小。完全缓解(CR):所有目标病灶消失且维持时时间≥4周;部分缓解(PR):肿瘤直径可见缩小,且缩小程度≥1/2,维持时间≥4周;无变化(NC);进展(PD):原靶病灶长径总和增大20%且原靶病灶长径总和绝对值增大5 mm,或者出现新病灶和淋巴结转移或远端转移;稳定(SD): 基线病灶长径总和略有缩小但未达到PR或者略有增加但未达PD,且维持时间<4周。
1.7 统计学方法

2 结果
2.1 2组西医疗效
西医疗效对照组有效率为45.3%,试验组54.5%,差异具有统计学意义(P<0.05),见表1。
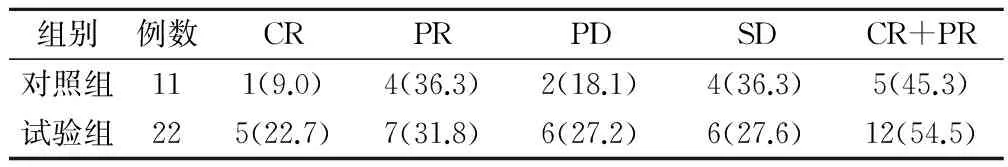
表1 2组西医疗效比较(例,%)
2.2 2组患者治疗前后血清SCC和CYFRA21-1均值比较
2组患者在接受治疗之后肿瘤标志物在血清中的含量均有所降低,试验组降低的程度较对照组高,具有统计学意义(P<0.05)。见表2。

表2 2组患者治疗前后SCC和CYFRA21-1变化
2.3 治疗后有无淋巴转移患者的SCC以及CYFRA21-1水平
对照组与试验组治疗后未出现淋巴结转移者25例。有无淋巴结转移患者血清SCC、CYFRA21-1水平比较,差异具有统计学意义(P<0.05)。见表3。

表3 有无淋巴结转移患者治疗后SCC以及CYFRA21-1比较
2.4 不良反应
2组患者出现不同程度的WBC下降、贫血、放射性食管炎、腹泻、恶心呕吐、肾功能下降、神经毒性,对照组分别为:27.2%(3/11)、18.8%(2/11)、36.4%(4/11)、45.5(5/11)、36.4%(4/11)、54.5%(6/11)、27.2%(3/11),试验组分别为:13.6%(3/22)、18.8%(4/22)、22.7%(5/22)、36.4%(8/22)、27.3%(6/22)、45.5%(10/22)、36.4%(8/22),各组间不良反应无统计学意义(P>0.05)。总不良反应发生率对照组为36.4%(4/11),试验组为27.3%(6/22),差异具有统计学意义(χ2=1.2,P<0.05)。
3 讨论
食管癌是我国常见的恶性肿瘤之一,病理类型主要为鳞癌(90%以上),早期症状通常不典型,容易被误诊或略诊[9],初步诊断为食管癌时已经失去了手术的机会。但随着医疗技术以及科研人员的不断探索和发现,人类对疾病的研究已经迈进了分子水平的大门,与之相关的蛋白质组学技术也突飞猛进,这为肿瘤的治愈和提供可靠的治疗后评价带来了新的进展。从本质来看,肿瘤是一种由不同且多种基因共同参与的复杂性极高的疾病但其发生发展和转归终究是需要通过蛋白质来实现的,可通过有效地识别、筛查、定位癌症的特异性表达蛋白,来达到疗效快且强,副作用小的目的。Profumo等[10]使用MALDI-TOF质谱分析法发现C3F片段在乳腺癌患者中显著增高,以此来为检测初期乳腺癌提供了有力的依据和指标,Chen等[11]利用蛋白质组学技术验证了识别体蛋白C3为胰腺癌特异性血清标志,殷杰等[12]通过人工合成min-122成熟cDNA序列为肝癌基因沉默治疗提供了新的思路。
本研究中使用西妥昔单抗作为实验药物和SCC以及CYFRA21-1作为预后评价指标进行实验,其主要目的是为了能直观地观测蛋白质组学技术应用于食管癌的临床价值。西妥昔单抗直接作用于受体细胞外区的单克隆抗体,可以阻断肿瘤坏死因子α和EGF(表皮生长因子)与EGFR(表皮生长因子受体)结合,而EGFR为原癌基因的主要表达产物,主要参与癌细胞的增殖、生长、迁移、浸润与存活。西妥昔单抗与EGFR的亲和力为人体内源配体的5~10倍,可以在人体正常细胞以及癌细胞的EGFR的细胞外激酶特异性结合时,竞争性抑制EGFR与其他配体结合,使得受体激酶磷酸化受阻,来实现抑制肿瘤生长、迁移的目的。西妥昔单抗只针对肿瘤的特异性表达蛋白产生靶向作用也使得在治疗后出现的不良反应大大减小,在上述的试验中,实验组患者治疗后的不良反应率远低于对照组患者。相关研究报道指出蛋白质组学技术在靶向性治疗癌症时候,虽然会出现耐药性可能,靶向治疗耐药性患者仍可以接受化疗,一段时间后原本已经耐药的靶向药物,仍然可以发挥作用,这使得癌症患者的生存期得以很大程度的提升。治疗后通过微粒子酶联免疫测定法测定血清SCC的值得出有淋巴结转移的患者SCC水平远高于无淋巴结转移患者,通过电化学发光免疫分析法分析治疗得出有淋巴结转移患者CYFRA21-1均值远高于无淋巴结转移患者,血清SCC和CYFRA21-1的数值可以作为评定治疗后疗效的有力证据,也可以用来判断食管癌患者各阶段的分期。蛋白质组学技术可以说贯穿了整个治疗的始终,也为食管癌的治疗提供了新的途径和方法。
[1] 林称意,原 野,罗卫民,等.TSLC1和 CD105在食管癌组织中表达的临床意义〔J〕.实用癌症杂志,2014,29(3):263-265.
[2] 吕汪霞,马胜林.西妥昔单抗的临床研究新进展〔J〕.医学综述,2010,16(9):1345-1348.
[3] 周志国,甄婵军,梁军利,等.食管癌AJCC/UICC第6、7版TNM分期分段方法在放疗患者中的比较〔J〕.肿瘤防治研究,2015,42(8):772-776.
[4] 刘 芳,杜 瑜.洛铂或顺铂联合5-Fu同步放化疗治疗不能手术的中晚期食管癌的临床观察〔J〕.实用癌症杂志,2016,31(2):212-214.
[5] 陆超敬.西妥昔单抗联合化疗治疗EGFR阳性表达中晚期食管癌患者的疗效分析〔J〕.中国医药指南,2011,9(29):113-114.
[6] 吴正吉,张渝成,徐维凤.血清肿瘤标志物在食管癌诊断中的运用分析〔J〕.实用癌症杂志,2014,29(5):503-505.
[7] 楼 静,洪 亮,余飞龙.晚期消化道肿瘤癌因性疲乏患者应用中医辨证治疗的疗效及生活质量改善状况分析〔J〕.中华中医药学刊,2016,24(1):245-247.
[8] 张贺龙.实体瘤疗效评价标准及演变〔J〕.现代肿瘤医学,2010,18(5):839-841.
[9] 文美玲.三维适行放疗同步GEMOX方案治疗局部晚期食管癌的临床观察〔J〕.中南医学科学杂志,2014,42(3):300-301.
[10] Profumo A,Mangerini R,Rubagotti A,et al.Complement -C3f serum levels may predict breast cancer risk in women with gross cystic disease of the breast〔J〕.J Proteomics,2013,85(5):44-52.
[11] Chen J,Wu W,Tang HK,et al.Analysis of pancreatic cancer peripheral blood by comparative proteomics〔J〕.Zhong hua wai ke za zhi,2013,51(1):62-65.
[12] 殷 杰,杨晓燕,虞 佳,等.miR-122表达载体的构建及其对Bcl-xL,Bcl-2基因的抑制作用〔J〕.中南医学科学杂志,2013,41(1):13-16.
