外泌体在体外对胃癌耐药信息传递作用的研究▲
2018-03-08陈俊强
李 鑫 王 震 邓 雅 赵 昆 陈俊强
(广西医科大学第一附属医院胃肠腺体外科,南宁市 530021)
胃癌是最常见的恶性肿瘤之一,死亡率位居恶性肿瘤的第三位,相关并发症发生率位居第四位[1]。外泌体(exosome,EXOs)是细胞内的多泡体与质膜融合后释放的、直径40~100 nm的囊泡,其中富含各种蛋白质、核酸及其他重要物质。通过这些物质,外泌体成为细胞与微环境之间相互作用的桥梁。在人体内,多种体液如血液、尿液、腹水及羊水中均能检测到外泌体的存在。研究发现,肿瘤微环境中外泌体的含量明显增多,且其中富含热休克蛋白、P53蛋白及磷酸酶等肿瘤调节因子[2];肿瘤细胞分泌的外泌体不但可以促进肿瘤细胞的增殖、侵袭与转移,抑制机体的免疫反应,还能增加肿瘤细胞对化疗药物的耐药性[3-4]。因此,本研究将探讨胃癌耐药细胞株分泌的外泌体是否对胃癌敏感细胞株传递耐药特性。现报告如下。
1 材料与方法
1.1 仪器与材料 胃癌敏感细胞株(SGC-7901)及其阿霉素耐药株(SGC-7901/VCR)(中国科学院细胞库),CO2恒温培养箱(3110,NUNE公司),超净工作台(THM#51013522,Thermo公司),酶标仪(Multiskan FC,Thermo公司),荧光倒置相差显微镜及照相系统(OLYMPUS IX71,奥林巴斯),完全1640培养基及不完全1640培养液,CCK-8(细胞增殖-毒性检测试剂盒,CA1210 Solarbio)长春新碱(KGA8251,凯基生物),超速离心机(Optima L100/90/80,Beckman)。
1.2 细胞培养 将SGC-7901、SGC-7901/VCR细胞接种于完全1640培养基中,在37℃、5 ml/L CO2的细胞培养箱中连续培养与传代,SGC-7901/VCR在含完全1640培养基加1.0 mg/L长春新碱至实验前2周无药物的培养基中培养,以上细胞培养至增殖期分别处理。
1.3 CCK-8法绘制细胞生长曲线 分别取对数期生长的亲代细胞SGC-7901、耐药细胞SGC-7901/VCR和共培养细胞株SGC-7901/VCR/EXO,分别计数,以3×105个的浓度接种于96孔板进行培养,每12 h取6孔,用CCK-8连续测定10次,最终以测定的次数为横轴,每次的吸收光度值的平均值为纵轴,绘制生长曲线,并计算倍增时间。
1.4 细胞外泌体提取与鉴定 细胞在完全1640培养基增殖期更换为不含血清的不完全1640培养基,继续培养24 h后,收集培养基离心,4℃、300 g、10 min,取上清液,4℃、2 000 g、10 min,取上清离心,4℃、10 000 g、30 min,除去培养基中的细胞碎片,留取上清离心,4℃、100 000 g、70 min,得到含有蛋白质的外泌体,用PBS缓冲液重悬外泌体洗涤2遍,得到的沉淀即为细胞外泌体,用40 μL PBS重悬。取20μL外泌体悬液滴加于载样铜网上,静置1 min,吸干液体后静置5 min,于铜网上滴加30 g/L磷钨酸溶液约10 μL,负染5 min,吸干液体,在透射电镜拍照前用白炽灯65℃烘烤约15 min。
1.5 CCK-8法测定胃癌细胞对长春新碱的药物敏感性 SGC-7901细胞,摄取VCR/EXO的SGC-7901细胞、SGC-7901/VCR细胞,于增殖期用2.5 g/L胰蛋白酶消化,加入1640完全培养基形成单细胞悬液,以5 000个细胞分别接种于96孔板,在50 mg/L CO2、37℃条件下培养过夜后,用不同浓度的长春新碱处理48 h后,在酶标仪上选择450 nm波长检测吸光度值。实验重复 3次,每组设3个复孔。
1.6 统计学分析 应用SPSS 17.0软件进行统计分析,计量资料用(x±s)表示,多组间计量资料比较采用方差分析,组间两两比较采用LDS法,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞倍增时间比较 SGC-7901、SGC-7901/VCR和SGC-7901/VCR/EXO细胞倍增时间分别为(31.54±1.37)h、(47.21±1.65)h和(42.89±1.73)h,差异均有统计学意义(F=311.650,P<0.001) 。耐药细胞株和共培养细胞株增长速度明显大于亲代细胞株。见图1。
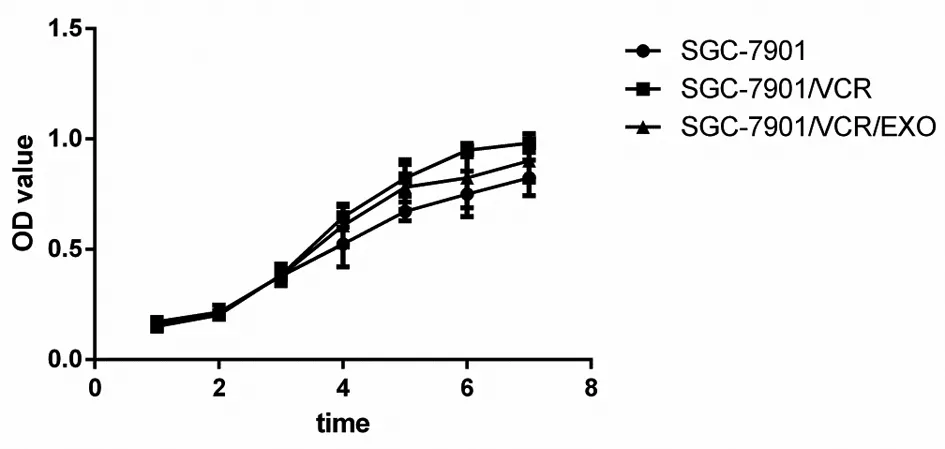
图1 细胞株的生长曲线
2.2 细胞外泌体的形状 投射电子显微镜视野下可观察到外泌体呈典型的椭圆形杯口状结构,直径40~100 nm。见图2。

图2 投射电子显微镜下外泌体形态
2.3 不同细胞株显微镜下形态比较 用耐药细胞株外泌体共培养的细胞SGC-7901/VCR/EXO形态和亲代细胞SGC-7901相比发生了明显的改变,其细胞形态不如亲代细胞圆滑,向棱角分明的耐药细胞形态转变。见图3。

图A SGC-7901
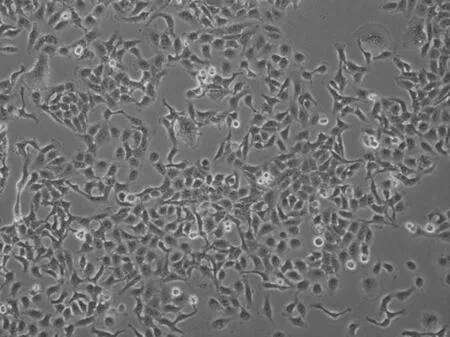
图B SGC-7901/VCR/EXO
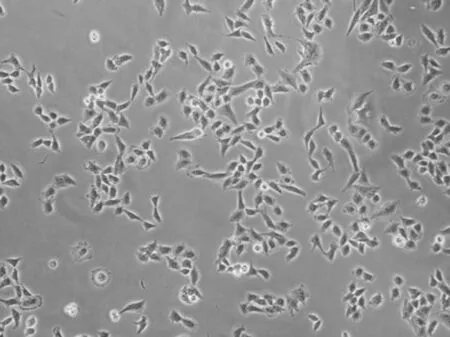
图C SGC-7901/VCR
2.4 药物敏感性分析 CCK-8实验结果显示,敏感细胞株SGC-7901对长春新碱的IC50为2.58 μg/mL,耐药细胞株SGC-7901/VCR对长春新碱的IC50为12.65 μg/mL,耐药细胞株SGC-7901/VCR的耐药指数为4.90。与VCR/EXO共培养后敏感细胞株SGC-7901细胞对长春新碱的IC50为6.54 μg/mL,耐药性提高了2.53倍。
3 讨 论
胃癌的治疗,目前主张是以手术为主,以放、化疗为辅的综合治疗。其中,术后辅助化疗已经成为进展期胃癌标准治疗方案的一部分。近几年的研究发现,围术期化疗不仅能改善胃癌患者的生活质量,还能延长生存期[5]。但胃癌的化疗并未达到预期的治疗效果,其主要原因为化疗耐药。因此,胃癌化疗的耐药性是困扰临床医师的一个重要难题。文献报道有超过50%的胃癌患者存在耐药现象[6],细胞外泌体(exosome)作为细胞间的新型通讯工具,随着对其组分和功能的深入了解,其在耐药中的作用越来越引起人们的重视。Lv等[7]在乳腺癌中发现了多西他赛耐药的细胞株所分泌的外泌体,其作用于多西他赛敏感的细胞株后,敏感细胞株对多西他赛的耐药性增强;进一步对耐药细胞株分泌的外泌体进行检测,发现其中P-糖蛋白含量增加。
肿瘤微环境是指肿瘤在其发生发展过程中所处的内环境,其具有组织缺氧、低pH(酸中毒)、间质高压形成、产生大量生长因子、细胞趋化因子和蛋白水解酶等,从而具有激发免疫炎性反应等特点。组织缺氧可激发肿瘤一系列的适应过程,诱导恶性表型的发展,促进肿瘤细胞耐药[8]。而肿瘤细胞分泌的外泌体,是肿瘤微环境的重要组成部分。肿瘤在发生和发展过程中,由于自身和环境的影响,会产生不同程度的异质性。肿瘤的异质性表现在同一瘤体内的不同肿瘤细胞对化疗药物的敏感性不一致;依据化疗敏感性对肿瘤细胞进行分类,可以分为耐药细胞和敏感细胞。研究表明,这种存在于肿瘤细胞之间对化疗药物敏感性的不一致性,可以在细胞之间相互传递,从而使敏感细胞获得耐药性。外泌体内存在大量的非编码RNA和蛋白等物质,在这种耐药性的传递中起着重要作用。
miRNA在外泌体诱导耐药中发挥着重要作用,Chen等[9-11]研究表明,多西他赛耐药的乳腺癌细胞株MCF-7相比于敏感株,miRNAs(miR-196a、miR-21、miR-29a、miR-29a/miR-100和MiR-30a)升高,多西他赛耐药株细胞外泌体作用与敏感细胞能显著提高敏感株的耐药性。Challagundla等[12]报道,成神经细胞瘤(NBL)释放的外泌体富含miR-21,将此外泌体和单核细胞共培养后注入此单核细胞与荷瘤小鼠,明显增加了荷瘤小鼠对顺铂的抵抗。Liu等[13]研究发现,调节胃癌细胞内CD97 的表达可以影响胃癌细胞的增殖与淋巴结转移,进一步研究发现,这种调控作用是通过肿瘤细胞分泌的外泌体实现的。
蛋白也在外泌体诱导耐药中参与作用,外泌体可以将转运多耐(multi-drugresistance,MDR)蛋白质转运到敏感的受体细胞内来诱导或者增强敏感细胞的耐药性[14],同时也可以通过MDR蛋白质包裹肿瘤内药物,介导药物的外派而降低药效。研究表明,耐药细胞株分泌的外泌体中的耐药蛋白annexin A3和敏感株相比显著增加[15]。MDR-associated ATP-binding cas-sette transporter(MDR-ABC)转运系统的激活介导药物的外排[16],是包括P-糖蛋白、MDR相关蛋白1和乳腺癌耐药蛋白等一类具有相同跨膜结构的转运蛋白。Ji等[17]研究发现,胃癌间充质干细胞分泌的外泌体可以通过激活CaM-Ks/Raf/MEK/ERK 信号通路而影响胃癌细胞对5-Fu等化疗药物的敏感性。
综上所述,肿瘤耐药是一个多因素多步骤的过程,是肿瘤细胞和肿瘤微环境相互作用的结果。本研究只是提示了外泌体在胃癌敏感细胞株SGC-7901的耐药上发挥了作用,但是进一步的机制尚在探索当中。目前关于外泌体参与耐药的研究已经证实,但在体内产生的影响仍然未知,需要我们进一步去研究,这或可为肿瘤的化疗耐药提供新思路,成为化疗耐药的新靶点。
[1] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide: Sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015(5):E359-E386.
[2] Yu DD,Wu Y,Shen HY,et al. Exosomes in development,metastasis and drug resistance of breast cancer[J].Cancer Sci,2015,106(8):959-964.
[3] Yu S,Cao H,Shen B,et al.Tumor-derived exosomesrogression a in cancer p nd treatment failure[J].Oncotarget,2015,6(35):37151-37168.
[4] Xiao X,Yu S,Li S,et al.Exosomes: decreased sensitivity of lung cancer A549 cells to cisplatin[J].Plo S One,2014,9(2):e89534.
[5] Greenleaf EK,Hollenbeak CS,Wong J.Trends in the use and impact of neoadjuvant chemotherapy on perioperative outcomes for resected gastric cancer[J].Surgery,2015,159(4):1099-1112.
[6] 韩 勇,寿成超.影响5-FU疗效的研究进展[J].中国肿瘤临床,2010,37(21):1255-1259.
[7] Lv MM,Zhu XY,Chen WX,et al.Exosomes mediate drug resistance transfer in MCF-7 breast cancer cells and a probable mechanism is delivery of P-glycoprotein[J].Tumor Biol,2014,35(11):10773-10779.
[8] Yang Y,Yang X,Yang Y,et al. Exosomes: A Promising Factor Involved in Cancer Hypoxic Microenvironments[J].Curr Med Chem,2015,22(36):4189-4195.
[9] Chen WX,Cai YQ,Lv MM,et al.Exosomes from docetaxel-resistant breast cancer cells alter chemosensitivity by delivering microRNAs [J].Tumour Biol,2014,35(10):9649-9659.
[10] Chen WX,Liu XM,Lv XM,et al. Exosomes from drug-resistant breast cancer cells transmit chemoresistance by a horizontal transfer of microRNAs[J]. Plo S One,2014,9(4):e95240.
[11] Chen WX,Zhong SL,Ji MH,et al.MicroRNAs delivered by extracellular vesicles: an emerging resistance mechanism for breast cancer[J].Tumor Biol,2014,35 (4):2883-2892.
[12] Challagundla KB,Wise PM,Neviani P,et al.Exosome-mediated transfer of microRNAs within the tumor microenvironment and neuroblastoma resistance to chemotherapy[J]. J Natl Cancer Inst,2015,107(7):pii:djv135.
[13] Liu D,Li C,Trojanowicz B,et al.CD97 promotion of gastric carcinoma lymphatic metastasis is exosome dependent[J].Gastric Cancer,2016,19(3):754-766.
[14] Baguley BC.Multiple drug resistance mechanisms in cancer[J].Mol Biotechnol,2010,46(3):308-316.
[15] Shedden K,Xie XT,Chandaroy P,et al.Expulsion of small molecules in vesicles shed by cancer cells: association with gene expression and chemosensitivity profiles[J].Cancer Res,2003,63(15):4331-4337.
[16] Jones PM,George AM.The ABC transporter structure and mechanism: perspectives on recent research[J].Cell Mol Life Sci,2004,61(6):682-699.
[17] Ji R,Zhang B,Zhang X,et al. J. Exosomes derived from human mesenchymal stem cells confer drug resistance in gastric cancer[J].Cell Cycle,2015,14(15):2473-2483.
