利用猪口腔液对猪场猪繁殖与呼吸综合征抗体进行检测
2018-03-08刘颖昳刘金兰单瑛琦王红梅吴佳俊翟新验
刘颖昳,刘金兰,单瑛琦,王红梅,吴佳俊,翟新验*
(1.中国动物疫病预防控制中心,北京 100260;2.北京市房山区原种猪场,北京 102400;3.北京市大兴区动物卫生监督管理局,北京 100260;4.北京六马养猪科技有限公司,北京 101300)
猪咀嚼物品时,可通过齿龈和位于口腔黏膜和齿龈组织的毛细血管渗出猪口腔液,其成分与血清相似,可反应出血清中的激素、药物、抗体和病毒等各种组分[1-3]。目前已有商品化的工具用于猪只口腔液的收集。该采样方法无创伤、应激小、非常适合用于猪群病原及抗体水平的监测[4-5]。
利用猪口腔液进行病原和抗体监测,目前已经有多项报道[1-3]。已报道的猪口腔液可用于监测的疫病包括猪繁殖与呼吸综合征(PRRS)[6-9]、圆环II型病毒病[10]、甲型流感[11]、非洲猪瘟[12]和口蹄疫[13-14]。口腔液检测可成功检出病原阳性,与拭子检测结果符合率较高。而且,口腔液检测还可成功检出抗体变化趋势,与血清结果具有较好的符合率。其中,PRRS的检测技术最成熟,已经有商用PRRS抗体检测ELISA试剂盒,可得到稳定检测结果。美国爱德华州立大学的Jeffrey Zimmerman教授报道了多项关于猪唾液采样及其在病原及抗体检测中的应用[6-8]。上述研究表明口腔液采样作为一种有潜力的监测方法,有希望广泛应用于猪场和养殖户。但是目前的大多数研究是基于背景清晰的SPF猪的实验型研究,对于情况更为复杂的养殖场,其应用仍需要进一步数据支持。
为了进一步评价该方法在猪场的实际使用效果,我们利用PRRS弱毒活疫苗分别免疫母猪和仔猪,然后分不同时间段进行口腔液和血清采集,然后使用商品化的试剂盒分别测定血液和口腔液中PRRS抗体的消长水平,比较血液和唾液中的抗体消长规律并分析结果,进一步完善利用猪口腔液用于PRRS抗体水平评价的方法,以便使该技术在种猪场进行技术推广和使用。
1 材料和方法
1.1 实验设计
选取3头母猪(胎次:5~6胎,大白和长白,一年免疫两次PRRS活疫苗)用于个体血液和口腔液样品的采集;同时选取母猪对应的3圈仔猪(20 日龄,每圈8~10 头,未免疫)用于群体血液和口腔液样品的采集。选取的PRRS活疫苗为高致病性猪繁殖与呼吸道综合征活疫苗TJMF92株(购自新疆天康畜牧生物技术股份有限公司)。
母猪和仔猪同日免疫PRRS活疫苗,免疫后7 d(1周)、14 d(2周)、21 d(3周)、28天(4周 )、35 d(5周)、42 d(6周)、49 d(7周)后分别采集口腔液;并同时通过耳缘静脉采血。3头母猪分别采集血液和口腔液;3圈小猪随机取3头采血,每圈共采集1份口腔液。
1.2 口腔液采集
自制未经漂白的原色棉绳。母猪用的棉绳直径为1.5 cm;仔猪用棉绳直径为0.8 cm。根据实验猪舍围栏高度,将棉绳剪成约80 cm长,使用前,将棉绳在121 ℃下高压灭菌20 min并烘干。使用前将棉绳末端打散供猪咀嚼,绳子尽量远离污物。调节高度,保证猪容易咀嚼到。吸引猪群咀嚼15~30 min后,取下棉绳,将湿润的末端放入大密封袋(8号)用力挤压。可重复采集,待口腔液收集量达3~5 mL,将其转入离心管中,离心吸取上清。
1.3 试剂盒基本信息
依据说明书,使用IDEXX PRRS口腔黏液抗体检测试剂盒和IDEXX PRRS X3抗体检测试剂盒分别检测口腔液和血清中的PRRS抗体(采购自北京协信诗华生物科技有限公司)。结果计算公式:S/P值=(样品的OD值—阴性对照值)/(阳性对照值-阴性对照值);S/P值>0.40,判为阳性;S/P值≤ 0.40,判为阴性 。
依据说明书,使用西班牙HIPRA PRRS血液、口腔液二合一抗体检测试剂盒检测口腔液和血清中的猪繁殖与呼吸综合征抗体(采购自北京天之泰生物科技有限公司)。结果计算公式:IRPC=(样品的OD值—阴性对照值)/(阳性对照值-阴性对照值)×100。IRPC>20.0,判为阳性;IRPC≤20.0,判为阴性。
图1 自制口腔液采样套装
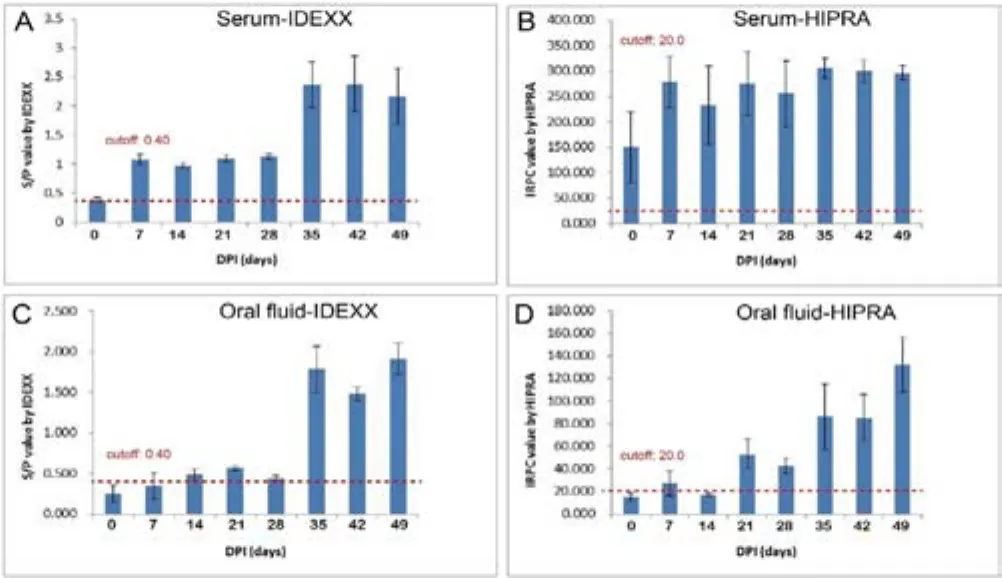
图2 母猪监测结果
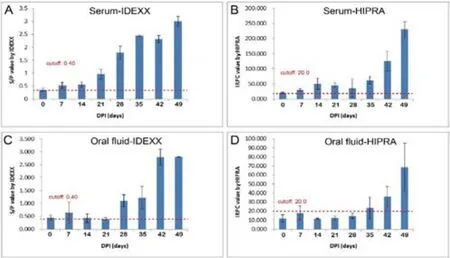
图3 仔猪监测结果
2 结果
2.1 口腔液采集效果
对于母猪和仔猪口腔液采样,在早晨(或者下午,需固定采样时间)喂食前采集样品成功率较高,对于单头母猪,如果首次采样,母猪不咬绳子的话,将棉绳手动塞入母猪口中直至其咀嚼,训练1~2次后,后续可顺利学会咀嚼棉绳,母猪样品量约为3~5 mL。对于仔猪,如果首次采样,仔猪不咬绳子的话,将绳子用5%蔗糖水浸泡润湿,训练1~2次后,后续仔猪可顺利学会咀嚼棉绳,仔猪样品量约为5~8 mL。离心后上清呈轻微浑浊浅黄色溶液。
2.2 血清与口腔液抗体检测结果
母猪血清与口腔液抗体检测结果:利用IDEXX检测试剂盒检查母猪血清与唾液中的PRRS抗体存在一定相关性。在免疫后1~5周内, PRRS抗体水平基本保持一致,但在第5周抗体水平显著升高(图2A,图2C)。而利用HIPRA检测试剂盒检测母猪血清与唾液中的PRRS抗体,其中血清中抗体水平一直处在较高的水平(图2B),但唾液中的PRRS抗体水平在第5周显著升高(图2D)。为了进一步表明母猪口腔液抗体水平和血清中抗体水平的关系,我们对免疫后不同时间的血清和口腔液中PRRS抗体阳性结果符合率进行了汇总整理,见表1。
仔猪血清与口腔液抗体检测结果:利用IDEXX检测试剂盒检查仔猪血清与唾液中的PRRS抗体存在一定相关性。在免疫后1~5周内,PRRS抗体水平基本保持一致,但在第5周抗体水平显著升高(图3A,图3C)。同时利用HIPRA检测试剂盒检查仔猪血清与唾液中的PRRS抗体也存在一定相关性。在免疫后1~5周内,PRRS抗体水平基本保持一致,但在第5周抗体水平显著升高(图3B,图3D)。
2.3 血清与口腔液抗体检测结果阳性符合率
根据上述结果计算血清和口腔液中PRRS抗体阳性率的符合率,符合率=口腔液中PRRS抗体阳性率/血清中PRRS抗体阳性率100%(表1)。对于母猪,免疫后5周后经两种试剂盒检出符合率为100%;对于仔猪,免疫后4周经IDEXX试剂盒检出符合率为100%,免疫后6周经HIPRA试剂盒检出符合率为100%。
3 讨论
猪口腔液中抗体初期主要是IgA和IgM,后期主要为IgG,水平较高且持续时间可长达数周。已经证实猪口腔液中抗体与血清中抗体水平存在相关性[3,6,15]。基于这种相关性,已经开发出商用口腔液PRRS抗体检测ELISA试剂盒。为了进一步评价该方法的实际使用效果,我们评估了不同试剂盒对母猪和仔猪口腔液中的PRRS抗体的检测结果,并与血清结果进行了对比。结果表明在口腔液中,总抗体水平较低。母猪和仔猪中,均是在免疫后第5周在口腔液中检出抗体水平峰值。此外,之前有研究证实口腔液中PRRS抗体在免疫后5周达到峰值,10周后即迅速降低,而相应的血清抗体则可持续14周仍保持较高水平[8,15,16],我们的结果与上述研究结果相似。但是在本研究中,由于未持续跟踪猪群的抗体水平,对血清和唾液中抗体水平消长规律无法进行完整描述,例如7周后血清和唾液中免疫抗体变化等,因此无法给出抗体持续时间。
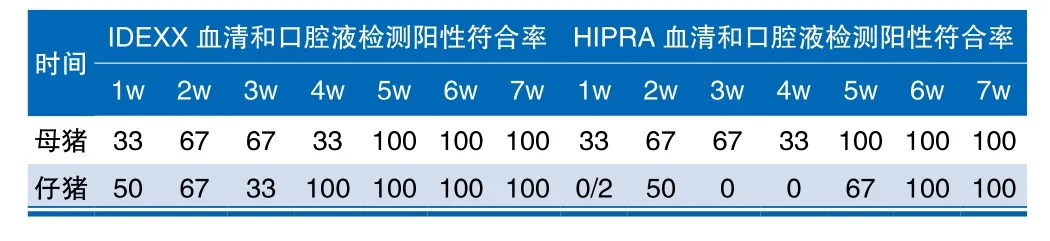
表1 免疫后不同时间2种试剂盒检测血清和口腔液中PRRS抗体阳性结果符合率 %
2个不同品牌试剂盒对血清和口腔液PRRS抗体的检测结果存在一定差异。我们发现IDEXX试剂盒在进行口腔中不同时间段PRRS抗体检测时,其口腔抗体与血清抗体阳性符合率对于母猪和仔猪分别是免疫后5周和4周达到100%;HIPRA试剂盒对于母猪和仔猪分别是免疫后5周和6周达到100%(表1)。HIPRA试剂盒为口腔液血清二合一试剂盒,可同时检测口腔液和血清样品,因此,猪场可根据实际需求进行选择。由于口腔液抗体水平较低,根据我们的结果,对于所有猪群免疫后6周,使用两种品牌的试剂盒均可得到较好结果。
此外,我们观察到,HIPRA试剂盒检测母猪血清中PRRS抗体时,从免疫后第1周开始,抗体水平始终处于较高水平,并未检出上升趋势(图2,图3),可能是由于母猪持续免疫PRRS弱毒疫苗,血清中IgG抗体水平较高,HIPRA二合一试剂盒用于血清检测时,针对的是血清中的IgG抗体,因此母猪免疫初期抗体即在较高水平。因此,建议在免疫抗体水平较高的母猪中,使用口腔液进行PRRS抗体检测,有助于排除本底干扰,可检测到因免疫新近产生的抗体。
4 小结
PRRS免疫抗体可通过口腔液进行检测。免疫后6~7周采集口腔液样本进行检测,可进行免疫效果监测,结果与血清结果符合率较高。同时,不同试剂盒检测效果有差异,应根据采样时间和采样猪群选择合适试剂盒。
致谢:北京市生猪产业体系创新团队(基金号:BAIC02-2017)
[1] DELIMA A J, DYKE T E V. Origin and function of the cellular components in gingival crevice fluid[J]. Periodontology, 2003, 31(1):55-76.
[2] CAMERON S O, CARMAN W F. The use of the OraSure collection device for hepatitis virus testing in health care settings[J]. Journal of Clinical Virology the Official Publication of the Pan American Society for Clinical Virology,2005, 34 Suppl 1:S22-S28.
[3] ZIMMERMAN J R P J J, Z IMMERMAN A J J. The development of oral fluid-based diagnostics and applications in veterinary medicine.[C]// Anim Health Res Rev,2010:207-216.
[4] OLSEN C, KARRIKER L, CHONG W, et al. Effect of collection material and sample processing on pig oral fluid testing results[J]. Veterinary Journal, 2013, 198(1):158-163.
[5] PEPIN B, LIU F, MAIN R, et al. Collection of oral fluid from individually housed sows[J]. Journal of Swine Health& Production, 2015, 23(1):35-37.
[6] PRICKETT J, SIMER R, CHRISTOPHENNINGS J, et al.Detection of Porcine reproductive and respiratory syndrome virus infection in porcine oral fluid samples: a longitudinal study under experimental conditions.[J]. Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc, 2008, 20(2):645-654.
[7] OLlSEN C, WANG C, CHRISTOPHERHENNINGS J,et al. Probability of detecting infection using pen-based swine oral fluid specimens as a function of within-pen prevalence[J]. Food & Nutrition Bulletin, 1943, 23(3Suppl):17-20.
[8] KITTAWORNRAT A, ENGLE M, PANYASING Y, et al.Kinetics of the porcine reproductive and respiratory syndrome virus (PRRSV) humoral immune response in swine serum and oral fluids collected from individual boars[J].Bmc Veterinary Research, 2013, 9(9):1-11.
[9] KITTAWORNRAT A, PANYASING Y, GOODELL C, et al. Porcine reproductive and respiratory syndrome virus(PRRSV) surveillance using pre-weaning oral fluid samples detects circulation of wild-type PRRSV[J]. Veterinary Microbiology, 2014, 168(2-4):331-339.
[10] WONIL K. Application of oral fluid sample to monitor Porcine circovirus-2 infection in pig farms.[J]. Journal of Veterinary Clinics, 2010, 27(6):704-712.
[11] DECORTE I, STEENSELS M, LAMBRECHT B, et al.Detection and Isolation of Swine Influenza A Virus in Spiked Oral Fluid and Samples from Individually Housed,Experimentally Infected Pigs: Potential Role of Porcine Oral Fluid in Active Influenza A Virus Surveillance in Swine[J].Plos One, 2015, 10(10):154.
[12] MUR L, GALLARDO C, SOLER A, et al. Potential use of oral fluid samples for serological diagnosis of African swine fever[J]. Veterinary Microbiology, 2013, 165(1-2):135-139.
[13] VOSLOO W, MORRIS J, DAVIS A, et al. Collection of Oral Fluids Using Cotton Ropes as a Sampling Method to Detect Foot-and-Mouth Disease Virus Infection in Pigs[J].Transboundary & Emerging Diseases, 2013, 11(5):246 247.
[14] MOUCHANTAT S, HAAS B, BOHLE W, et al. Proof of principle: Non-invasive sampling for early detection of foot-and-mouth disease virus infection in wild boar using a rope-in-a-bait sampling technique[J]. Veterinary Microbiology, 2014, 172(1-2):329-333.
[15] KITTAWORNRAT A, PRICKETT J, WANG C, et al. Detection of Porcine reproductive and respiratory syndrome virus(PRRSV) antibodies in oral fluid specimens using a commercial PRRSV serum antibody enzyme-linked immunosorbent assay[J]. Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc, 2012, 24(2):262-269.
[16] LANGENHORST R J,LAWSON S, KITTAWORNRAT A,et al. Development of a fluorescent microsphere immunoassay for detection of antibodies against PRRSV using oral fluid samples as an alternative to serum-based assays[J].Clinical & Vaccine Immunology,2011,19(2):180-189.
