缺氧诱导因子-1α、葡萄糖转运蛋白-1和碳酸酐酶-Ⅸ在子宫内膜癌患者中的作用
2018-03-08
(安阳市妇幼保健院妇产科,河南 安阳 455000)
子宫内膜癌是发达国家女性最常见的生殖器恶性肿瘤,发病风险为2%~3%[1]。子宫内膜癌自然病程缓慢,预后较好,临床症状的早期出现使我们能够在疾病的早期进行诊断。子宫内膜癌患者的5 a总生存率很高,在所有阶段占80%以上,其中在第一阶段占90%以上[2]。预后不良的患者,会受益于进一步的辅助化疗或放疗。因此更多了解预测复发和(或)死亡的重要风险因素是非常有意义的。
目前公认的子宫内膜癌预后较差的因素是:临床分期晚期、非子宫内膜组织学亚型、高级别病变(G3)、子宫肌层深部侵犯(>50%)、淋巴结转移、宫颈受累和淋巴血管间隔侵犯[2]。尽管近年来我们对肿瘤细胞的认识有了很大的提高,但控制肿瘤进展和转移形成过程的确切机制仍不清楚。
缺氧在癌变中起着重要作用。代谢重编程和基因表达的变化对于适应氧可用性下降是必要的。肿瘤微环境中的缺氧诱导因子(hypoxia inducible factor,HIF)是能够适应缺氧环境的氧敏感转录因子。HIF是细胞对应激反应的重要介质,如代谢性、缺氧性和炎症性。肿瘤发生过程中发生代谢改变,部分是在缺氧和HIF调节下发生的。此外,低氧是继发于低氧的炎症信号和过滤清除了肿瘤进展的驱动因素[3]。然而,尽管低氧在肿瘤微环境中的作用已被证实,但其在子宫内膜癌中的意义还不完全清楚。HIF-1是哺乳动物几乎所有核细胞氧平衡的关键调节因子[3-4]。免疫组织化学研究[5]表明,许多恶性肿瘤的特征是与正常组织相比,HIF-1出现过度表达。对细胞氧水平变化的适应主要由HIF-1的α亚单位决定。低氧条件下,活性因子HIF-1参与葡萄糖代谢、pH值、血管生成、细胞分化、迁移和转移形成的调节[6],肿瘤微环境中葡萄糖代谢由氧线粒体过程转变为糖酵解(Warburg效应)。HIF-1调节葡萄糖转运蛋白(glucose transporter,GLUT)中GLUT-1和GLUT-3的活性,这些转运蛋白负责葡萄糖的摄取[7]。GLUT-1的表达被缺氧以一种依赖于HIF-1α的方式调节[8]。碳酸酐酶-Ⅸ(carbonic anhydrase-Ⅸ,CA-Ⅸ)是另一个与HIF-1α活性相关的因素[9]。CA-Ⅸ对肿瘤微环境的影响以调节pH为特征。CA-Ⅸ的过度表达在许多肿瘤组织中观察到,但在正常组织中没有观察到[10]。本研究的目的是验证HIF-1α、GLUT-1和CA-Ⅸ免疫组化测定蛋白作为子宫内膜癌患者不良临床病理特征预测因子的有效性,以及分析蛋白表达与患者生存的关系。
1 材料与方法
1.1一般资料入组2013年1月至2017年12月期间我院收治的经病理学确诊的92例子宫内膜癌患者,年龄37~84(65.1±9.5)岁,根据刮宫标本对子宫内膜癌进行诊断后,所有患者均行腹部子宫切除术、双侧输卵管卵巢切除术和盆腔淋巴结切除术,患者的基本临床资料见表1。根据上述的风险因素,所有患者分为3组:低风险组:Ⅰa期、G1或G2期、子宫内膜组织病理亚型;中风险组:Ⅰa期G3级、Ⅱ期和非子宫内膜样组织病理亚型;高风险组:非子宫内膜样组织病理亚型、Ⅰb期G3级、Ⅱ期和更高分型及分期。低风险组的患者术后不再接受任何进一步的治疗;中风险组术后5周接受近距离放疗;高风险组接受远程放疗和近距离放疗;对10例非子宫内膜组织病理亚型(化疗包括卡铂和紫杉醇)患者进行辅助化疗。

表1 子宫内膜癌患者的一般资料
1.2方法检测指标应用免疫组化S-P法,蜡块均由病理科专业技术人员处理制备。实验操作步骤均按照操作说明严格进行。主要试剂:鼠抗HIF-1α单克隆抗体(1100);兔抗GLUT-1多克隆抗体(1200)和兔抗CA-Ⅸ多克隆抗体(11 500)。石蜡切片脱蜡水化,过氧化氢封闭内源性过氧化物酶,用含质量分数5%牛血清白蛋白磷酸盐缓冲液(phosphate buffer,PBS)中洗涤。滴加一抗,GLUT-1和CA-IX抗体在室温下孵育30 min,HIF-1α在4 ℃条件过夜;以DAB(3-3-二氨基联苯胺)为显色剂,将抗原抗体复合物定位为棕色反应产物。
1.3免疫组化染色判断蛋白的表达量根据2个参考进行:1)根据细胞膜及细胞质染色强度进行评分,0分:阴性;1分:低染色;2分:适度染色;3分:强染色;2)阳性细胞或组织面积的百分比,0分:阴性;1分:<10%;2分:10%~<50%;3分:50%~<80%;4分:≥80%。

2 结果
2.1子宫内膜癌组织中HIF-1α、GLUT-1和CA-Ⅸ蛋白表达子宫内膜癌组织中HIF-1α阳性表达率为96.74%,GLUT-1为100.00%,CA-Ⅸ为89.13%。不同临床分期子宫内膜癌组织中HIF-1α、GLUT-1和CA-Ⅸ的蛋白表达情况见图1。
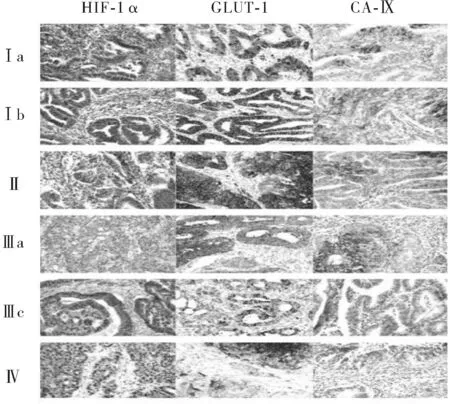
图1 不同临床分期子宫内膜癌
2.2子宫内膜癌组织中HIF-1α、GLUT-1和CA-IX蛋白表达量与其临床病理特征之间的关系HIF-1α的表达在子宫内膜癌的组织学亚型之间存在高度差异,HIF-1α的表达越高,复发的风险越高(P<0.05)。见表2~4。

表2 子宫内膜癌组织中HIF-1α蛋白表达与其临床病理特征之间的关系
表3 子宫内膜癌组织中GLUT-1蛋白表达与其临床病理特征之间的关系

表4 子宫内膜癌组织中CA-Ⅸ蛋白表达与其临床病理特征之间的关系
2.3子宫内膜癌组织中HIF-1α、GLUT-1和CA-Ⅸ蛋白表达与其生存之间的关系的COX回归分析结果单变量COX回归分析显示,组织学分级(G3)、淋巴结转移阳性和侵犯子宫肌层>50%是子宫内膜癌生存危险因素;多变量COX回归分析显示,仅侵犯子宫肌层>50%是子宫内膜癌生存危险因素(P<0.05)。见表5、6。
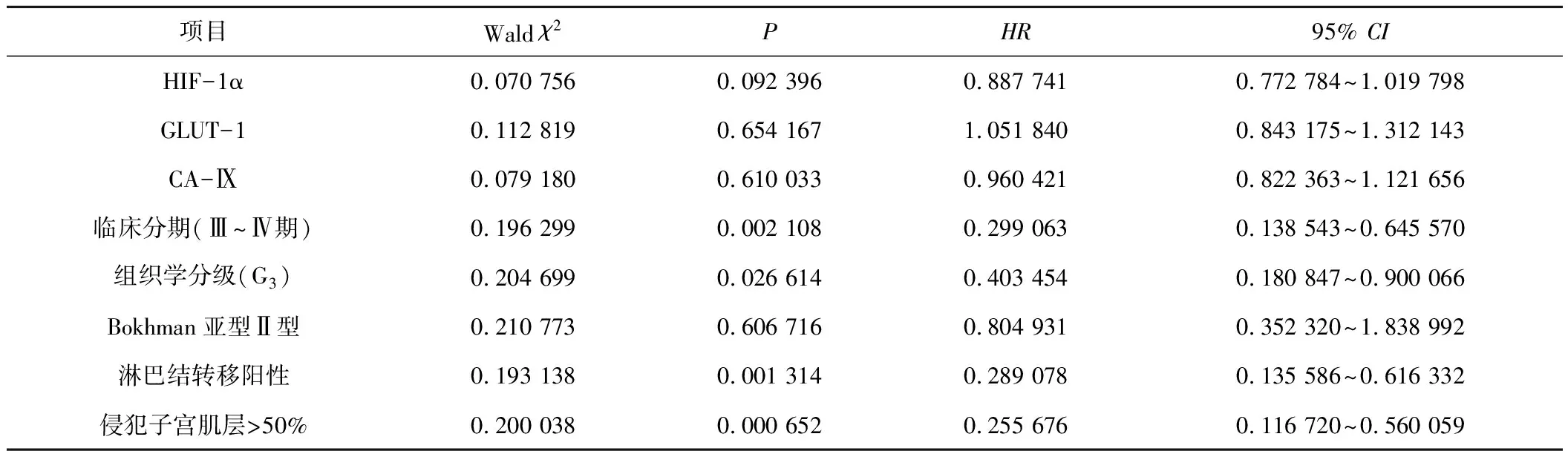
表5 COX单变量分析选择的总生存率的预后因素

表6 COX多变量分析选择的总生存率的预后因素
3 讨论
缺氧在致癌过程中起着重要作用。然而,尽管低氧在肿瘤微环境中的作用已被证实,但其在子宫内膜癌中的重要性还没有得到很好的解释。肿瘤的生长需要不断增加的氧气和营养素供应,从而促进新血管系统的发育。通常情况下,肿瘤细胞的生长往往先于血管的发育,而血管的发育是由低氧区的存在所反映出来的,这些区域位于肿瘤周围,由于增殖增强,也位于其中心部位,血管的穿透不足[11],缺氧诱导了HIF-1α的合成,导致肿瘤微环境的改变。此外,随着肿瘤的发展,肿瘤细胞变得独立于外部调节因子,并可迁移至供氧的不同区域,因此,假设HIF-1α的表达与抗肿瘤和治疗有关,那么这种假设就会刺激对新型药物的研究,这些药物可以克服与HIF-1α过度表达相关的治疗抵抗[12]。目前有人认为,HIF-1α发挥救世主作用,使细胞发生缺氧。此外,研究[13]还发现,除缺氧外,高水平的HIF-1α也可能是由病毒癌基因刺激所致。
HIF-1α参与月经周期子宫内膜修复,其表达增加与分泌期最相关,在其晚期有峰值表达的报道;此外,HIF-1α被发现是雌激素依赖性血管内皮生长因子合成的共同激活因子[14]。
HIF-1α不仅可以调节正常子宫内膜癌的血管生成,还可以在子宫肌层受到侵犯时释放血管内皮生长因子[14]。在动物模型中,低氧刺激与前列腺素受体结合,促进子宫内膜癌细胞的增殖和肿瘤的生长[15]。
HIF-1α通过调节p27kip细胞周期抑制剂参与子宫内膜癌的进展[16]。此外,HIF-1α基因多态性的存在与HIF-1α的稳定性和持续激活有关。这种多态性在子宫内膜癌细胞中被记录为一种新的突变。这种缺陷与较高的血管密度和肿瘤更大的生长潜力有关[16-17]。
激活人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路可使HIF-1α稳定。编码PTEN基因的突变增强了细胞增殖,增加了细胞周期蛋白的表达和复制。在正常的子宫内膜细胞中,这些细胞是由自身再生引起的。相反,PTEN抑制性转化功能的失活导致子宫内膜细胞恶性转化[18]。PTEN抑制基因编码的蛋白质是一种磷酸酶,负责细胞膜脂质的去磷酸化。此外,PTEN还作为蛋白激酶途径的抑制剂,抑制了磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase , PI3K)的活性。约83%的子宫内膜癌中表达PTEN蛋白。PI3K/AKT/mTOR通路过度激活可导致肌腱损伤,导致肿瘤生长失控。在子宫内膜癌细胞中,PI3K/Akt/mTOR信号转导级联是酪氨酸激酶受体的主要失活途径之一,如血管内皮生长因子受体1、血小板衍生生长因子受体、表皮生长因子受体1和c-Met[19]。
目前,假设HIF-1α的表达增加,从正常子宫内膜中观察到的最小值到子宫内膜增生和恶性肿瘤中记录到的中、高水平。事实上,HIF-1α的表达与肿瘤的临床分期成比例增加同样重要。HIF-1α表达的增加伴随着血管紧张度的增加、血管生成的不稳定;这意味着HIF-1α、血管生成和子宫内膜癌之间的关系[20]。
我们的研究证实了HIF-1α在子宫内膜癌中的表达,与子宫内膜肿瘤相比,HIF-1α抗体在非子宫内膜恶性肿瘤中的表达显著增高。根据Bokhman的研究,HIF-1α的水平与Bokhman亚型 Ⅱ 型的存在显著相关,与我们的发现与之前唯一一项分析依赖于Bokhman亚型的HIF-1α表达的研究结果相一致[21]。此外,在Bokhman亚型Ⅰ型子宫内膜癌患者中,HIF-1α的表达增加与不良预后因素的存在相关[21]。
此外,我们观察到HIF-1α的表达与风险发生率存在高度相关性,HIF-1α的高表达与中、高复发风险关系密切。单变量和多变量COX回归分析显示,HIF-1α蛋白的表达是Bokhman分型Ⅱ型的一个重要预测因子,并且与中、高复发风险相关。以往关于HIF-1α肿瘤预后价值的研究结果既没有结论性,也存在争议。一些作者认为,HIF-1α的高表达与较短的生存时间和复发时间有关;相反,其他研究者认为HIF-1α与肿瘤患者的预后无关[21-22]。
值得注意的是,我们的研究表明,HIF-1α蛋白的高表达与子宫内膜癌预后较差的Bokhman分型Ⅱ型和更高的复发风险有关;这与有关研究[22]结果一致。
PTEN/mTOR通路参与子宫内膜癌变刺激了对mTOR抑制剂的研究。在雷帕霉素衍生物替西罗莫司的第2阶段研究中,有14%的子宫内膜癌患者出现部分反应,而有系统治疗史的患者中有4%未接受过化疗。此外,69%的既往未经治疗的患者和48%的化疗后患者病情稳定。然而,本研究并未揭示PTEN蛋白表达或PTEN基因突变与替西罗莫司治疗结果之间的关系[23]。目前,其他mTOR抑制剂正在进行先进的子宫内膜癌治疗试验。
HIF-1α的表达会改变葡萄糖从有氧代谢到无氧代谢的过程。GLUT和碳酸氢酶参与了这种改变条件的适应性。GLUT-1葡萄糖转运体也负责摄取这种糖。GLUT-1的表达在无氧条件下增加,引起代谢性脂肪分解。与此相反,GLUT-1的过度表达证实了各种肿瘤的发生,如食管癌、甲状腺癌、肺癌、卵巢癌和乳腺癌[24]。我们的研究也发现,GLUT-1的表达也增加了子宫内膜癌的发生风险。但是,GLUT-1的表达与子宫内膜癌临床病理特征之间并没有显著相关性,这一结论与以前的报道一致,根据这些报道我们发现,GLUT-1的存在是肿瘤转化的标志[25]。正常子宫内膜中缺少GLUT-1的表达,以及在癌前病变中的弱表达和子宫内膜癌组织中的过度表达表明,GLUT-1在子宫内膜癌发生的早期可溶解。
CA-Ⅸ在缺氧诱导的糖酵解过程中起着重要的作用,在许多肿瘤中观察到了CA-Ⅸ的过量表达,但在正常组织中却没有[10]。我们的研究证实了CA-Ⅸ在子宫内膜癌微环境中的表达增加。然而,这种表达水平与肿瘤的临床病理特征之间并没有显著相关性。这一发现与迄今发表的2项研究结果一致[26-27]。有文献[26]证实了CA-Ⅸ在子宫内膜癌组织中的表达高于正常子宫内膜组织,并提示CA-Ⅸ参与了与肿瘤转化相关的葡萄糖代谢的转移。然而,我们的研究结果表明,测定GLUT-1和CA-Ⅸ的表达对确定子宫内膜癌患者的预后没有帮助。GLUT-1和CA-Ⅸ参与致癌的早期阶段,这表明两者在良性和恶性肿瘤之间的潜在应用是不可区分的。
总之,HIF-1α在高复发风险组及非子宫内膜样病理组织亚型中的重要作用表明,该因子的表达可能有助于辅助病理形态学检查,有助于预测子宫内膜癌患者的预后。
