基于COⅠ序列的不同地理种群岩虫遗传多样性研究
2018-03-07赵欢张伯序薛圣伦王一枭杨大佐周一兵
赵欢,张伯序,薛圣伦,王一枭,杨大佐,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
岩虫Marphysa sanguinea隶属于环节动物门Annelida、多毛纲Polychaeta、矶沙蚕科Eunicidae、岩虫属Marphysa,是三大洋暖水中广泛分布种,栖息于潮间带和潮下带的泥沙、砾石底质、有机质沉积丰富的海区,在中国黄海、渤海、东海和南海均有分布。岩虫个体肥大、营养丰富,是鱼类、甲壳类等经济物种的优质天然饵料,同时也被视为最珍贵的海洋游钓饵料之一。岩虫经济价值不断提升,导致人们对其过度采捕,自然资源日渐枯竭。因此,开展岩虫的人工繁育及种质资源保护研究势在必行。
目前,国内外学者对于岩虫的研究,多集中在人工繁育及室内养殖方面[1],此外,对其形态学[2]、生理学[3]、发育学[4]和天然产物多肽的抗癌功能[5]等方面的研究也有报道。笔者曾利用ISSR开展了不同地理位置岩虫遗传多样性的研究[6],在此基础上,本研究中以COⅠ序列分析方法,研究了中国黄、渤海域和南海海域5个群体岩虫的遗传多样性和遗传分化,揭示了中国沿海岩虫自然群体的遗传多样性,并探讨了群体间的亲缘关系,旨在为岩虫人工繁育提供理论依据。
1 材料与方法
1.1 材料
试验用岩虫为2012—2013年于辽宁大连、辽宁兴城、山东乳山和广西北海4个海域采集样品(图1),其中广西北海采集了2个群体,共5个群体,每个群体各15尾样品。
1.2 方法
1.2.1 样品的制备 将采集到的样品从尾部剪取2~3 cm,装入冻存管中并编号,放入冰箱 (-20℃)中冷冻,以备DNA的提取。
1.2.2 样品DNA的提取 使用宝生物DNA提取试剂盒 (TaKaRa MiniBEST Universal Genomic DNA Extraction Kit),按照其说明书步骤操作进行。样品在10 g/L琼脂糖凝胶电泳上进行检测,用紫外分光光度计测定DNA浓度后,于4℃下保存备用。1.2.3 PCR扩增与测序 从NCBI上检索出岩虫的COⅠ序列 (注册号为GQ497547.1),用引物设计软件Primer Premier 5.0设计一对引物,上游引物序列 COⅠ-F: 5′ACGMGTBCCSCTRTTTGT 3′,下游引物序列 COⅠ-R:5′ATTGTTGCYAGTCABCTAA 3′。用该引物预扩增目的片段长度为444 bp。 COⅠ-PCR 反应体系 (共25 μL): 2×Taq Plus PCR Master Mix 12 μL(Tiagen), 上、 下游引物 (10 μmol/L) 各为 1.25 μL, DNA 模板 10 ng,用ddH2O补足至25 μL。PCR反应程序:94℃下预变性5 min;94℃下循环变性45 s,46℃下退火复性30 s,72℃下延伸1 min,共进行35个循环;最后在72℃下再延伸10 min,于4℃下保存。反应结束后,将扩增产物在10 g/L琼脂糖凝胶电泳上检测拍照和比较,挑选较好的PCR产物送大连宝生物公司进行双向测序。

图1 采样地点Fig.1 Sample locations of rock worm Marphysa sanguinea
1.3 数据处理
将通过双向测序所得到的COⅠ序列在NCBI上进行Blast同源性比对,证实所获得的基因片段确实为线粒体COⅠ基因。应用Vector NTI软件参考测序所得电泳图谱对序列进行整理,去除两端因测序所造成的不准确碱基。应用DnaSP 5计算各群体样本核苷酸组成、GC含量、单倍型多样性(Hd)、核苷酸多样性 (π)、平均核苷酸差异(K)、Tajima's D值和Fu's Fs值[7]。对各群体COⅠ序列进行核苷酸不配对分布分析并制图。用Arlequin 3.11软件计算群体间遗传分化系数Fst[8],并通过分子方差分析 (AMOVA)分析群体内和群体间的遗传变异。采用MEGA 5.0软件进行群体间的聚类分析,并应用Bootstrap(重复次数1000)检验聚类树各分支置信度,绘制UPGMA聚类图,选取多毛纲、矶沙蚕科、岩虫属Marphysa的Marphysa cf.hentscheli作为外参种群 (GenBank登录号:GQ497551.1)。单倍型聚类树同样应用MEGA 5.0软件进行绘制,采用Bootstrap(重复次数1000)检验各分支置信度,绘制NJ邻接树[9]。应用Network软件绘制各单倍型网络关系图[10]。
2 结果与分析
2.1 序列特征及单倍型多样性分析
将测序所得到的全部57条COⅠ序列应用软件Victor NTI中的Align X程序进行比对和整理,去除两端不可信碱基,得到长度为374 bp的同源序列,经 Blast同源性分析,与岩虫线粒体 DNA COⅠ序列 (GenBank登录号:GQ497547.1)一致性高达99%,确定为岩虫COⅠ序列。对这57个岩虫个体的COⅠ序列进行分析,未发现有碱基的插入和缺失。共检测到多态性位点78个,其中简约信息位点59个,单核苷酸突变位点19个。COⅠ序列中有46个碱基位点发生转换,26个发生颠换,另有6个位点既有转换又有颠换。根据Nei等[11]的研究,物种间序列的变异位点基本上是转换多于颠换,本试验结果与其相符。57条COⅠ序列平均碱基含量:A=27.0%,T=29.6%,C=25.9%,G=17.5%,G+C含量为43.4%,低于A+T含量 (56.6%),符合线粒体COⅠ基因的一般特点[12]。
从表1可见:5个群体的57个个体共出现了9种单倍型,其中单倍型Hap8出现次数最多,为15次,但仅出现于广西两个群体之中;单倍型Hap5仅出现于乳山群体,单倍体Hap6和Hap7则仅出现于兴城群体中。各群体中乳山群体拥有的单倍型种类最多,分别为Hap1~Hap5,而广西两个群体均仅有Hap8和Hap9两种单倍型。

表1 岩虫5个群体COⅠ单倍型分布Tab.1 Distribution of nine haplotypes in five populations of rock worm Marphysa sanguinea
各群体的单倍型多样性指数、核苷酸多样性指数等遗传参数指标如表2所示。从表2可见:乳山群体单倍型多样性最高 (0.822),大连单倍型多样性群体最小 (0.295);各群体核苷酸多样性为0.001 17~0.047 84,其中,乳山群体最高,广西两个群体均偏低。总体上看,5个群体的岩虫单倍型多样性为0.830,核苷酸多样性为0.097 73,岩虫整体水平的遗传多样性较高。

表2 各群体的单倍型多样性Hd、核苷酸多样性π和平均核苷酸差异KTab.2 Haplotype diversity(Hd), nucleotide diversity(π)and average number of nucleotide differences(K)of each population
2.2 不同地理群体的遗传距离及分化系数
岩虫5个群体内及群体间的Kimura-2参数遗传距离如表3所示。从表3可见,群体内遗传距离为0.001 2~0.053 1,其中,广西B群体最小,乳山群体最高;群体间的遗传距离为0.001 2~0.179 4,广西两个群体间的遗传距离最小,仅为0.001 2,而广西两个群体与其他3个群体间的遗传距离均较远,其中与兴城的遗传距离最远,为0.179 4。

表3 岩虫群体内及群体间的遗传距离Tab.3 Genetic distance within-population and amongpopulation of rock worm Marphysa sanguinea
5个群体岩虫群体间的遗传分化系数及基因流如表4所示。从表4可见,除了乳山与兴城群体间、广西两群体间的遗传分化系数无显著性差异(P>0.05)外,其他各群体间均产生了较大的遗传分化 (P<0.01)。其中,大连群体与广西两个群体的遗传分化系数最大,达到了0.604 52和0.638 86,而乳山与兴城群体间的遗传分化系数为负值,说明这两个群体间不存在遗传分化。
通过分子方差分析 (AMOVA)所得结果如表5所示,其中,有40.26%的遗传变异发生在群体间,59.74%的遗传变异发生在群体内。虽然群体内的变异高于群体间的变异,但并不十分明显。
2.3 遗传进化关系分析
图2为应用MEGA 5.0软件对5个群体的57个岩虫个体建立的UPGMA聚类树。5个群体的岩虫分为两大类群:乳山 (RS)和兴城 (XC)群体聚为一类,之后与大连群体 (DL)又聚在一起,成为一大类群,广西的两个群体 (GXA、GXB)聚为另一大类群。
图3为应用MEGA 5.0软件对9种单倍型建立的NJ系统树。从图3可知,单倍型Hap2~Hap7较密集地聚在一起,而后与单倍型Hap1相聚,成为一大分支,这7种单倍型出现于大连、乳山和兴城3个群体。仅出现于广西两个群体中的单倍型Hap8和Hap9聚类在一起,成为另一大分支。岩虫个体间的UPGMA聚类树和单倍型间的NJ树显示的结果基本一致。
图4为根据岩虫5个群体中出现的9种单倍型绘制的单倍型网络关系图。从图4可知,这9种单倍型间存在5个中介节点,图中粗线所示为多位点突变,其余细线均为单位点突变。单倍型Hap2~Hap7处于第一个集团,单倍型Hap1单独成为第二个集团,而单倍型Hap8和Hap9处于第三个集团,这也与单倍型NJ树所显示的结果是一致的。
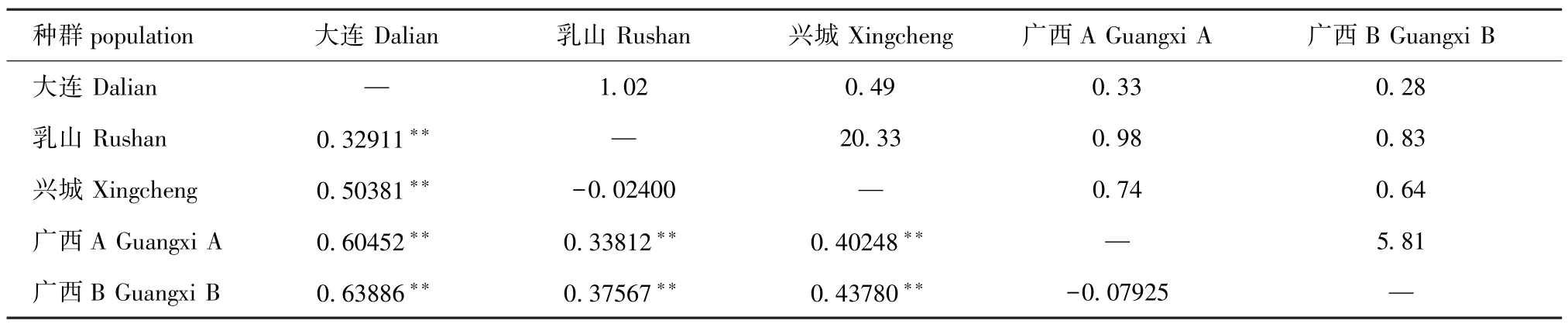
表4 岩虫不同群体间的遗传分化系数Fst及基因流Tab.4 Genetic differentiation and gene flow among 5 populations of rock worm Marphysa sanguinea

图2 基于线粒体COⅠ序列构建的5各群体岩虫的NJ聚类树Fig.2 NJ tree of five populations of rock worm Marphysa sanguinea based on mtDNA COⅠsequences

表5 岩虫群体线粒体COⅠ序列分子变异分析Tab.5 AMOVA analysis of mtDNA COⅠsequences inrock worm Marphysa sanguinea

图3 岩虫线粒体COⅠ序列不同单倍型NJ树Fig.3 Neighbor-joining tree of different haplotypes in rock worm Marphysa sanguinea based on COⅠsequences
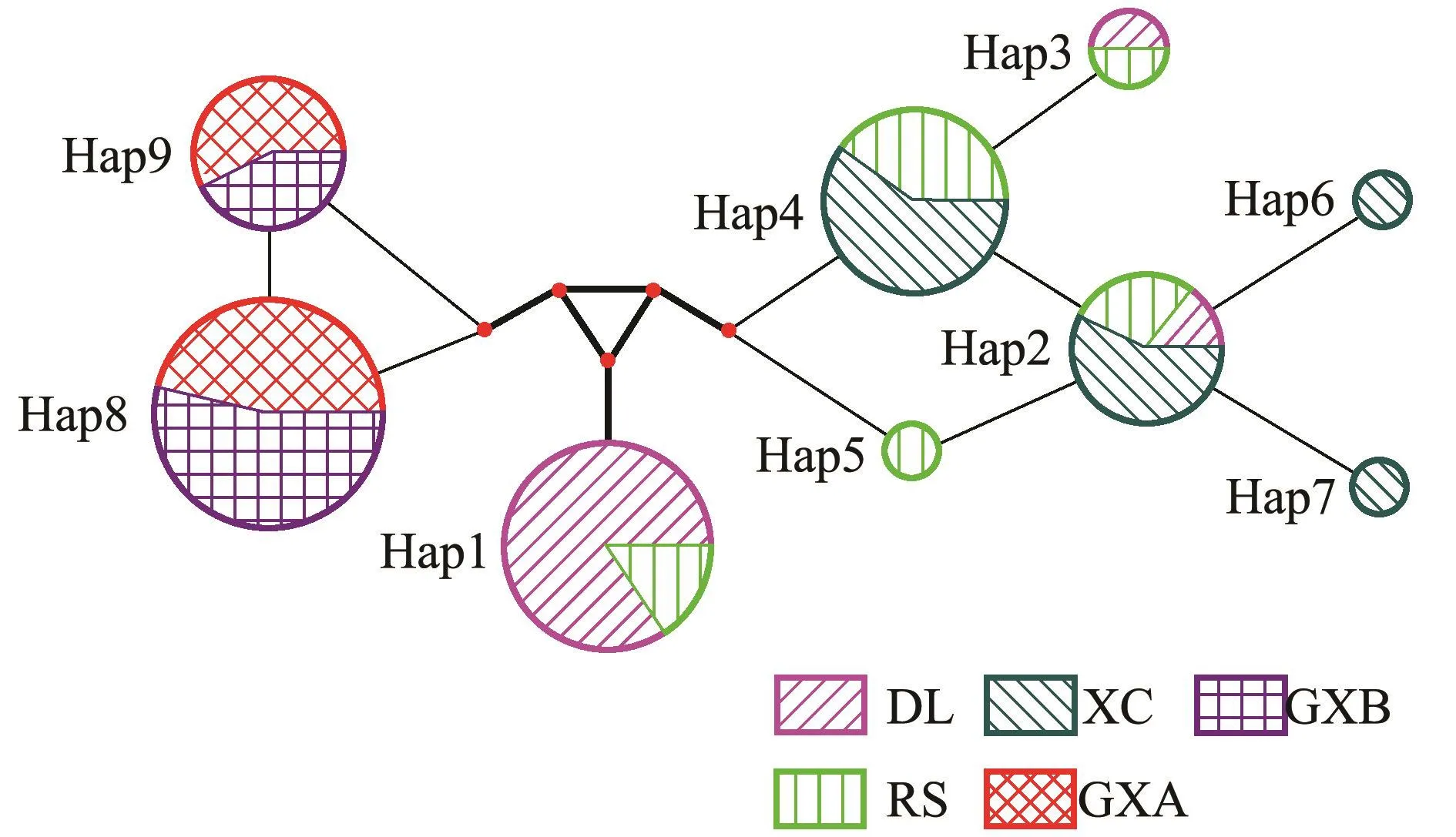
图4 岩虫单倍型网络关系图Fig.4 Haplotype network from all haplotypes of rock worm Marphysa sanguinea based on COⅠsequences
3 讨论
线粒体DNA为严格的母系遗传,没有重组及其他遗传重排现象,后代能够完整保存祖先的遗传信息,同时避免了产生混杂遗传信息的可能。其中,COⅠ是目前应用最多且研究比较透彻的基因之一,被广泛应用于鱼类和甲壳类等的系统进化研究[13-14]。线粒体DNA属细胞质遗传系统,但在有性生殖中,精子对细胞质贡献的可能性不足0.004%。线粒体DNA一个个体就可以代表一个母系集团,有效种群大小为核DNA两性遗传的1/4,故较少的样本就能反映群体结构[15]。但也有报道指出,样本量过少会低估种群的遗传多样性水平[16]。本试验中进行COⅠ序列分析时的样本数量定为15尾,实际测序获得的COⅠ序列每个群体均大于10尾。从分析结果来看,所得数据基本能够真实地反映出群体遗传多样性水平,但所获得的单倍型种类较少。这种情况有可能与本研究中样本数量较少有关。
3.1 岩虫的遗传多样性
在COⅠ序列分析方法中,评价遗传多样性的参数以单倍型多样性 (Hd)和核苷酸多样性 (π)为主要指标。根据线粒体基因序列的单倍型多样性和核苷酸多样性可将海洋生物的遗传多样性分为4种类型[14]:低Hd(<0.5) 和低 π (<0.5%),高Hd(>0.5) 和低π (<0.5%),低Hd(<0.5) 和高π (>0.5%), 高 Hd(>0.5) 和高 π (>0.5%)。 5个岩虫群体中,除了大连群体和广西B群体外,均属于高单倍型多样性、低核苷酸多样性类型。5个岩虫群体中遗传多样性最高的是乳山群体,其单倍型多样性为0.822,核甘酸多样性为0.047 84;遗传多样性最低的是大连群体,其单倍型多样性为0.295。根据Grant等[17]提出的4个假设,较低的Hd值和π值提示群体可能经历了近期的瓶颈效应或奠基者效应,推测大连群体的遗传多样性较低的原因可能与溢油事故的发生具有相关性。2010年7月大连新港发生输油管爆炸事件,大量原油泄漏入海,造成黄海、渤海海区重度原油污染,这势必对这一海区内的海洋生物造成影响[18]。沉降于水底的油类分解产生的硫化氢等毒物,会造成底栖生物大量死亡。这种生存环境的巨大灾难性变化所引起的瓶颈效应,很有可能对大连近岸的岩虫种群造成严重影响,使群体遗传多样性下降。
从岩虫5个群体遗传多样性的联合分析来看,5个群体的岩虫单倍型多样性为0.830,核苷酸多样性为0.097 73,表明岩虫群体遗传多样性处于中等水平。近年来,随着岩虫经济价值不断提升,岩虫自然群体被大量采捕,然而较大的资源量仍然可以维持岩虫较高的遗传多样性。岩虫群体这种高单倍型多样性和低核苷酸多样性的特点表明,物种在近期可能经历了一个由较小的有效群体快速增长为大种群的过程。
3.2 岩虫群体遗传分化
遗传距离是评价群体遗传变异的主要指标。5个群体中广西两个群体间的遗传距离最小,仅为0.001 2,而广西两个群体与其他3个群体间的遗传距离均较远,其中与兴城的距离最远,为0.179 4。广西两个群体与其他3个群体间的遗传距离均大于0.01,表明广西群体与其他3个群体间有明显分化。这可能是由于海域相距甚远,地理屏障导致群体基因交流受阻。岩虫具有底栖穴居的生活习性,其种群的扩散能力较弱,长期的地理隔离,以及其自身的生活繁殖方式导致广西群体与其他群体间存在较大程度的遗传分化。广西两群体遗传距离小于0.01,表明这两个群体间遗传差异较小,两个群体间可能存在频繁的基因交流。不同群体间的遗传分化系数 (表4)也证实了广西两群体与其余3个群体距离较远,而广西的两个群体间未有明显的遗传分化。
从不同个体间UPMGA聚类树来看,5个群体聚为两大类:第一类为大连群体 (DL)、兴城群体(XC)和乳山群体 (RS),其中乳山群体 (RS)和兴城群体 (XC)亲缘关系更近,先聚在一起,而后与大连群体 (DL)聚在一起;第二大类是广西北海的两个群体 (GXA、GXB)。同时,单倍型NJ系统树的结果也符合这一推论,表明广西北海群体与其他3个群体间存在较远亲缘关系。从单倍型角度分析,出现于大连群体中的单倍型Hap1~Hap3在乳山群体中均有发现,但单倍型Hap1在乳山群体中所占比例仅为20%,而在大连群体中所占比例则高达84.6%,从单倍型NJ树来看,单倍型Hap1也只是第一大支的一个分支,并未与单倍型Hap2~Hap7发生密集聚类。推断这一单倍型可能受到环境选择的影响,成为存在于大连群体中的主要单倍型,并存在继续进化的潜力。由选择和瓶颈效应所形成的专有的单倍型可能会大大促进样本种群间的遗传分化[19]。
基因交流和繁育方式是影响群体遗传结构的最重要因素[20],此外,Crisp[21]通过其研究也指出,海洋无脊椎动物的幼体发育模式和浮游能力对其遗传结构影响非常显著。岩虫具有底栖穴居的生活习性,其幼体的浮游期较短且浮游能力较差,这就使得种群的扩散能力较弱,进而导致群体间产生较大程度的遗传分化。因此,岩虫群体目前这种遗传结构,可能是各群体间长期的地理隔离,其自身的生活繁殖方式,以及近期环境变化所产生的瓶颈效应共同作用所造成的。
[1] 杨大佐,周一兵,陈爱华,等.岩虫室内人工繁育的初步研究[J].水产科学,2011,30(9):572-574.
[2] 毛昕,朱丽岩,郑家声.岩虫消化管组织学、组织化学和超微结构的初步研究[J].中国海洋大学学报,2007,37(6):961-967.
[3] Garcês J P,Pereira J.Effect of salinity on survival and growth of Marphysa sanguinea Montagu(1813)juveniles[J].Aquaculture International,2011,19(3):523-530.
[4] 于海志,朱丽岩,郑家声.岩虫的性腺发育和生殖周期[J].中国水产科学,2005,12(6):669-674.
[5] 潘卫东,刘向辉,戈峰.海洋岩虫抗菌肽筛选及抗癌活性的初步研究[J].中国海洋药物,2004,23(3):1-6.
[6] Zhao Huan,Wang Yixiao,Yang Dazuo,et al.An analysis of genetic diversity in Marphysa sanguinea from different geographic populations using ISSR polymorphisms[J].Biochem Syst Ecol,2016,64:65-69.
[7] Librado P,Rozas J.DnaSP v5:a software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25(11):1451-1452.
[8] Excoffier L,Laval G,Schneider S.Arlequin(version 3.0):an integrated software package for population genetics data analysis[J].Evol Bioinform Online,2005,1:47-50.
[9] Nei M.Genetic distance between populations[J].Am Nat,1972,106(949):283-292.
[10] Bandelt H J,Forster P,Röhl A.Median-joining networks for inferring intraspecific phylogenies[J].Mol Biol Evol,1999,16(1):37-48.
[11] Nei M,Kumar S.Molecular Evolution and Phylogenetics[M].Oxford:Oxford University Press,2000.
[12] 常抗美,李焕,吕振明,等.中国沿海7个长蛸(Octopus variabilis)群体COI基因的遗传变异研究[J].海洋与湖沼,2010,41(3):307-314.
[13] 赵琳,张敏莹,徐东坡,等.2个地理种群大银鱼COⅠ基因序列变异与遗传分化[J].大连海洋大学学报,2016,31(3):285-289.
[14] 董鑫,邢坤,隋宥珍,等.基于线粒体COI基因序列的4个海域口虾蛄群体的遗传多样性研究[J].海洋科学,2015,39(7):29-36.
[15] 李建华,王继文.动物线粒体DNA在进化遗传学研究中的应用[J].生物学通报,2005,40(2):5-7.
[16] 闫晗.利用ISSR和COI序列标记分析不同地理仿刺参群体的遗传多样性[D].大连:辽宁师范大学,2006.
[17] Grant W S,Bowen B W.Shallow population histories in deep evolutionary lineages of marine fishes:insights from sardines and anchovies and lessons for conservation[J].J Hered,1998,89(5):415-426.
[18] Lv Ying,Zhang Weidong,Gao Yan,et al.Preliminary study on responses of marine nematode community to crude oil contamination in intertidal zone of Bathing Beach,Dalian[J].Mar Pollut Bull,2011,62(12):2700-2706.
[19] 盖珊珊.山东沿海不同地理群体双齿围沙蚕(Perinereis aibuhitensis)的早期发育及遗传多样性研究[D].青岛:中国海洋大学,2012.
[20] Hamrick J L,Godt M J W,Sherman-Broyles S L.Gene flow among plant populations:evidence from genetic markers[M]//Hoch P C,Stephenson A G.Experimental and Molecular Approaches to Plant Biosystematics.Saint Louis:Missouri Botanical Garden Press,1995:215-232.
[21] Crisp D J.Genetic consequences of different reproductive strategies in marine invertebrates[M]//Battaglia B,Beardmore J A.Marine Organisms:Genetics,Ecology,and Evolution.New York:Plenum,1978:257-273.
