斑马鱼肠道细菌的16S rDNA分子鉴定及PCR-SSCP分析
2018-03-07胡秀彩吕爱军孙敬锋石洪玥YEONGYiksung裴超张超李莉
胡秀彩,吕爱军,孙敬锋,石洪玥,YEONG Yiksung,裴超,张超,李莉
(1.天津农学院水产学院,天津市水产生态及养殖重点实验室,天津300384;2.河南师范大学水产学院,河南新乡453007)
斑马鱼Danio rerio个体较小,性成熟期短,繁殖力强,胚胎透明且体外发育,易于活体观察,便于研究其遗传发育、生理病理和疾病免疫功能[1]。目前,斑马鱼已成为研究人类、动物和鱼类疾病的一种水生模式动物[1-2]。
鱼类肠道微生物是影响其生长发育等生命活动的重要因素之一。研究表明,鱼类肠道正常菌群在营养物质消化吸收、免疫反应和器官发育等方面具有重要作用,且影响鱼类的生长、发育、生理和病理[3-4]。目前,国内外对肠道微生物的研究主要集中在畜禽动物,而对鱼类肠道菌群组成的研究报道尚少[3-5]。对于鱼类肠道微生物群落结构的分析鉴定需要建立快速、准确的研究技术,其中单链构象多态性分析 (SSCP)是一种基于DNA构象差别来检测点突变的方法[6]。而PCR-SSCP方法被广泛用于未知基因突变的检测,近年来在肠道微生物多样性的分析上也有应用[7-11]。为此,本试验中通过对斑马鱼肠道细菌进行分离纯化、16S rDNA基因克隆和V3区的PCR-SSCP等系统研究,揭示斑马鱼肠道细菌种类,旨在为探讨鱼类肠道菌群结构对其生命活动的影响提供科学参考。
1 材料与方法
1.1 材料
试验用斑马鱼购自江苏省徐州市某花鸟市场。
LB固体培养基、LB液体培养基、4%NaCl嗜盐菌培养基由天津市水产生态及养殖重点实验室配制。
TCBS琼脂、SS琼脂、伊红美蓝EMB选择培养基购自杭州微生物试剂公司。UNIQ-10柱式细菌基因组DNA抽提试剂盒购自上海生工生物工程公司,dNTP、Taq DNA聚合酶、10×PCR反应试剂、PCR产物胶回收试剂盒购自上海捷瑞生物工程公司,pMD 18-T载体购自大连宝生物工程公司。
1.2 方法
1.2.1 斑马鱼肠道细菌的分离与培养特性 参照胡秀彩等[5]的方法,在无菌条件下分别将菌落接种到 LB平板、4%NaCl营养琼脂、TCBS琼脂、SS琼脂、EMB选择培养基上,于29℃下倒置培养24 h。分别挑取菌落形态特征不同的单个菌落接种到LB平板上,无菌条件下挑取单菌落多次划线进行分离纯化。获得纯化细菌菌株于4℃下保存(试管斜面)。观察细菌在普通琼脂培养基与选择培养基上的生长情况,并记录菌体培养特性。
1.2.2 细菌基因组DNA提取及16S rDNA基因PCR扩增 根据斑马鱼肠道菌株在不同平板上的菌落形态、颜色、大小等,选取12株细菌进行16S rDNA序列测定,采用UNIQ-10柱式细菌基因组DNA抽提试剂盒提取基因组DNA,经琼脂糖电泳后,将12株细菌的总DNA于-20℃下保存备用。采用大肠杆菌通用引物对16S rDNA进行扩增,正向引物序列为 5′AGAGTTTGATCATGGCTCAG 3′, 反向引物序列为 5′TACGGTTACCTTGTTACGACTT 3′。 PCR反应体系 (共 15 μL): 模板1.0 μL, 正、 反向引物各 0.5 μL, Taq PCR Master Mix 7.5 μL, 加 ddH2O 5.5 μL。 反应条件: 94 ℃下预变性4 min;94℃下变性30 s,55℃下退火30 s,72℃下延伸1 min,共进行30个循环;最后在72℃下再延伸10 min,于4℃下保存备用。
将PCR产物连接pMD-18T载体,并转化至大肠埃希菌DH5α感受态细胞中,筛选阳性克隆,经pMD-18T载体 M13的正向引物序列 5′ACTCCTACGGGAGGCAGCAG 3′、 反向引物序列 5′ATTACCGCGGCTGCTGG 3′进行PCR扩增,验证阳性克隆由上海生工生物工程有限公司测序。采用10 g/L琼脂糖凝胶电泳,EB染色检测,用紫外线分析仪拍照观察。
1.2.3 16S rDNA序列及系统发育学分析 将测序获得的16S rDNA序列,利用NCBI进行BLAST序列比对 (http://www.ncbi.nlm.nih.gov/BLAST/),基于16S rDNA序列分析,所获得序列与数据库中的参考序列应用CLUSTALX 1.8软件进行匹配比对,然后采用MEGA 4.1软件构建系统发育树。
1.2.4 16S rDNA基因V3序列的PCR-SSCP分析
以细菌总DNA为模板,用正向引物序列5′CAGTCACGACGTTGTAA 3′、 反 向 引 物 序 列5′CAGGAAACAGCTATGAC 3′扩增16S rDNA 序列。PCR反应体系 (共15 μL):正、反向引物各0.5 μL, Buffer 1.5 μL, Mg2+0.6 μL, dNTP 0.2 μL,Taq 酶 0.1 μL, 模板 1.5 μL, 加 ddH2O 至 15 μL。反应条件:94℃下预变性4 min;94℃下变性30 s,51℃下退火30 s,72℃下延伸1 min,共进行30个循环;最后在72℃下再延伸10 min,于4℃下保存备用。PCR扩增产物采用10 g/L琼脂糖凝胶电泳检测。
SSCP分析依照文献[5-6]进行,简述如下:取6 μL的PCR产物和4 μL变性缓冲液混匀,98℃下变性10 min后立即冰浴10 min,于10%PAGE中电泳,4℃、180 V条件下电泳2.5 h(Bio-Rad);电泳后先用蒸馏水洗1~2次,再用0.1%AgNO3染色15 min,最后利用2.0%NaOH(0.2%甲醛)显色,直至条带清晰为止,拍照进行SSCP带型分析。
2 结果与分析
2.1 斑马鱼肠道细菌形态及培养特征
从斑马鱼肠道中分离纯化出12株细菌,分别命名为 Zf1、 Zf2、 Zf3、 Zf4、 Zf5、 Zf6、 Zf7、 Zf8、Zf9、Zf10、Zf11和 Zf12,在 LB培养基培养24 h后12株分离细菌均为中小型菌落,多为透明或乳白色菌落。其中,菌株 Zf5、Zf6、Zf7、Zf8、Zf9在4%NaCl平板上生长缓慢,菌落形态小而圆、多为乳白色,其余7个菌株生长不良;菌株Zf1、Zf2、 Zf3、 Zf4分别在 TCBS、 TCBS、 EMB、 SS选择培养基上生长较快,并呈现出不同的颜色;菌株Zf10、Zf11和Zf12在LB培养基上生长较快,呈现为乳白色的圆形菌落 (表1)。
2.2 肠道菌株l6S rDNA基因克隆及分子鉴定
斑马鱼肠道细菌基因组总DNA电泳检测显示,12株细菌基因组DNA均大于2000 bp,可用作PCR扩增16S rDNA的模板 (图1)。
以所提取的细菌总DNA为模板进行16S rDNA PCR扩增,PCR产物用琼脂糖凝胶电泳检测,表明扩增出Zf1~Zf12菌株的16S rDNA基因片段,大小约为1500 bp(图2),用PCR检测pMD18-T/16S rDNA阳性克隆并进行测序。对斑马鱼肠道细菌测序获得的7个菌株的16S rDNA序列,利用NCBI进行BLAST序列相似性检索,结果见表2。同时结合肠道细菌形态学和培养特征,确定菌株Zf1与Zf11属于气单胞菌属Aeromonas,与菌株Aeromonas veronii为同一种细菌;Zf4与Zf8属于鞘氨醇单胞菌属 Sphingomonas,与菌株 Sphingomonas sp.为同一种菌;Zf5属于芽孢杆菌属Bacillus,与菌株Bacillus subtilis为同一种菌;Zf7属于气单胞菌属Aeromonas,与菌株Aeromonas sp.M10为同一种菌;而Zf10与非培养菌株uncultured bacterium clone GI3-M-5-G01为同一种菌,可能是一种新的菌种。

表1 细菌的形态和培养特征Tab.1 Morphological and culture characteristics of all strains

图1 菌株Zf1-Zf12基因组总DNAFig.1 Total DNA of genome from strains Zf1 to strain Zf12 in the intestine of zebrafish
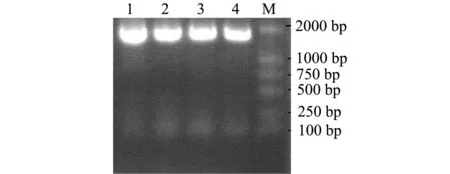
图2 菌落PCR检测pMD18-T/16S rDNA阳性克隆Fig.2 Positive clones of pMD18-T/16S rDNA in the strains by PCR

表2 16S rDNA序列测序结果分析Tab.2 Sequencing of the 16S rDNA from different isolates
通过构建16S rDNA基因序列系统发育树分析显示,以Zf1、Zf11为代表的菌株与已知种的细菌Aeromonas veronii聚为一支,亲缘关系最近,归在同一类群,且一致性达99%;而菌株Zf5则与Bacillus subtilis聚为一支,一致性达99%;而以Zf4、Zf8为代表的菌株则与Sphingomonas sp.未知细菌聚为一支,归在同一类群,一致性达99%;Zf7与Aeromonas sp.未知细菌聚为一支,一致性达99%;另外一个代表菌株Zf10则与尚未获得纯培养的菌株聚为一支,一致性达92%。以肠道大肠埃希氏菌Escherichia cdi作为参考菌株,与各菌株分支较远,可知分离的菌种与大肠埃希氏菌亲缘关系较远(图3)。

图3 以斑马鱼肠道细菌16S rDNA基因序列构建的系统发育树Fig.3 Phylogenetic tree analysis of different bacterial isolates from the intestine of zebrafish based on 16S rDNA gene sequence
2.3 16S rDNA基因V3区的PCR-SSCP分析
对12株分离菌16S rDNA V3区基因的PCRSSCP图谱显示,斑马鱼肠道细菌Zf1~Zf12的16S rDNA V3区基因存在多态性:Zf1与Zf11带型一致;Zf4与Zf8带型一致;而Zf5、Zf7、Zf10带型各不相同,与前两种带型也有所不同 (图4)。进一步对其中7株肠道细菌16S rDNA V3区基因序列进行比对 (图5),结果显示,Zf1、Zf11序列完全相同,表明为同一种菌;Zf4、Zf8序列基本相同,为同一种菌。Zf5、Zf7、Zf10序列互不相同,且与Zf1、Zf11以及Zf4、Zf8均有较大差别,初步鉴定为不同菌种,此结果与16S rDNA-SSCP图谱一致。

图4 16S rDNA V3区基因的PCR-SSCP图谱Fig.4 PCR-SSCP results of the V3 region gene of l6S rDNA of the bacteria from the intestine of zebrafish

图5 16S rDNA基因V3区基因序列比对Fig.5 Homological analysis of 16S rDNA V3 region sequences
3 讨论
3.1 鱼类肠道细菌的多样性研究
近年来,对动物肠道微生物的研究主要集中于哺乳类动物[12-14],而对模式生物斑马鱼肠道菌群进行分离鉴定的研究则鲜有文献报道[1,3]。国内对鱼类肠道菌群组成的研究起步相对较晚。迄今,相关学者对大弹涂鱼[15]、青石斑鱼[16]肠道菌群进行鉴定分析,并发现了肠道优势菌群与细菌种属,认为这些优势菌群可能是参与消化生理活动的主要菌群。樊海平等[17]研究发现,日本鳗鲡肠道中细菌数量与栖息水体、生理状态、饵料状况等有关。赵庆新[18]以草鱼、鲤等鲤科Cyprinidate鱼类为研究对象,分析了其肠道细菌的菌群结构,结果表明,鱼类肠道中主要有致病杆菌属Xenorhabdus、气单胞菌属Aeromonas、柠檬酸杆菌属Citrobacter、假单胞杆菌属Pseudomonas等。本研究中,采用PCRSSCP的分子技术鉴定方法研究了斑马鱼肠道细菌多样性,16S rDNA系统发育树分析显示,以Zf1、Zf11为代表的菌株与已知种细菌Aeromonas veronii,Zf5与 Bacillus subtilis, Zf4、 Zf8与 Sphingomonas sp.,Zf7与Aeromonas sp.分别聚为一支,且16S rDNA序列一致性高达99%;同时从斑马鱼肠道中分离获得Zf10菌株与uncultured bacterium clone一致性为92%,表明有可能为一种新分离菌株。斑马鱼肠道细菌16S rDNA分子鉴定表明,Zf1、Zf7和Zf11属于气单胞菌属Aeromonas,Zf4、Zf8属于鞘氨醇单胞菌属Sphingomonas,Zf5属于芽孢杆菌属Bacillus。此外,斑马鱼肠道细菌Zf2、Zf3、Zf6、Zf9和Zf12等分离株构建的阳性克隆,测序尚未成功,这可能与鱼类肠道细菌多样性、菌株生物学特性和试验技术条件因素有关。已有研究报道,利用宏基因组技术可进行微生物多样性结构和功能基因组研究[7]。本试验中通过对斑马鱼肠道细菌16S rDNA的基因克隆测序分析,发现Zf10与尚未获得纯培养的菌株uncultured bacterium GI3-M-5-G01聚为一支,一致性为92%,推测菌株Zf10可能是一种新分离菌种,有待进一步研究鉴定,以丰富斑马鱼肠道微生物物种资源。
3.2 鱼类肠道细菌PCR-SSCP分析
有研究表明,16S rDNA序列分析在细菌鉴定方面具有不可替代的作用,结合SSCP技术可以提高检测的特异性[9-10]。细菌16S rDNA既有保守区,也有相对变异区,因此,可以采用PCR-SSCP技术进行鉴定分析[8]。王永等[9]对于4种食源性致病菌16S rDNA的可变区进行SSCP分析,结果表明,4种致病菌16S rDNA单链构象多态性具有种属特异性。本试验结果表明,斑马鱼肠道分离菌种的SSCP图谱无论从条带的数目、相对迁移率及条带之间的间距看,相互间均存在明显差异,其中Zf1与Zf11带型一致,Zf4与 Zf8带型一致,而Zf5、Zf7、Zf10带型各不相同,与前两种带型也有所不同。通过构建16S rDNA系统进化树分析发现,其SSCP图谱差异似与亲缘关系成正比,即亲缘关系越远,差异越明显。此外,16S rDNA基因V3区片段大小约为200 bp,利用SSCP分析V3区基因片段分辨率较高,得到的图谱也较清晰;尽管如此,利用SSCP技术进行分析时也有其缺陷,比如,当分离片段较大 (>400 bp)时,会出现分辨率低、共迁移等现象[9,19]。此外,有学者利用PCR-DGGE、PCR-RFLP技术进行肠道微生物、病原菌分析鉴定研究[19-20]。本研究中,斑马鱼肠道细菌16S rDNA基因V3区的PCR-SSCP结果与16S rDNA基因序列比对结果一致,值得进一步研究。
综上所述,本研究中从斑马鱼肠道分离纯化出的12株细菌,其中气单胞菌属Aeromonas等优势菌株与其他学者研究报道结果一致[15,18],这为今后进行斑马鱼肠道菌群及其微生态功能研究提供了科学依据,也为PCR-SSCP技术应用于斑马鱼肠道细菌多样性分析提供了参考。
[1] 全珊珊,吴新荣.斑马鱼,人类疾病研究的理想模式动物[J].生命的化学,2008,28(3):260-263.
[2] 王智诚,周晓旭,王昊泽,等.长链非编码RNA及其在斑马鱼中的研究进展[J].大连海洋大学学报,2017,32(2):248-254.
[3] 宋增福,吴天星.鱼类肠道正常菌群研究进展[J].水产科学,2007,26(8):471-474.
[4] Liu Yukun,Yao Yayun,Li Huan,et al.Influence of endogenous and exogenous estrogenic endocrine on intestinal microbiota in zebrafish[J].PLoS One,2016,11(10):e0163895.
[5] 胡秀彩,王艺,吕爱军.弗氏柠檬酸杆菌的分离鉴定与PCR-SSCP 分析[J].微生物学杂志,2011,31(4):12-18.
[6] Orita M,Iwahana H,Kanazawa H,et al.Detection of polymorphisms of human DNA by gel electrophoresis as single-strand conformation polymorphisms[J].Proc Natl Acad Sci USA,1989,86(8):2766-2770.
[7] 李丽娟,张殿昌,龚世园.宏基因组技术在开发未培养微生物资源中的应用[J].水利渔业,2007,27(3):7-9,31.
[8] 刘文强,贾玉萍,赵宏坤.16S rRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2006,27(11):15-18.
[9] 王永,赵新,兰青阔,等.4种食源性致病菌的PCR-SSCP检测技术研究[J].天津农业科学,2009,15(1):13-15.
[10] Callon C, Delbès C, Duthoit F,et al.Application of SSCP-PCR fingerprinting to profile the yeast community in raw milk Salers cheeses[J].Systematic and Applied Microbiology,2006,29(2):172-180.
[11] 刘莉,王中康,俞和韦,等.贡嘎蝠蛾幼虫肠道细菌多样性分析[J].微生物学报,2008,48(5):616-622.
[12] 邱索平,凌华枢,陈文.食蟹猴肠道志贺氏菌的分离和鉴定[J].安徽农业科学,2007,35(33):10730-10736.
[13] 邱立,朱占烨,杨增岐,等.关中奶山羊肠道正常菌群的分离鉴定[J].黑龙江畜牧兽医,2007(10):77-78.
[14] 张振瑞,张力,陈桂银,等.健康家兔肠道益生菌的分离鉴定[J].中国养兔杂志,2007(2):21-24.
[15] 王伟霞,李福后,李信书.大弹涂鱼肠道细菌学分析[J].安徽农业科学,2007,35(12):3545-3549.
[16] 覃志坚,卢冬,常正义,等.PCR-SSCP法快速检测鉴定临床病原菌的探讨[J].广西医科大学学报,2003,20(3):341-343.
[17] 樊海平,曾占壮,林煜,等.养殖的日本鳗鲡肠道中细菌的数量和组成[J].台湾海峡,2005,24(4):515-519.
[18] 赵庆新.鲤科(Cyprinidate)鱼肠道菌群分析[J].微生物学杂志,2001,21(2):18-20.
[19] 罗雯,万雅各,彭宣宪,等.采用通用引物PCR配合SSCP及RFLP技术快速检测常见病原菌[J].中华微生物学和免疫学杂志,2001,21(6):687-689.
[20] 李可,郑天凌,田蕴,等.南美白对虾肠道微生物群落的分子分析[J].微生物学报,2007,47(4):649-653.
