扇贝土和黄土在刺参幼参饲料中的应用研究
2018-03-07路晶晶赵春龙郭冉崔兆进夏辉王美雪解伟杨品贤贾高旺刘春阳
路晶晶,赵春龙,郭冉,崔兆进,夏辉,王美雪解伟,杨品贤,贾高旺,刘春阳
(1.河北农业大学海洋学院,河北秦皇岛066000;2.河北省海洋与水产科学研究院河北省海洋生物资源与环境重点实验室,河北秦皇岛066000)
刺参是沉积食性的棘皮动物,以海底沉积物中的有机物为生,对蛋白质和脂肪的需求量比其他水产动物低,当蛋白质含量为18.21%~24.18%,脂肪含量为5%时,刺参可获得最大生长和最低脏壁比[1]。虽然海泥中蛋白质、脂肪含量较低,但海泥中富含大量的原生动物、有益藻、矿物质、腐殖质等,在刺参养殖过程中有着极其重要的营养作用[2-3]。目前,在刺参育苗及养成过程中,大多采用人工饲料或者藻粉搭配一定比例的海泥作为刺参饲料。随着大量的海泥作为刺参饲料的原料,海泥使用量在逐步增大。而海泥的挖掘和运输有诸多不便,在干制过程中也存在费时、易结块、营养流失等诸多问题,并且大规模地挖掘海泥势必会影响当地海域的生态环境[4]。目前,学界对海泥替代原料的研究和开发仍相对滞后,开发替代海泥的新资源成为了海参规模化养殖中亟需解决的关键问题之一[5]。为此,本研究中从节约资源、保护环境和开采简单与便捷考虑寻找可以替代海泥的新资源。
近年来,扇贝产量迅猛发展,据中国渔业统计年鉴统计2015年全国养殖扇贝量为178.54万t,同比2014年增幅为8.24%。河北沿海海湾扇贝养殖面积为5.33 hm2,扇贝起捕后,扇贝笼上附着的大量附生生物 (藻类、苔藓类、藤壶、小型原生动物等约30多种)、淤泥和扇贝壳碎片,经过晾晒、碾压至脱落后产生的混合物,即为扇贝土。目前,每年随意排放堆积的扇贝土以万吨计,不仅造成了资源的浪费,也污染环境。能否将扇贝土应用于刺参饲料中是本试验目的之一。黄土作为陆地土壤,含有丰富的以腐殖质为主的有机质、矿物质和微生物[6]。与海泥相比,黄土稍加处理即可粉碎成特定颗粒大小,简便易添加。将黄土按比例混合一定量的螺旋藻,丰富其土质中藻类的含量并用于刺参养殖,是一次大胆的新探索。本试验中,用扇贝土和按一定比例混合螺旋藻粉的黄土替代刺参饲料中的海泥,通过测定刺参生长性能和免疫性指标,分析刺参对扇贝土和黄土的利用效果,旨在为刺参养殖饲料的开发和合理化使用提供参考。
1 材料与方法
1.1 材料
试验用刺参购自山东省安源水产有限公司。采用经沉淀、过滤的秦皇岛海域自然海水养殖刺参。
扇贝土采自昌黎大蒲河扇贝养殖区 (晾晒、粉碎后过筛),螺旋藻粉购自山东无棣县,海泥和黄土取自秦皇岛市,海带购自秦皇岛天桥海鲜市场。
1.2 方法
1.2.1 试验饲料的制备 试验中将海带、海泥、黄土、扇贝土等主要原料经粉碎机粉碎后,过60目筛,采用逐级混合法将各原料混合,再于搅拌机(HYJ-30,北京环亚天元机械技术有限公司)中充分混匀,制成3种试验饲料,分别记为海泥组(SM)、扇贝土组 (SS)和黄土组 (YS)并保存于冰箱 (-20℃)中备用。饲料配方及其营养成分见表1。
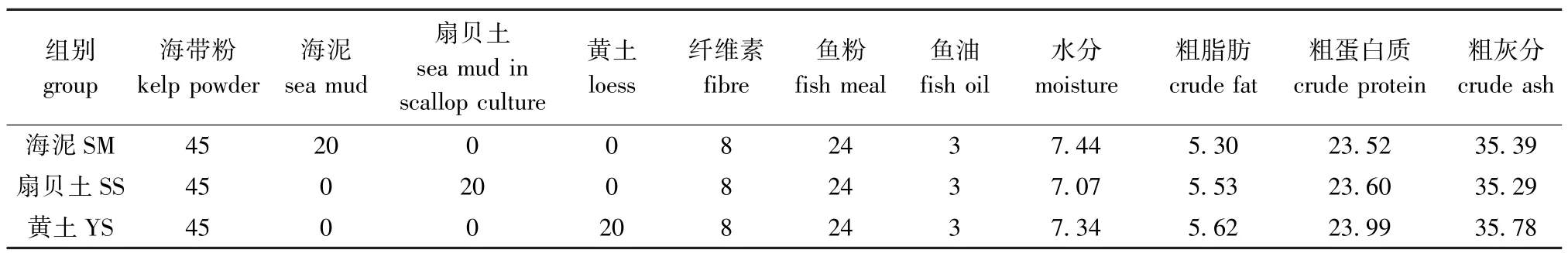
表1 饲料配方及其营养成分 (干物质)Tab.1 Ingredients of trial diets(dry matter) w/%
1.2.2 饲养管理 试验前将刺参在室内水族玻璃缸 (0.4 m×0.5 m×0.6 m)中暂养两周,以适应养殖环境。随机选取720头 (平均体质量为0.35 g)大小均匀、体色相近、健康无病的刺参幼参进行试验。试验共设置3组,每个组设3个重复,每个重复随机放80头刺参,分别饲养在9个水族玻璃缸中。试验期间,采用避光养殖,于每天10:00按刺参体质量的3%~5%进行投喂。水温为 (17±1)℃,盐度为30.5~31.5,溶解氧保持在7 mg/L以上,pH值为8.0±0.2。每天定时吸底、换水,换水量为2/3~3/4。观察刺参摄食及死亡情况并做好记录。
1.2.3 样品采集 饲养试验结束后,对所有试验刺参禁食24 h,并对各组刺参进行计数和称重。从每个平行组取11头刺参依次测量体长和称重后,用2.5 mL针管于刺参腹部1/3处抽取体腔液,并解剖刺参取出完整的肠道,再依次测定其肠道长度、肠道质量和体壁质量,计算消化道指数和脏壁比。将刺参体腔液离心 (以2500 g),取上清液于4℃下保存,用于免疫指标的测定;将肠道和体壁在液氮中迅速冷冻,取出后放于超低温冰箱 (-80℃)中保存,用于刺参肠道消化酶指标和体壁营养成分的分析。
1.2.4 指标的测定与计算
(1)生长指标。刺参的增重率、特定生长率、蛋白质效率、饲料系数、脏壁比、比肠长、比肠重计算公式分别为
增重率(WGR)=(Wt-W0)/W0×100%,特定生长率(SGR)=(ln Wt-ln W0)/t×100%,蛋白质效率(PER)=(Wt-W0)/(F×P)×100%,饲料系数(FC)=F/(Wt-W0),脏壁比=Wv/Wb×100%,比肠重=Wi/Wt,比肠长=Li/L。
其中:W0、Wt分别为试验开始和结束时刺参体质量 (g);Wv为内脏质量 (g);Wi为肠道质量 (g),Wb为体壁质量 (g);Li为刺参肠道长度 (cm);L为刺参体长 (cm);F为饲料摄食量 (g);P为饲料中蛋白质含量 (%);t为试验时间 (d)。
(2)刺参体壁营养成分。分别采用105℃烘干恒重法、马弗炉灼烧法 (550℃)、微量凯氏定氮法和索氏抽提法测定水分、粗灰分、粗蛋白质和粗脂肪含量。
(3)刺参消化、免疫指标。采用南京建成生物工程生产的试剂盒分别测定淀粉酶 (碘-淀粉比色法)、脂肪酶 (比浊法)、胃蛋白酶 (福林试剂比色法)、胰蛋白酶 (BAEE法)、溶菌酶 (LZM,自身对照法)、过氧化物酶 (POD,酚比色法)、谷胱甘肽过氧化物酶 (GSH-Px,二硫双硝基苯甲酸法)、超氧化物歧化酶 (SOD,黄嘌呤氧化酶法)、磷酸酶 (ALP和ACP,铁氰化钾法)和总抗氧化能力 (T-AOC,FRAP法)。
1.3 数据处理
试验结果采用平均数±标准差 (mean±S.D.)表示,使用SPSS 17.0软件进行单因子方差分析(One-way ANOVA),若组间有显著性差异,采用LSD法进行多重比较,显著性差异水平设为0.05。
2 结果与分析
2.1 不同饲料对刺参生长性能的影响
从表2可见:SS组和YS组刺参与对照组SM组刺参相比,在成活率、增重率、特定生长率、摄食量、蛋白质效率等指标均呈现SS组>YS组>SM组的趋势,而饲料系数则呈现SS组<YS组<SM组的趋势,各组间无显著性差异 (P>0.05);YS组刺参脏壁比显著低于SM组和SS组 (P<0.05)。
2.2 不同饲料对刺参体壁营养成分的影响
从表3可见,仅YS组刺参体壁水分含量显著高于SM组和SS组 (P<0.05),各组刺参体壁粗蛋白质、粗脂肪、粗灰分等含量均无显著性差异(P>0.05)。

表2 不同饲料对刺参生长性能的影响Tab.2 Effects of different diets on growth performance in sea cucumber

表3 不同饲料对刺参体壁营养成分的影响 (干物质)Tab.3 Effects of different diets on body wall compositionin sea cucumber(dry matter) w/%
2.3 不同饲料对刺参消化道指数的影响
从表4可见:仅YS组刺参比肠重显著低于SM组 (P<0.05):SS组和YS组刺参比肠长略高于SM组,但无显著性差异 (P>0.05)。

表4 不同饲料对刺参消化道指数的影响Tab.4 Effects of different diets on intestine-somatic indices in sea cucumber
2.4 不同饲料对刺参肠道消化酶指标的影响
从表5可见:仅SS组刺参肠道淀粉酶活力显著高于YS组 (P<0.05);SS组刺参体腔液中脂肪酶活力和胰蛋白酶活力均最高,YS组胃蛋白酶活力最高,但与其他组均无显著性差异 (P>0.05)。

表5 不同饲料对刺参肠道消化酶指标的影响Tab.5 Effects of different diets on activities of digestive enzymes in sea cucumber
2.5 不同饲料对刺参体腔液非特异性免疫指标的影响
从表6可见:SS组刺参体腔液中GSH-Px活力显著高于YS组刺参 (P<0.05),二者均显著高于SM组 (P<0.05);SM组LZM、SOD、ALP活力均高于SS和YS组,而POD、T-AOC活力均低于SS和 YS组,但组间均无显著性差异 (P>0.05)。
3 讨论
3.1 扇贝土和黄土对刺参生长及体成分的影响
在本研究中,扇贝土和黄土组刺参的成活率、增重率、特定生长率、摄食量、蛋白质效率等指标略高于海泥组,而饲料系数略低于海泥组,但无显著性差异。这与Liu等[5]和金波昌[7]用黄泥等量替代海泥投喂刺参,刺参特定生长率无显著性差异的试验结果一致。本研究中扇贝土组刺参脏壁比略低于海泥组,但混合螺旋藻的黄土组显著低于海泥组和扇贝土组,即黄土更有利于刺参体壁的增长。除黄土组体壁水分显著高于海泥组和扇贝土组外,各组刺参体壁粗蛋白质、粗脂肪和粗灰分含量无显著性差异。因此,从影响生长的指标分析,扇贝土和黄土完全替代海泥饲料在实践上是可行的。

表6 不同饲料对刺参体腔液非特异性免疫的影响Tab.6 Effects of different diets on nonspecific immunity in sea cucumber
3.2 扇贝土和黄土对刺参消化道指数和消化酶指标的影响
刺参缺乏专门的消化器官和消化腺,而海洋生物对营养物质的消化吸收与其肠道形态结构密切相关,结构越完整,小肠绒毛越稠密,对食物的吸收越好[8-9]。本研究中发现,黄土组刺参比肠重显著低于海泥组和扇贝土组,而后两组间无显著性差异;各组比肠长值无显著性差异。推测海泥和扇贝土可能有增粗刺参肠道的作用。一方面原因可能是,扇贝土和海泥在通过机械搅拌、摩擦切割藻类碎片过程中形成的物质,直接刺激刺参肠道,增加肠道中微生物的附着面积;另一方面原因可能是,通过海泥和扇贝土中微生物的间接刺激,增大与肠道的接触面积。这与魏国重等[2]研究海泥在刺参苗种培育的应用试验中的推论一致。本研究中对消化酶的研究表明,扇贝土组刺参肠道淀粉酶活力显著高于黄土组,且该组脂肪酶活力和胰蛋白酶活力也较其他两组略高。消化酶活性是反映刺参消化机能的一项重要指标,其活性的高低决定着刺参对营养物质的消化吸收能力,对生长速度有着决定性作用[10-12]。在本研究中,综合比较刺参消化酶活力,结果为扇贝土组刺参消化酶活力最佳,推测扇贝土可能一方面促进刺参消化道自身分泌消化酶,另一方面促进某些微生物进入刺参肠道分泌外源性消化酶,两者协同促进消化道对营养物质的消化吸收。
3.3 扇贝土和黄土对刺参非特异性免疫的影响
刺参不具备专门的免疫组织和器官,主要靠细胞免疫和体液免疫组成的非特异性免疫系统来防御疾病。POD、GSH-Px、SOD等抗氧化酶和磷酸酶、溶菌酶等免疫酶在刺参体液非特异性免疫系统中具有重要的作用[13-16]。本研究中发现,扇贝土组刺参体腔液中GSH-Px活力显著高于黄土组,二者均显著高于海泥组;扇贝土组和黄土组刺参体腔液POD、T-AOC活力要略高于海泥组,各组刺参的SOD、LZM和ALP活力均无显著性差异。有研究表明,扇贝壳提取物具有抗皮肤氧化损伤、抗衰老和促进脂质代谢的作用[17-19];螺旋藻中的水溶性螺旋藻多糖含有较高的糖醛酸基团、酚羟基团等酸性基团,他们通过电子转移和氢传递等作用清除机体产生的自由基和过氧化物,从而防止过氧化发生,提高抗氧化能力[20]。这与本试验中扇贝土组和黄土组刺参体腔液GSH-Px和POD等抗氧化酶活性较高的结果相一致。因此,推测扇贝土组中的扇贝和黄土组中的螺旋藻成分对于刺参抗氧化能力的增强起到了积极促进作用。
综上所述,在本试验条件下,综合考虑刺参生长、消化性能、非特异性免疫等指标,扇贝土和黄土均可以作为新资源完全替代海泥饲料,且以扇贝土为最优。
[1] 朱伟,麦康森,张百刚,等.刺参稚参对蛋白质和脂肪需求量的初步研究[J].海洋科学,2005,29(3):54-58.
[2] 魏国重,李晓月.海泥在刺参苗种培育中的应用[J].水产养殖,2011,32(5):21-22.
[3] 胡耿,耿建,刘莎莎,等.海泥对刺参幼参生长的影响[J].饲料研究,2015(18):54-55.
[4] 金波昌,董双林,林光辉.黄泥混合海藻粉投喂刺参的稳定碳同位素研究[J].中国海洋大学学报:自然科学版,2013,43(7):17-22.
[5] Liu Ying,Dong Shuanglin,Tian Xiangli,et al.Effects of dietary sea mud and yellow soil on growth and energy budget of the sea cucumber Apostichopus japonicus(Selenka)[J].Aquaculture,2009,286(3-4):266-270.
[6] 张世熔,黄元仿,李保国,等.黄淮海冲积平原区土壤有机质时空变异特征[J].生态学报,2002,22(12):2041-2047.
[7] 金波昌.池塘养殖刺参(Apostichopus japonicus)食物来源的稳定同位素法研究[D].青岛:中国海洋大学,2010.
[8] 左然涛,李敏,秦宇博,等.饲料中DHA含量对刺参成参生长及其体壁营养成分的影响[J].大连海洋大学学报,2017,32(2):172-177.
[9] 吴永恒,王秋月,冯政夫,等.饲料粗蛋白含量对刺参消化酶及消化道结构的影响[J].海洋科学,2012,36(1):36-41.
[10] 王吉桥,于红艳,姜玉声,等.饲料中用陆生植物淀粉替代鼠尾藻粉对仿刺参幼参生长和消化的影响[J].大连海洋大学学报,2010,25(6):535-541.
[11] Kennedy E J,Robinson S M C,Parsons G J, et al.Effect of lipid source and concentration on somatic growth of juvenile green sea urchins,Strongylocentrotus droebachiensis[J].Journal of the World Aquaculture Society,2007,38(3):335-352.
[12] 姚雪梅,王珺,贝荣丙,等.不同pH对糙海参消化酶活性的影响[J].海南大学学报:自然科学版,2006,24(4):389-394.
[13] 刘洪展,郑风荣,孙修勤,等.氨氮胁迫对刺参几种免疫酶活性的影响[J].海洋科学,2012,36(8):47-52.
[14] 王艳玲,李东,王秀利.海参免疫相关基因的研究进展[J].生物技术通报,2011,27(9):22-26.
[15] Yang Hongsheng,Zhou Yi,Zhang Tao,et al.Metabolic characteristics of sea cucumber Apostichopus japonicus(Selenka)during aestivation[J].Journal of Experimental Marine Biology and Ecology,2006,330(2):505-510.
[16] Møyner R,Røed K H,Sevatdal S,et al.Changes in non-specific immune parameters in Atlantic salmon,Salmo salar L.,induced by Aeromonas salmonicida infection[J].Fish&Shellfish Immunology,1993,3(4):253-265.
[17] Torita A,Miyamoto A,Hasegawa Y.The effects of scallop shell extract on collagen synthesis[J].Fisheries Science,2007,73(6):1388-1394.
[18] Liu Yunchun,Torita A,Hasegawa Y.Scallop shell extract inhibits squalene monohydroperoxide-induced skin erythema and wrinkle formation in rat[J].Fisheries Science,2008,74(1):217-219.
[19] Liu Yunchun,Natsui N,Hasegawa Y.Promotion of lypolysis activity in mouse C3H10T1/2 adipocyte cells by components from scallop shells[J].Fisheries Science,2006,72(3):702-704.
[20] 张文,吴清平,吴军林.螺旋藻营养保健价值及开发应用进展[J].食品与发酵科技,2013,49(3):89-92.
