新加坡石斑鱼虹彩病毒ORF39L基因克隆、表达及抗体的制备
2018-03-07张红莲夏立群秦启伟
张红莲, 夏立群, 秦启伟
(1.广东海洋大学食品科技学院,广东湛江524088;2.广东海洋大学现代生物化学实验中心,广东 湛江524088;3.广东海洋大学深圳研究院,广东深圳518108;4.广东海洋大学 水产学院,广东 湛江 524088;5.华南农业大学 海洋学院,广东 广州510301)
虹彩病毒 (grouper iridovirus,GIV)是一类侵染昆虫、爬行动物、鱼类等生物并能在宿主细胞质形成包涵体的二十面体双链DNA病毒[1],因其病毒粒子在病毒感染的宿主体内或在纯化浓缩的病毒沉淀物中呈周期性间隔的异常整齐排列,形成晶格平面并互相重叠,当有斜射光线照射时呈现蓝色或紫色虹彩,故命名为虹彩病毒。隶属于虹彩病毒科、蛙病毒属的新加坡石斑鱼虹彩病毒 (Singapore grouper iridovirus,SGIV),是近年严重危害中国和东南亚国家石斑鱼养殖的一种鱼类传染性病毒,该病毒能诱导石斑鱼脾细胞以类凋亡这种无DNA片段化的程序性细胞死亡方式使患病鱼脾脏肿大出血,致死率高达90%[2-4]。目前,学界已经完成了关于SGIV的一些基础研究工作,如病毒的分离鉴定、基因组学、转录组学、蛋白组学和快速检测方法等[5-8]。研究SGIV重要基因的功能,对探索该病毒感染的发生机制,制定病毒防控策略具有重要的意义。目前,对SGIV重要功能基因的研究已经陆续在国内外展开[9-16]。
SGIV ORF39L是根据SGIV全基因组转录图谱确定的晚期基因[7],编码一个丝氨酸-苏氨酸蛋白激酶,是虹彩病毒科核心基因[17]。核心基因所编码的蛋白可以在宿主细胞内广泛地进行复制和传播,在病毒感染过程中具有重要作用。目前,国内外还未见有对SGIV ORF39L基因功能的研究报道。为研究ORF39L在病毒侵染过程中的作用机制,本研究中拟先制备ORF39L表达蛋白的抗体。ORF39L的开放阅读框长3153 bp,编码1051个氨基酸,预测的分子量为118.2 ku,序列结构预测表明,ORF39L基因结构庞大,直接将其在大肠杆菌中进行原核表达有一定困难。为此,本研究中利用生物信息学方法预测了ORF39L抗原表位基因片段,在大肠杆菌中进行融合表达,并将表达蛋白纯化后制备抗体,利用抗体进行了间接免疫荧光试验,旨在为进一步研究ORF39L基因在SGIV感染过程中的作用机制提供数据资料。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞、菌株和质粒 新加坡石斑鱼虹彩病毒 (SGIV)[2]和GS细胞[18](石斑鱼脾细胞,grouper spleen cells)由华南农业大学海洋学院秦启伟教授实验室提供。大肠杆菌DH5α、大肠杆菌BL21(DE3)和表达载体pET32a+购自Novagen公司。
1.1.2 细菌和细胞培养基
LB细菌培养基:蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH为7.2~7.4,15 g/L琼脂,定容至1000 mL,高压灭菌,4℃下保存。LB液体培养基不加琼脂。
GS细胞培养基:L15培养基 (Leibovitz's-15 GIBCO购自Invitrogen公司)。
1.1.3 工具酶和试剂 PrimeSTAR DNA聚合酶、限制性核酸内切酶、T4DNA连接酶、DNA Maker均购自TaKaRa公司;PCR片段纯化、DNA凝胶回收及质粒微量提取试剂盒均购自Axygen公司;蛋白Maker购自Fermentas公司;异丙基-B-D-硫代半乳糖苷 (IPTG)、二氨基联苯胺 (DAB)购自BBI公司;BCA-100蛋白质定量测定试剂盒和镍琼脂糖凝胶FF预成柱分别购自上海申能博采公司和北京韦氏博慧色谱科技有限公司;His-Tag单克隆抗体和辣根过氧化物酶 (HRP)-标记的羊抗鼠IgG二抗购自Pierce公司;聚偏二氟乙烯 (PVDF)膜购自Millinpore公司。
提取病毒 DNA的碱裂解缓冲液:0.2 mol/L NaCO3, 0.3 mol/L NaCl, 0.02 mol/L EDTA。
1.1.4 免疫小鼠及相关试剂 免疫用6周龄雄性BALB/c小鼠,购自广东省实验动物中心,为SPF级标准。弗氏完全佐剂 (FCA)和弗式不完全(FIA)佐剂购自Sigma公司。
PBS 溶 液: 8 g NaCl, 0.2 g KCl, 1.44 g Na2HPO4和0.24 g KH2PO4,pH 7.4,用双蒸水定容至1 L,高压灭菌,室温保存。
1.1.5 间接免疫荧光试验相关试剂 4%的多聚甲醛:称取4 g多聚甲醛,溶于80 mL双蒸水,逐步滴加1 moL/L NaOH(约2 mL),边加边摇匀,待其全部溶解后,定容至100 mL,保存于棕色瓶中;异硫氰酸荧光素 (FITC)-羊抗鼠IgG购自美国Sigma公司;4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)购自美国Biotium公司;抗荧光淬灭封片剂购自美国Pierce公司。
1.2 方法
1.2.1 生物信息学分析抗原表位基因 应用DNA Star 5.0软件分析SGIV VP39蛋白的二级结构、亲(疏)水性、柔韧性和表面可及性。采用Jameson-Wolf法分析VP39蛋白的抗原表位,并利用网站http://www.cbs.dtu.dk/services/Bepipred在线分析VP39蛋白潜在的B细胞蛋白抗原表位。
1.2.2 SGIV总DNA的提取 总DNA的提取方法参考 《分子克隆实验指南》第三版 (上册)[19]。
1.2.3 SGIV ORF39L基因原核表达载体的构建和表达 根据 SGIV(基因库登录号:AY521625)ORF39L(核苷酸的位置:34262-37417)的序列和质粒pET32a+的MCS酶切位点,采用Primer 5.0软件设计引物。
pET32a-39Ag1:
上游引物 5′GCCGAATTCATGGCTGATAATCTGAGC3′(EcoRI);
下游引物 5′GCGCTCGAGTTATACTGGCCCTCCTAC3′(XhoI)。
pET32a-39Ag2:
上游引物 5′GCGGATCCATGGGAGGGCCAGTATATC 3′(BamHI);
下游引物5′GCGAAGCTTGTTATCTGAACGCGGGTC 3′(HindⅢ)。
引物合成在上海英骏生物技术有限公司完成。
PCR循环反应条件:95℃下预变性5 min;94℃下变性30 s,52℃下退火30 s,72℃下延伸30 s,共进行33个循环;最后于72℃下再延伸7 min。反应结束后,将PCR产物纯化回收,利用限制性核酸内切酶分别酶切pET32a+质粒和PCR产物后,用T4DNA连接酶连接过夜,次日热激转化入大肠杆菌DH5α感受态细胞中,用琼脂糖凝胶电泳鉴定菌落PCR后,将阳性克隆测序,从测序正确的阳性克隆中分别提取质粒pET32a-39Ag1和pET32a-39Ag2,再次热激转化入大肠杆菌BL21(DE3)感受态细胞中,将转化后的BL21(DE3)涂布于LB平板上培养7~8 h,长出的单菌落即为表达融合蛋白的原核重组菌BL21/pET32a-39Ag1和BL21/pET32a-39Ag2。挑取阳性单菌落接种于10 mL LB液体培养基中,37℃下以200 r/min震荡培养8 h活化后,再按照1%(体积比)的比例转接于新鲜的LB液体培养基中,37℃下以200 r/min震荡培养至菌体浓度OD600nm值约为0.6,加入诱导剂IPTG至终浓度为0.7 mmol/L,继续培养6 h。培养结束后取菌悬液1 mL,以10 000 r/min离心1 min收集菌体,进行SDS-PAGE分析。以上使用的LB平板和LB液体培养基均为含氨苄青霉素浓度为100 μg/mL的选择培养基。
1.2.4 融合蛋白的纯化 参考夏立群等[20]方法。1.2.5 抗血清的制备 将纯化好的融合蛋白与等体积的弗氏完全佐剂 (FCA)或弗氏不完全佐剂(FIA)混匀免疫BALB/c小鼠。取6周龄雄性BALB/c小鼠,每只小鼠每次皮下注射约30 μg纯化的融合蛋白,首次注射液为蛋白与等体积完全佐剂 (FCA)混匀制备,之后3次注射液为蛋白与等体积弗氏不完全佐剂 (FIA)混匀制备。每隔7 d免疫注射1次,共4次。阴性对照注射液为佐剂加PBS,注射方法同上。末次免疫注射一周后,从小鼠眼球取血,4℃下过夜,次日离心分离血清,于-80℃下分装保存。采用酶联免疫吸附法(ELISA)测定抗血清效价。
1.2.6 Western-blot蛋白印迹分析 利用诱导表达的重组菌SDS-PAGE电泳进行融合蛋白检测。经SDS-PAGE电泳后,于4℃条件下,200 mA转膜约80 min,将蛋白转移至PVDF膜上。用5%脱脂牛奶室温下封闭1 h,用TBST(20 mmol/L Tris-HCl+150 mmol/L NaCl+0.05%Tween 20, pH 为7.4)漂洗 3次,每次 5 min。分别加入一抗(1∶5000稀释的鼠抗 SGIV VP39Ab1血清或鼠抗SGIV VP39Ab2血清),室温下封闭孵育2 h,用TBST漂洗3次,每次5 min;再加入二抗 (HRP标记的羊抗鼠IgG,1∶5000稀释),室温下封闭孵育2 h,用TBST漂洗3次,每次5 min;最后加入DAB显色液,避光显色30~60 s,水洗终止反应后,观察显色条带,拍照保存,判断制备的多克隆抗体特异性。利用SGIV感染的GS细胞进行细胞水平检测的Western-blot方法同上。
1.2.7 间接免疫荧光 (IFAT)试验 将GS细胞传代至6孔细胞培养板中的无菌盖片上。24 h后,接种约1 MOI(感染复数)的SGIV。分别于感染12 h和24 h后,将盖玻片从培养板中小心取出,以pH为7.4的PBS清洗细胞1次;用4%多聚甲醛固定细胞1 h,以pH为7.4的PBS清洗细胞3次;用冰乙醇 (100%)透化7 min,用PBS清洗细胞2次。以2%牛血清白蛋白 (BSA)室温下封闭1 h。用1∶75稀释的抗SGIV VP39鼠血清作为一抗 (同时设以阴性血清为一抗的对照),37℃下孵育细胞1 h,用PBS清洗细胞4次;用1∶75稀释的FITC标记羊抗鼠IgG作为二抗,37℃下避光孵育细胞1 h,用 PBS清洗细胞3次;以 DAPI(4′,6-二脒基-2-苯基吲哚二盐酸盐) (用PBS稀释至终浓度1 μg/mL)室温下避光染核10 min,用PBS清洗细胞3次;再用抗荧光淬灭剂将盖玻片的细胞面贴在载玻片上,置于荧光显微镜下观察。
2 结果与分析
2.1 预测SGIV ORF39L抗原表位基因片段
横轴为蛋白质的氨基酸位置,纵轴为杰弗森-沃夫 (Jameson-Wolf)抗原指数。位于横轴以上连续的峰值区间即为潜在的抗原表位,通过DNAStar软件分析SGIV VP39蛋白的二级结构、亲 (疏)水性、柔韧性和表面可及性。从图1可见,VP39蛋白的二级结构中,α螺旋、β-折叠、转角和无规则卷曲从N末端到C末端均有分布,该蛋白的亲水性、柔韧性和表面可及性区域较多。
SGIV VP39蛋白的抗原表位结果如图2所示,其中,1~1050位氨基酸大部分肽段都可作为潜在的抗原。利用网站 http://www.cbs.dtu.dk/services/Bepipred在线预测得到的SGIV VP39蛋白的抗原表位肽段有43个,分布位置和软件分析的结果类似。基于以上分析,选取N末端氨基酸的两段基因序列39Ag1(1~414 bp)和39Ag2(402~783 bp)分别进行克隆表达和制备抗体。
2.2 SGIV ORF39L抗原表位基因片段克隆
高保真PCR扩增预测的SGIV ORF39L抗原表位基因39Ag1和39Ag2,用10 g/L的琼脂糖凝胶电泳分析PCR产物结果。从图3可见:在250~500 bp区间得到了39Ag1和39Ag2的目标带,与理论结果39Ag1为414 bp、39Ag2为381 bp大小相符合。证明扩增目标带成功。切胶回收后,将其连接入pET32a+载体,阳性克隆送到上海英骏公司测序,测序结果用Clustalx 1.83软件与NCBI(美国国立生物技术信息中心 https://www.ncbi.nlm.nih.gov/)已报道的序列进行比对分析,结果表明,插入基因片段序列正确,将构建成功的重组质粒命名为pET32a-39Ag1和pET32a-39Ag2。
2.3 SGIV ORF39L的原核表达
将pET32a-39Ag1、pET32a-39Ag2质粒转化至大肠杆菌BL21(DE3)中,经IPTG诱导,分别以未经诱导的含重组质粒pET32a-39Ag1和pET32a-39Ag2的BL21(DE3)菌体作为阴性对照,与未融合重组菌全菌蛋白电泳条带相比,在分子量约35 ku处均有一条超强蛋白带的融合蛋白(图4),其中,VP 39Ag1蛋白的预计分子量约为15.79 ku,VP 39Ag2蛋白的分子量约为14.94 ku,pET32a+表达的融合标签为20.4 ku。与预期相符,说明目的蛋白成功表达,对其分别命名为pET32a-VP39Ag1和 pET32a-VP39Ag2。
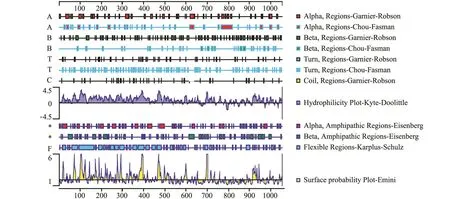
图1 SGIV VP39蛋白的二级结构、亲水性、柔韧性及表面可及性图Fig.1 Secondary structure, hydrophilicity, flexibility and surface accessibility of SGIV VP39 protein
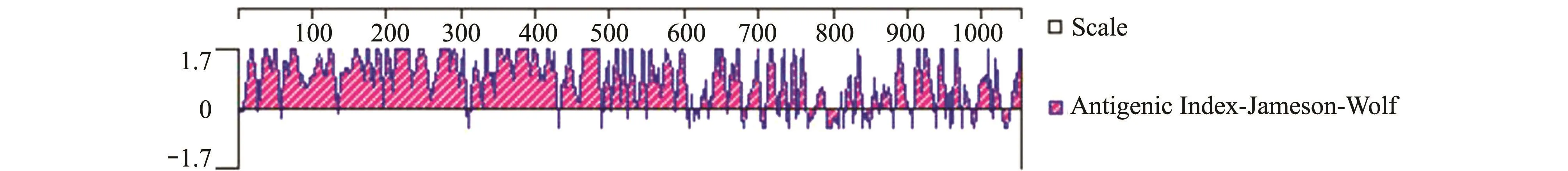
图2 SGIV VP39蛋白的抗原表位分析Fig.2 Analysis of the antigenic index of SGIV VP39 protein
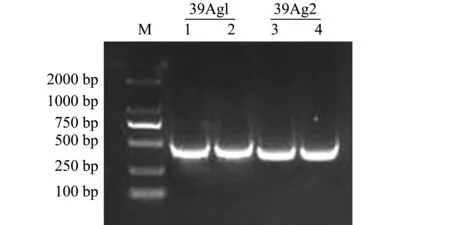
图3 琼脂糖凝胶电泳分析39Ag1和39Ag2的PCR产物Fig.3 Agarose gel electrophoresis analysis of PCR products of 39Ag1 and 39Ag2 genes
2.4 融合蛋白的纯化
用SDS-PAGE分析融合蛋白pET32a-VP39Ag1和pET32a-VP39Ag2纯化的结果如图5所示。纯化的融合蛋白浓度用Bradford法测定,洗脱第一次、第二次和第三次收集液中纯化的VP39Ag1融合蛋白浓度分别为 1140.07、 121.31、 11.45 μg/mL,纯化的VP39Ag2融合蛋白浓度分别为1129.013、133.310、8.750 μg/mL。由此可见,纯化蛋白浓度完全可以用于小鼠免疫。
2.5 Western-blot法检测制备的多克隆抗体的特异性
ELISA法检测表明,获得的 VP39Ab1和VP39Ab2多克隆抗体效价均为1∶15 000。分别用纯化的融合蛋白pET32a-VP39Ag1和pET32a-VP39Ag2进行SDS-PAGE电泳后转PVDF膜,用不同小鼠来源的免疫血清作为一抗分别进行孵育,每只小鼠免疫血清孵育一条PVDF膜,Westernblot结果发现,在分子量为35 ku附近有明显的条带 (图6),证明所制备的多克隆抗体39Ab1和39Ab2分别对融合蛋白 pET32a-VP39Ag1和pET32a-VP39Ag2有特异性。同时,本试验中用感染了SGIV病毒的GS细胞检测,结果证实了多克隆抗体39Ab1和39Ab2均能与分子量为118.2 ku的蛋白带发生特异反应 (图7),说明所制备多克隆抗体在细胞水平上可以检测VP39蛋白。
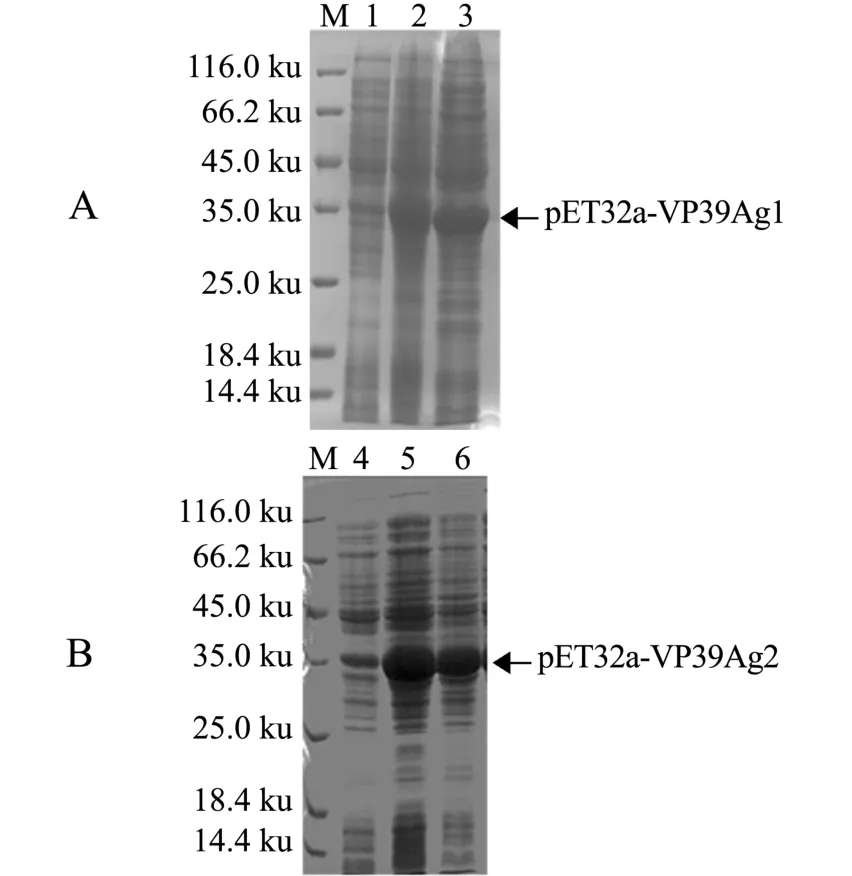
图4 VP39Ag1和VP39Ag2蛋白在大肠杆菌中表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of VP39Ag1 andVP39Ag2 expressed in E.coli BL21
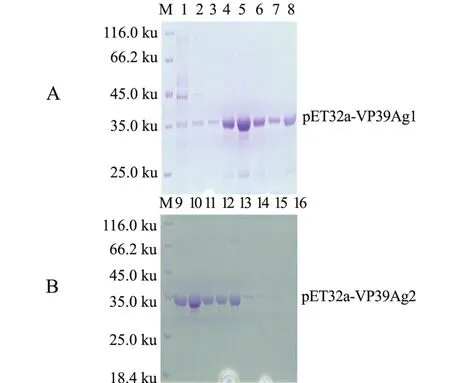
图5 SDS-PAGE分析融合蛋白pET32a-VP39Ag1和pET32a-VP39Ag2纯化的结果Fig.5 SDS-PAGE analysis of purification recombinant proteinspET32a-VP39Ag1 productand pET32a-VP39Ag2 product

图6 Western-blot法分析抗血清39Ab1和39Ab2对融合蛋白pET32a-VP39Ag1 and pET32a-VP39Ag2的特异性Fig.6 Western-blot analysis of the specificity of antiserum 39Ab1 and 39Ab2 to the fusion protein pET32a-VP39Ag1 and pET32a-VP39Ag2

图7 Western-blot法分析抗血清39Ab1和39Ab2对SGIV VP39蛋白的特异性Fig.7 Western-blot analysis of the specificity of antiserum 39Ab1 and 39Ab2 to SGIV VP39 protein
2.6 间接免疫荧光 (IFAT)试验
利用制备的VP39多克隆抗体进行间接免疫荧光试验,以确定VP39参与了SGIV在GS细胞中的装配。结果发现,在SGIV感染GS细胞12 h后,就可以在细胞中检测到VP39的绿色荧光信号,且绿色荧光全细胞分布 (图8)。而阴性对照细胞中则无绿色荧光出现。随着时间延长,感染24 h后,VP39分布在病毒装配区 (病毒加工厂),说明VP39参与了SGIV病毒的装配过程。
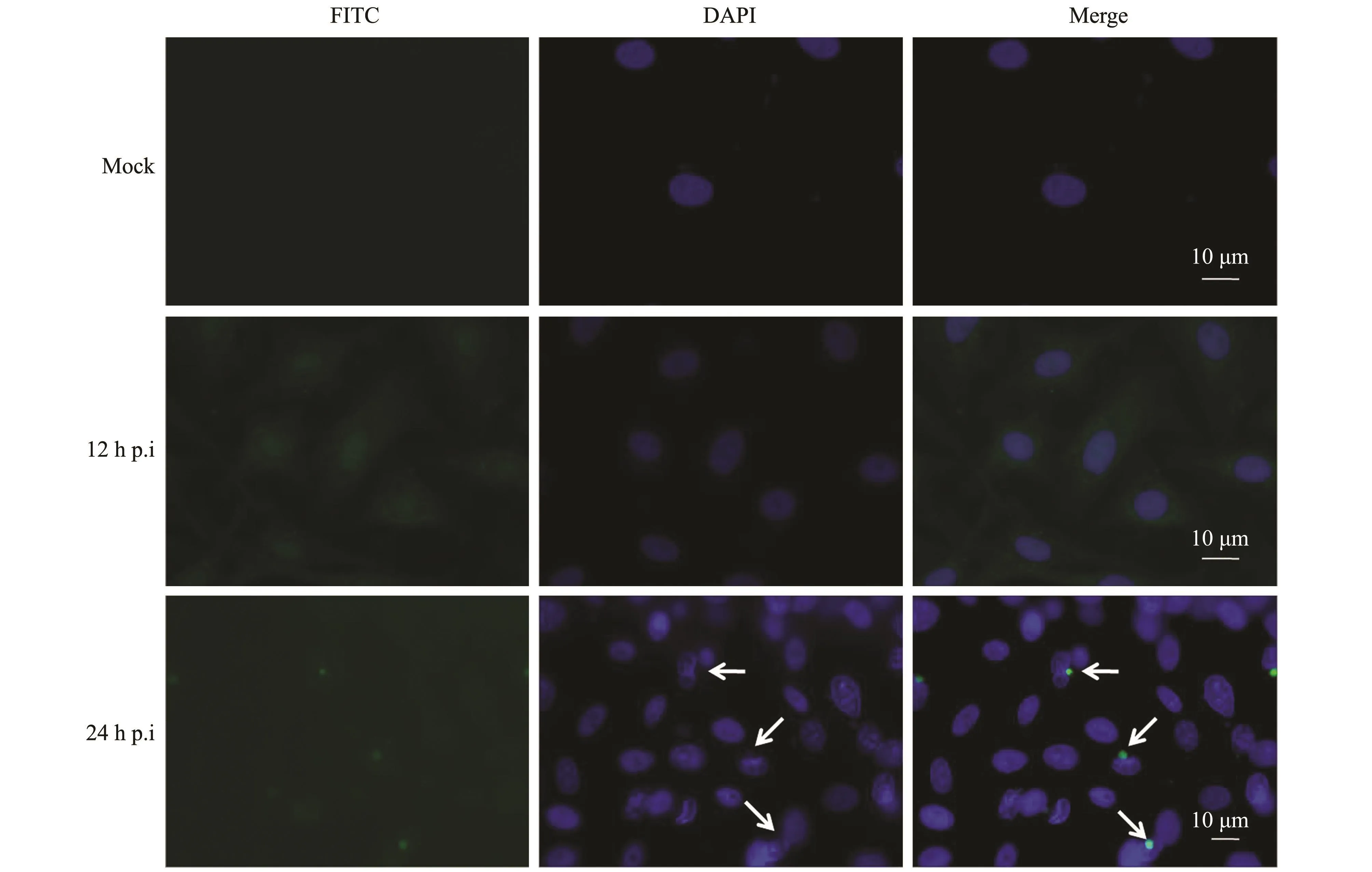
图8 间接免疫荧光检测VP39在SGIV感染GS细胞过程中的表达Fig.8 Indirect Immunofluorescence detection of VP39 in SGIV-infected GS cells at different time
3 讨论
本研究中主要着眼于SGIV ORF39L的原核表达、蛋白纯化和抗体制备,以及抗体在免疫荧光试验中的应用。鉴于ORF39L基因结构庞大,直接在大肠杆菌中进行融合表达有一定的困难,为此,本试验中首先利用生物信息学方法预测SGIV ORF39L抗原表位基因片段,应用DNA Star 5.0软件子程序Protean分析了SGIV VP39蛋白的二级结构及亲 (疏)水性、柔韧性和表面可及性。其中,采 用 Kyte-Doolittle、 Karplus-Schultz、 Emini、Jameson-Wolf方法,分别预测氨基酸的亲水性、氨基酸的柔韧性、氨基酸的表面可能性、潜在的B细胞抗原表位。一般来说,蛋白质各氨基酸残基分为亲水残基和疏水残基两类[21],疏水性残基一般被埋在蛋白内部,亲水性残基位于蛋白质表面,亲水性残基与蛋白抗原表位有着密切的联系。Hopp等[22]认为,氨基酸序列中抗原表位存在的区域一般具有较强亲水性;蛋白质抗原构象的多肽链骨架具有一定程度的柔韧性,柔韧性强的氨基酸残基其可塑性大,从与抗体进行嵌合的角度来说,柔韧性高的氨基酸区域形成抗原表位的可能性较大一些[23];表面可及性是指蛋白质抗原中氨基酸残基被溶剂分子接触的可能性,表面可及性参数高的氨基酸区域也更易于构成抗原表位[24]。从VP39蛋白氨基酸序列的亲水性、柔韧性和表面可及性方面分析 (图1),VP39蛋白具有多个抗原表位。采用Jameson-Wolf法和网站 http://www.cbs.dtu.dk/services/Bepipred在线分析VP39蛋白潜在的B细胞蛋白抗原表位,也证实了DNA Star 5.0软件分析的结果,考虑到抗原太小不利于后续的试验进行,本试验中选取了比较大的两个基因片段在大肠杆菌中进行融合表达、蛋白纯化和抗体制备,间接免疫荧光试验结果表明,依据抗原表位分析结果克隆、表达、免疫后制得的多克隆抗体,能在细胞水平上较好地检测到VP39蛋白。
虹彩病毒在宿主细胞的细胞核与细胞质中分别进行了其生命周期中的不同复制,对于病毒蛋白在细胞内的定位研究可为其功能研究提供非常有用的参考。有研究表明[25-26],虹彩病毒感染是通过细胞内吞方式进入宿主细胞内部,在细胞内部分两个阶段 (细胞核阶段和细胞质阶段)复制:在细胞核内,病毒粒子以甲基化的病毒基因组DNA作模板,利用宿主细胞的II型RNA聚合酶和病毒早期基因复制、转录和表达出病毒基因编码的DNA聚合酶,再通过DNA聚合酶合成的病毒DNA,然后转运到细胞质,在细胞质内开始第二阶段病毒基因组DNA的复制,形成了长的DNA多联体,最后加工切割成成熟的DNA,当晚期基因转录并表达出病毒的结构蛋白后,在细胞质中完成病毒的组装。成熟的病毒粒子会集中在细胞质的一个或多个病毒装配区 (viral assembly sites),也称为病毒加工厂(viral factory)的地方。在本试验中,SGIV感染晚期的GS细胞质内VP39在病毒装配区处呈现强烈的绿色荧光,与病毒加工厂共定位,说明VP39参与了SGIV的装配,有可能是病毒的结构蛋白。病毒结构蛋白往往能够作为病毒的抗原使用,因此,在研究病毒疫苗时应将其作为重要的研究对象。
本研究中通过对SGIV ORF39L基因克隆表达和抗体的制备,为探索SGIV感染石斑鱼的致病机理、开发有效疫苗,以及防治虹彩病毒病害提供了科学依据。
[1] 孙志鹏,徐祥,李强,等.真鲷虹彩病毒辽宁株跨膜蛋白(ORF049L)基因的克隆及表达[J].大连海洋大学学报,2013,28(2):148-153.
[2] Qin Q W,Lam T J,Sin Y M,et al.Electron microscopic observations of a marine fish iridovirus isolated from brown-spotted grouper,Epinephelus tauvina[J].Journal of Virological Methods,2001,98(1):17-24.
[3] Qin Q W,Chang S F,Ngoh-Lim G H,et al.Characterization of a novel ranavirus isolated from grouper Epinephelus tauvina[J].Diseases of Aquatic Organisms,2003,53(1):1-9.
[4] Huang X H,Huang Y H,Ouyang Z L,et al.Singapore grouper iridovirus,a large DNA virus,induces nonapoptotic cell death by a cell type dependent fashion and evokes ERK signaling[J].Apoptosis,2011,16(8):831-845.
[5] Song W J,Qin Q W,Qiu J,et al.Functional genomics analysis of Singapore grouper iridovirus:complete sequence determination and proteomic analysis[J].Journal of Virology,2004,78(22):12576-12590.
[6] Song W J,Lin Q S,Joshi S B,et al.Proteomic studies of the singapore grouper iridovirus[J].Molecular and Cellular Proteomics,2006,5(2):256-264.
[7] Teng Y,Hou Z W,Gong J,et al.Whole-genome transcriptional profiles of a novel marine fish iridovirus,Singapore grouper iridovirus(SGIV)in virus-infected grouper spleen cell cultures and in orange-spotted grouper, Epinephulus coioides[J].Virology,2008,377(1):39-48.
[8] Mao X L,Zhou S,Xu D,et al.Rapid and sensitive detection of Singapore grouper iridovirus by loop-mediated isothermal amplification[J].Journal of Applied Microbiology,2008,105(2):389-397.
[9] Wang F,Bi X Z,Chen L M,et al.ORF018R,a highly abundant virion protein from Singapore grouper iridovirus,is involved in serine/threonine phosphorylation and virion assembly[J].Journal of General Virology,2008,89(5):1169-1178.
[10] Xia L Q,Cao J H,Huang X H,et al.Characterization of Singapore grouper iridovirus(SGIV)ORF086R,a putative homolog of ICP18 involved in cell growth control and virus replication[J].Archives of Virology,2009,154(9):1409-1416.
[11] Wan Q J,Gong J,Huang X H,et al.Identification and characterization of a novel capsid protein encoded by Singapore grouper iridovirus ORF038L[J].Archives of Virology,2010,155(3):351-359.
[12] Zhou S,Wan Q J,Huang Y H,et al.Proteomic analysis of Singapore grouper iridovirus envelope proteins and characterization of a novel envelope protein VP088[J].Proteomics,2011,11(11):2236-2248.
[13] Huang X H,Gong J,Huang Y H,et al.Characterization of an envelope gene VP19 from Singapore grouper iridovirus[J].Virology Journal,2013,10:354.
[14] Zhang H L,Zhou S,Xia L Q,et al.Characterization of the VP39 envelope protein from Singapore grouper iridovirus[J].Canadian Journal of Microbiology,2015,61(12):924-937.
[15] Wang F,Liu Y,Zhu Y,et al.Singapore grouper iridovirus ORF75R is a scaffold protein essential for viral assembly[J].Scientific Reports,2015,5:13151.
[16] Yuan Y M,Wang Y Z,Liu Q Z,et al.Singapore grouper iridovirus protein VP088 is essential for viral infectivity[J].Scientific Reports,2016,6:31170.
[17] Eaton H E,Metcalf J,Penny E,et al.Comparative genomic analysis of the family Iridoviridae:re-annotating and defining the core set of iridovirus genes[J].Virology Journal,2007,4:11.
[18] Huang X H,Huang Y H,Sun J J,et al.Characterization of two grouper Epinephelus akaara cell lines:application to studies of Singapore grouper iridovirus(SGIV)propagation and virus-host interaction[J].Aquaculture,2009,292(3-4):172-179.
[19] 萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].黄培堂,译.3 版.北京:科学出版社,2002:27-30.
[20] 夏立群,张红莲,梁海鹰,等.新加坡石斑鱼虹彩病毒ORF086蛋白的原核表达、纯化及抗体制备[J].上海海洋大学学报,2010,19(1):1-6.
[21] 纪锋,徐黎明,赵景壮,等.鲤春病毒血症病毒Shlj1株糖蛋白空间结构及其B细胞抗原表位的预测[J].大连海洋大学学报,2017,32(4):440-446.
[22] Hopp T P,Woods K R.Prediction of protein antigenic determinants from amino acid sequences[J].Proceedings of the National Academy of Sciences of the United States of America,1981,78(6):3824-3828.
[23] Karplus P A,Schulz G E.Prediction of chain flexibility in proteins[J].Naturwissenschaften,1985,72(4):212-213.
[24] Emini E A,Hughes J V,Perlow D S,et al.Induction of hepatitis a virus-neutralizing antibody by a virus-specific synthetic peptide[J].Journal of Virology,1985,55(3):836-839.
[25] Jancovich J K,Chinchar V G,Hyatt A,et al.Family iridoviridae[M]//King A M Q,Lefkowitz E,Adams M J,et al.Virus taxonomy:ninth report of the International Committee on Taxonomy of Viruses.San Diego,CA:Elsevier,2012:193-210.
[26] Yamauchi Y,Helenius A.Virus entry at a glance[J].Journal of Cell Science,2013,126(6):1289-1295.
