胸腔积液γ-干扰素释放试验对结核性胸腔积液诊断价值的Meta分析
2018-03-07李慧敏马清光李洪英
李慧敏, 马清光, 李洪英
(上海市大场医院检验科,上海 200444)
胸腔积液是临床常见症状,由结核、肿瘤、肺炎等多种病因造成。能否快速确诊结核性胸腔积液会对患者的转归起到关键性作用。而传统的病原学检查,如结核培养和涂片的阳性率较低,胸膜活检是侵入性操作,技术难度较大。近年来有报道称胸腔积液γ-干扰素释放试验(interferon-gamma release assay ,IGRA)对诊断结核性胸腔积液有较高的价值[1-10],但由于单项研究存在样本量偏小、阈值效应等问题,而且国外也有IGRA对结核性胸膜炎诊断价值较低的报道[11-12]。同时鉴于我国结核病的发病率较高,为进一步明确IGRA对结核性胸腔积液的诊断价值,本研究采用Meta分析对当前相关研究进行统计分析,以期为胸腔积液IGRA的临床应用提供更可靠的依据。
1 材料和方法
1.1 文献纳入标准和排除标准
1.1.1 纳入标准 (1)研究类型:国内外已发表的研究胸腔积液IGRA诊断结核性胸腔积液的相关文献。(2)研究对象:结核性胸膜炎患者,依据金标准进行诊断:胸膜活检发现干酪样坏死或肉芽肿性炎,痰或胸腔积液涂片抗酸染色阳性或结核培养查到抗酸杆菌,诊断性抗结核治疗后患者胸腔积液减少或全身症状缓解。(3)方法:待评价试验为IGRA,包括结核感染T细胞检测(T-SPOT.TB)和QuantiFERON TB(QFT)。(4)结局指标:合并敏感性、合并特异性、合并阳性似然比、合并阴性似然比、合并诊断优势比、汇总受试者工作特征(summary receiver operating characteristic,SROC)曲线的曲线下面积(area under curve,AUC)。
1.1.2 排除标准 (1)重复发表的文章。(2)不同的文章疑似采用了相同的病例,排除质量相对不好者。(3)重要数据报告缺失或指标不明确的文章。(4)排除对照组患者有人类免疫缺陷病毒感染、免疫抑制剂使用史,且对照组仅有肿瘤性胸腔积液单一病种的文献。
1.2 检索策略
使用计算机检索PubMed、EMbase、Medline、The Cochrane Library(2015年第6期)、中国知网、万方数据和维普网,全面收集胸腔积液IGRA诊断结核性胸腔积液的相关研究。中文文库检索词包括γ-干扰素释放试验、T-SPOT、IGRA、ELISASPOT、胸腔积液和胸膜炎;英文文库检索词包括Tuberculous Pleurisies、pleural、interferon gamma release assay、T spot、enzyme-linked immunosorbent spot等。检索时限均为从建库至2016年7月1日。以PubMed为例,其具体检索策略见图1。

图1 PubMed检索策略
1.3 文献筛选、资料提取和质量评价
由2位评价员独立筛选文献,提取资料,评价所纳入研究的偏移风险,遇到有分歧时讨论解决或交由第三方协助裁定。主要内容包括文献偏移风险评价的相关内容、第一作者、发表时间、研究来源、例数、诊断方法以及四格表数据[真阳性(true positivity,TP)、真阴性(true negativity,TN)、假阴性(false negativity,FN)、假阳性(false positivity,FP)]等。采用QUADAS-2[13](Quality Assessment of Diagnostic Accuracy Studies-2)工具进行所纳入研究的偏移风险评价。
1.4 统计学方法
采用Meta-Disc 1.4软件进行Meta分析,采用Stata软件分析发表偏移。计算合并敏感性、合并特异性、合并阳性似然比、合并阴性似然比、合并诊断优势比,绘制SROC 曲线并计算AUC。
2 结果
2.1 文献检索结果
初检共获得相关文献734篇,经逐层筛选,仅纳入用金标准进行诊断的文献,按照排除标准排除不符合要求的文献,最终获得27项研究[3-31],共包括2 072例患者。其中21项研究采用了T-SPOT.TB的实验方法,8项研究采用了QFT的实验方法,QuantiFERON TB GOLD(QFT-G)和QuantiFERON TB GOLD in-tube(QFT-GIT)都是QFT的改良方法。文献筛选流程及结果见图2。
2.2 纳入研究的基本特征和偏移风险评价
本研究共纳入27项研究,涉及胸腔积液患者2 107例,其中试验组1 222例,对照组885例。所纳入研究的基本特征见表1。本研究采用QUADAS-2工具进行偏移风险评价,QUADAS-2工具共由4个部分组成:(1)病例的选择;(2)待评价试验;(3)金标准;(4)病例流程和进展情况。因为本研究以严格的金标准试验作为筛选文献的基本条件,所以在“金标准”部分基本不存在偏移风险,但在“待评价试验”部分有14篇文献存在较高的偏移风险。偏移风险评价见图3。
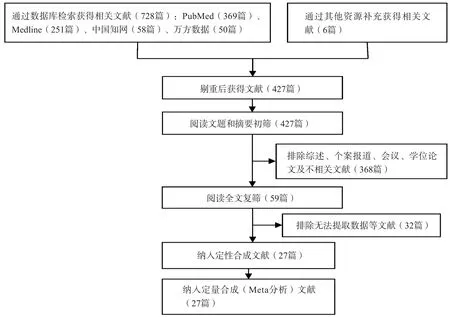
图2 文献筛选流程及结果
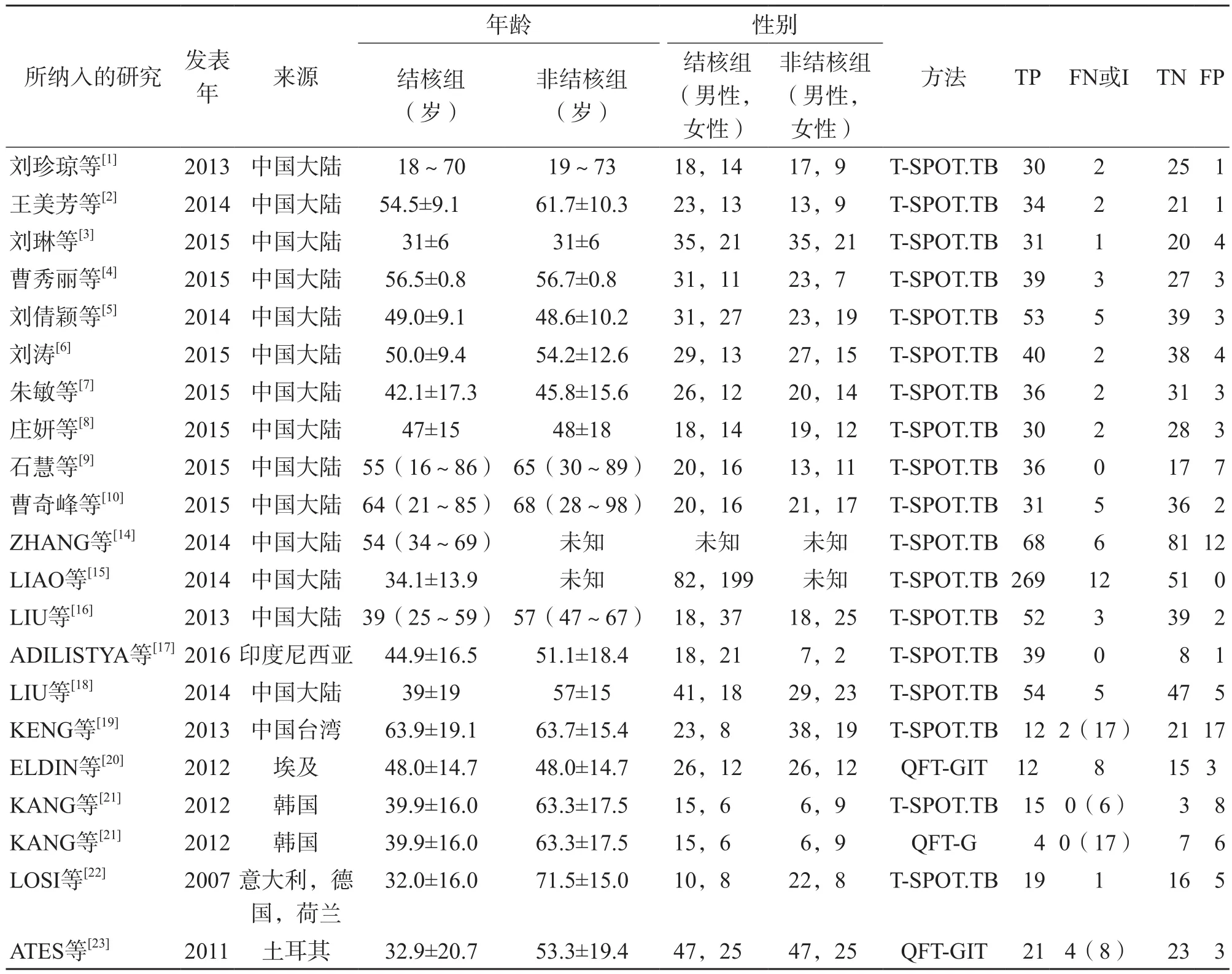
表1 纳入研究的基本特征
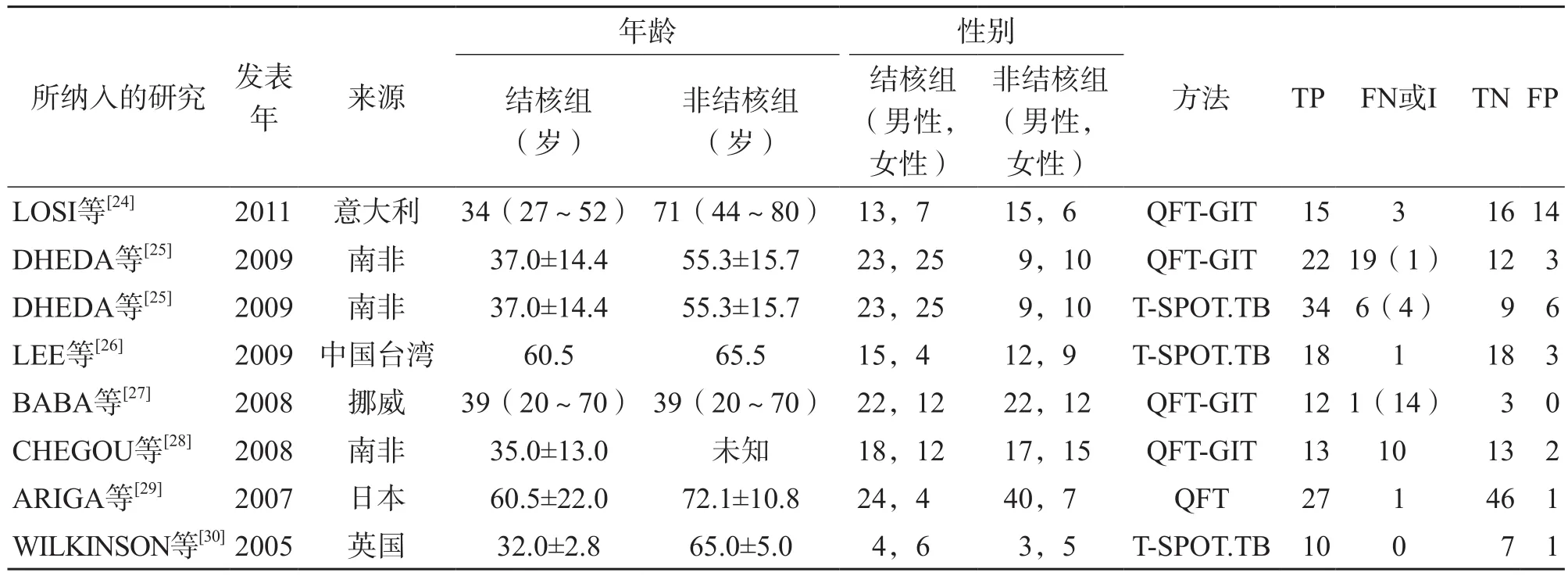
续表1

图3 纳入研究的偏移风险评价
2.3 Meta分析结果
SROC曲线不呈“肩臂状”改变,提示定性评价没有阈值效应。Spearman相关系数为-0.337(P=0.073),提示定量评价也没有阈值效应。采用随机效应模型进行Meta分析,结果显示:合并敏感性为0.85[95%可信区间(confidence interval,CI)0.83~0.87],合并特异性为0.85(95%CI 0.83~0.88),合并阳性似然比为5.37(95%CI 3.38~8.53),合并阴性似然比为0.16(95%CI 0.09~0.26),合并诊断优势比为41.51(95%CI 17.48~97.61),AUC为0.930 0。见图4~图6。
采用“实验方法”(分为T-SPOT.TB、QFTGIT、QFT-G和QFT 4个组)、“发表时间”(分为2014—2017年、2011—2013年和2010年以前发表3个组)、“来源”(分为中国大陆和其他来源2个组)和“是否为前瞻性研究”(分为是、否和不明3个组)4个变量来做Meta分析,根据P值从大到小按照逆方差权重法依次排除“是否为前瞻性研究”(P=0.653 8)、“实验方法”(P=0.284 3)和“发表时间”(P=0.056 1)3个变量,最后得出“来源”的P值为0.000,提示研究间异质性与所纳入文献的“来源”有关,来自中国大陆的研究诊断精确性是其他来源研究的20.85倍,合并诊断优势比为20.85(95%CI 6.19~70.30,P=0.000)。
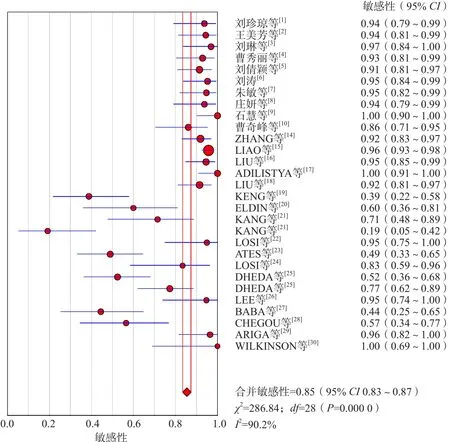
图4 IGRA诊断结核性胸腔积液合并敏感性的Meta分析
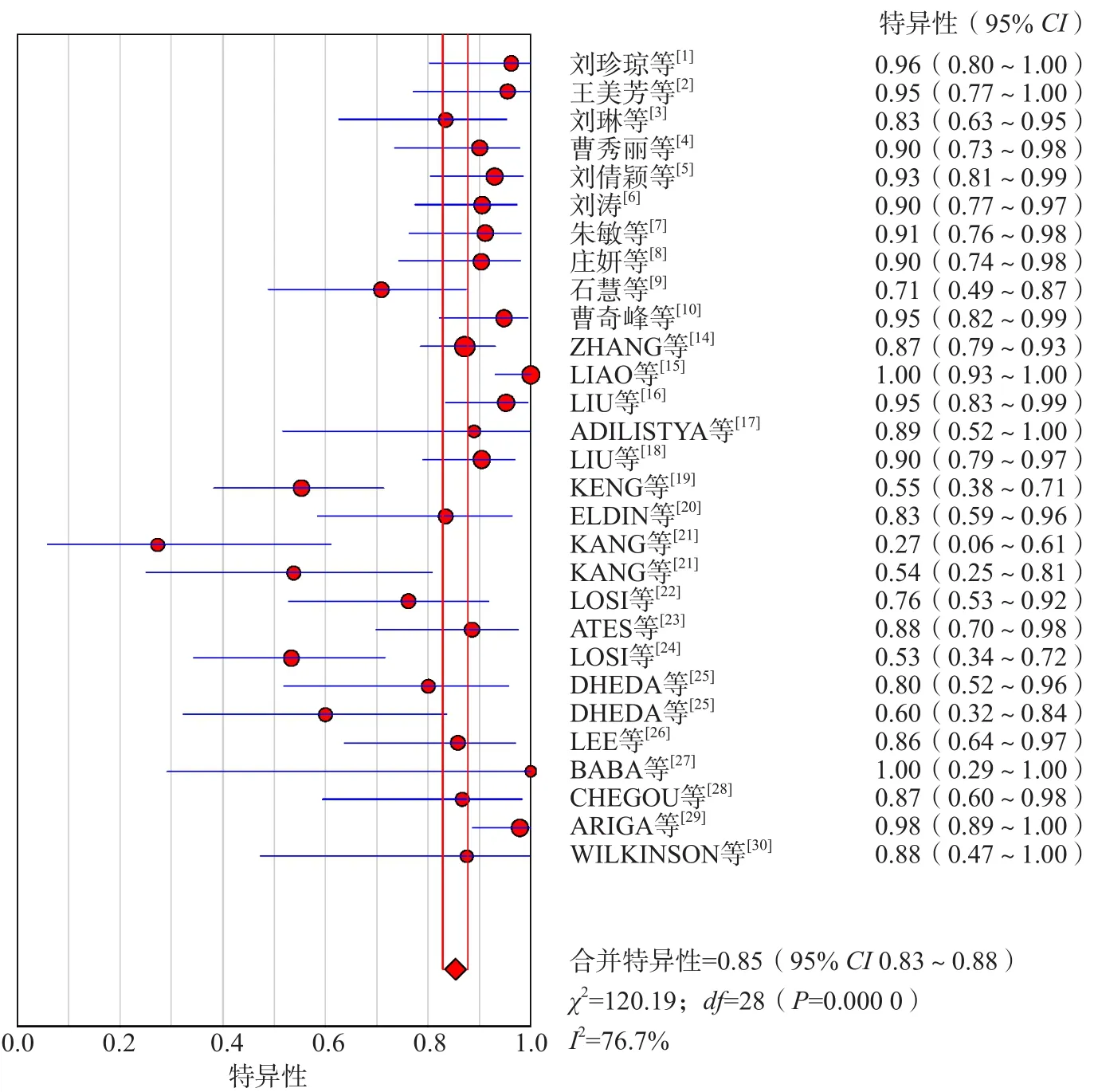
图5 IGRA诊断结核性胸腔积液合并特异性的Meta分析
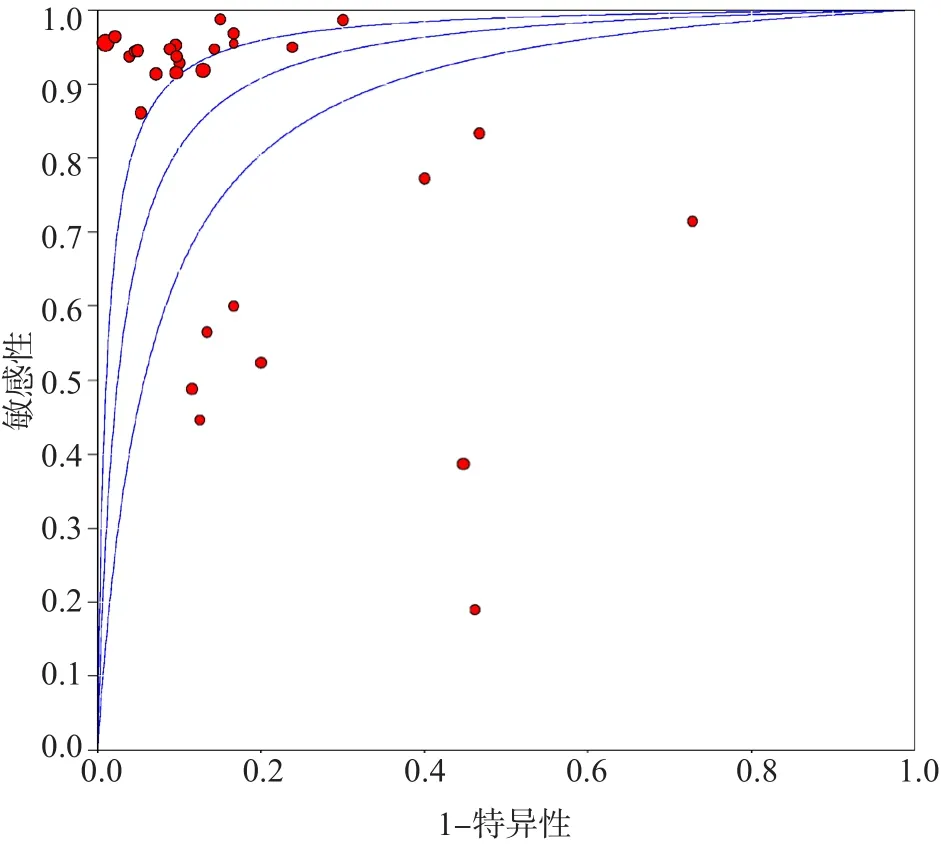
图6 IGRA诊断结核性胸腔积液ROC曲线
对于“来源”为中国大陆的研究进行亚组分析:合并敏感性为0.94,合并特异性为0.91,合并诊断优势比为147.38, AUC为0.973 8。对于“来源”为其他来源的研究进行亚组分析:合并敏感性为0.67,合并特异性为0.75,合并诊断优势比为8.98,AUC为0.824 8。对于“实验方法”为T-SPOT.TB的文献进行亚组分析:合并敏感性为0.92,合并特异性为0.86,合并诊断优势比为81.80,AUC为0.959 8,表明实验方法为T-SPOT.TB的研究敏感性、特异性均较高,异质性也明显降低。对于“实验方法”为QFT(包括QFT-GIT、QFT-G和QFT)的文献进行亚组分析:合并敏感性为0.57,合并特异性为0.81,合并诊断优势比为6.73,AUC为0.833 4,表明敏感性和特异性均较低,异质性较高,诊断优势比较低。
2.4 发表偏移
Begg's检验发表偏移结果Z=0.02,P>|Z|=0.985,提示差异无统计学意义;Egger's检验偏移t=0.29,P=0.771,并且95%CI为(-0.787 0~1.050 6),提示发表偏移存在的可能性不大。见图7。
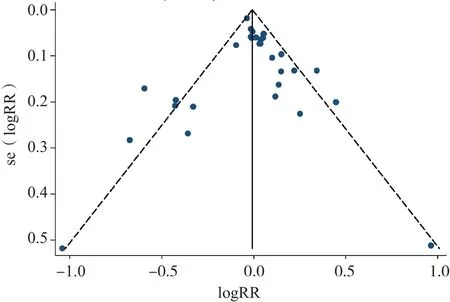
图7 IGRA诊断结核性胸腔积液发表偏移漏斗图
3 讨论
临床上鉴别诊断结核性胸腔积液常常比较困难。IGRA是基于以结核分枝杆菌特异性抗原在体外刺激T细胞产生γ-干扰素的原理为基础的体外免疫诊断技术,检测结果可判断受检宿主的T细胞对结核分枝杆菌特异性抗原是否有记忆,因此其临床意义为检测机体是否感染过结核分枝杆菌[31]。当结核分枝杆菌进入胸膜时,胸膜将发生一系列的迟发型超敏免疫反应,在感染的过程中,会有大量T细胞聚集在炎症周围以对抗感染。由于结核抗原T细胞具有向病变部位集中的特点,故本研究将来自病变部位的胸腔积液作为检测对象,探讨IGRA对结核性胸腔积液的诊断价值。
虽然此前曾有AGGARWAL等[11]和ZHOU等[12]进行了Meta分析,结果显示胸腔积液IGRA对结核性胸腔积液具有较低的诊断效能。而本研究Meta分析的结果显示合并敏感性(0.85)、合并特异性(0.85)均较高,合并诊断优势比为41.31,SROC曲线的AUC为0.930 0,提示胸腔积液IGRA在诊断结核性胸腔积液中具有较高的诊断价值。分析原因,Aggarwal和Zhou等的研究并没有纳入中文文献,而我国是结核病的高发国家,本研究纳入了10篇中文文献,同时还纳入了最新的研究,从而提高了统计分析的全面性。本Meta分析漏斗图、Begg's检验和Egger's检验的结果提示所纳入的研究无明显发表偏移。
Meta分析结果显示,“来源”可能是异质性来源的重要原因。通过异质性分析及亚组分析发现,“来源”为中国大陆的文献和“实验方法”为T-SPOT.TB的文献敏感性(0.94、0.92),特异性(0.91、0.86),诊断优势比(147.38、81.80),AUC(0.973 8、0.959 8)均较高,诊断效能较优。通过分析发现,本研究所纳入的研究,凡是“来源”为中国大陆的实验方法都采用T-SPOT.TB,而中国大陆以外的文献2种试验方法均有采用,因此实验方法的不同可能是造成异质性的原因。LI等[32]在2015年针对酶联免疫斑点试验的Meta分析得出的敏感性(0.95)、特异性(0.90)、诊断优势比(88.26)、AUC(0.959 9)与本研究针对T-SPOT.TB亚组分析所得的结果较为一致。亚组分析的结果表明胸腔积液IGRA对中国人群结核性胸腔积液的诊断价值较高。我国是结核病高发国家,中国公民一出生均要接受卡介苗强制接种,而IGRA检测方法所用结核分枝杆菌特异性抗原为早期分泌靶抗原6(early secretory antigenic target-6,ESAT-6)及培养滤液蛋白10(culture filtrate protein-10,CFP-10),其结果不受卡介苗接种的影响,致使IGRA更加适应中国人群。
T-SPOT.TB检测的是经ESAT-6、CEP-10刺激后释放γ-干扰素的T细胞,而QFT检测的是经ESAT-6、CEP-10刺激后T细胞释放到上清液中的γ-干扰素。本研究亚组分析的结果表明,在诊断结核性胸腔积液时,T-SPOT.TB可能比QFT-GIT具有更好的效能。然而对于所纳入的文献进行深入分析,发现实验方法采用T-SPOT.TB的研究,有9项采用的是英国Oxford Immunotec Ltd.提供的试剂盒,有2项采用的是上海复星公司提供的试剂盒,其他6项没有明确试剂盒来源。因为不同厂家、不同年代、不同批号试剂盒采用的抗原组合以及抗原剂量都有很大差异,这些均可能造成研究结果出现差异。另外所纳入的采用QFT实验方法的文献都是2012年以前发表的,其中有6篇采用QFT-GIT,1篇采用QFT-G,1篇采用QFT。实验技术的进步、实验方法的改良以及质控的更加严格也可能影响对实验方法的评价。
结核是一种慢性病,而且在我国有很多潜伏性结核病例,对于既往感染过结核而如今却以其他类型的胸腔积液发病的病例筛选难度很大,这可能是造成不同文献所纳入对照组病例异质性高的原因。本研究所纳入的文献研究组均经严格的金标准筛选,而对照组病例的确诊却少有精确详尽的描述。另外本研究所纳入的文献仅有14篇是前瞻性研究,有2篇是回顾性研究,有11篇没有注明研究类型,尽管在Meta分析中显示“是否前瞻性研究”不是造成异质性的主要原因,而诊断性试验中较优的应该是前瞻性研究,这些都是本研究的不足之处。
综上所述,胸腔积液IGRA在诊断结核性胸腔积液中具有较高的价值,尤其在我国人群中其诊断效能较高,而T-SPOT.TB可能有更好的诊断优势。期待以后有更多高质量的研究,荟萃分析出更有价值的诊断结果。
[1] 刘珍琼,段永和,张齐龙,等. T-SPOT. TB技术检测胸腔积液在结核性胸膜炎诊断中的应用[J]. 实验与检验医学,2013,31(4):306-308.
[2] 王美芳,顾翔月. T-SPOT. TB实验在结核性胸腔积液中的诊断价值[J]. 中华全科医学,2014,12(8):1356-1357.
[3] 刘琳,胡克. 胸腔积液结核感染T细胞斑点试验在结核性胸腔积液中的诊断价值[J]. 医学综述,2015,21(2):324-326.
[4] 曹秀丽,王兰. 胸腔积液结核感染T细胞斑点实验检测对结核性胸膜炎的辅助诊断价值[J]. 中国煤炭工业医学杂志,2015,19(7):1094-1097.
[5] 刘倩颖,王心静,林明贵. 结核感染T细胞斑点试验在结核性胸腔积液诊断中的意义[J]. 解放军医药杂志,2014,26(8):89-91.
[6] 刘涛. T-SPOT.TB技术在结核性胸膜炎诊断中的意义[J]. 国际检验医学杂志,2015,36(9):1283-1284.
[7] 朱敏,李英,马希涛. 结核杆菌感染T细胞斑点试验和腺苷脱氨酶检测对结核性胸膜炎诊断价值探讨[J]. 河南医学高等专科学校学报,2015,28(5):575-578.
[8] 庄妍,赖雁平. 结核 T 细胞斑点试验在结核性胸膜炎中的价值[J]. 天津医科大学学报,2015,21(4):335-338.
[9] 石慧,崔丽英. 结核感染T细胞斑点试验诊断结核性胸膜炎的应用价值[J]. 中华肺部疾病杂志(电子版),2015,8(2):51-54.
[10] 曹奇峰,杨卫琴,瞿美君. 外周血联合胸腔积液应用T SPOT-TB 检测对于诊断结核性胸膜炎的临床研究[J]. 现代实用医学,2015,27(12):1588-1590.
[11] AGGARWAL A N,AGARWAL R,GUPTA D,et al. Interferon gamma release assays for diagnosis of pleural tuberculosis:a systematic review and metaanalysis[J]. J Clin Microbiol,2015,53(8):2451-2459.
[12] ZHOU Q,CHEN Y Q,QIN S M,et al.Diagnostic accuracy of T-cell interferon-γ release assays in tuberculous pleurisy:a meta-analysis[J].Respirology,2011,16(3):473-480.
[13] 邬兰,张永,曾献涛. QUADAS-2在诊断准确性研究的质量评价工具中的应用[J]. 湖北医药学院学报,2013,32(3):201-208.
[14] ZHANG L,ZHANG Y,SHI X,et al. Utility of T-cell interferon-γ release assays for diagnosing tuberculous serositis:a prospective study in Beijing,China[J]. PLoS One,2014,9(1):e85030.
[15] LIAO M,YANG Q,ZHANG J,et al. Gamma interferon immunospot assay of pleural effusion mononuclear cells for diagnosis of tuberculous pleurisy[J]. Clin Vaccine Immunol,2014,21(3):347-353.
[16] LIU F,GAO M,ZHANG X,et al. Interferongamma release assay performance of pleural fluid and peripheral blood in pleural tuberculosis[J]. PLoS One,2013,8(12):e83857.
[17] ADILISTYA T,ASTRAWINATA D A,NASIR U Z. Use of pleural fluid interferon-gamma enzymelinked immunospot assay in the diagnosis of pleural tuberculosis[J]. Acta Med Indones,2016,48(1):41-47.
[18] 刘菲,张霞,杜凤娇,等. γ-干扰素释放试验检测胸腔积液对诊断结核性胸膜炎的初步探讨[J]. 中华结核和呼吸杂志,2014,37(5):323-327.
[19] KENG L T,SHU C C,CHEN J Y,et al.Evaluating pleural ADA,ADA2,IFN-γ and IGRA for diagnosing tuberculous pleurisy[J]. J Infect,2013,67(4):294-302.
[20] ELDIN E N,OMAR A,KHAIRY M,et al.Diagnostic value of ex vivo pleural fluid interferongamma versus adapted whole-blood quantiferon-TB gold in tube assays in tuberculous pleural effusion[J].Ann Thorac Med,2012,7(4):220-225.
[21] KANG J Y,RHEE C K,KANG N H,et al.Clinical utility of two interferon-gamma release assays on pleural fluid for the diagnosis of tuberculous pleurisy[J]. Tuberc Respir Dis(Seoul),2012,73(3):143-150.
[22] LOSI M,BOSSINK A,CODECASA L,et al. Use of a T-cell interferon-gamma release assay for the diagnosis of tuberculous pleurisy[J]. Eur Respir J,2007,30(6):1173-1179.
[23] ATES G,YILDIZ T,ORTAKOYLU M G,et al.Adapted T cell interferon-gamma release assay for the diagnosis of pleural tuberculosis[J]. Respiration,2011,82(4):351-357.
[24] LOSI M,BOCCHINO M,MATARESE A,et al. Role of the quantiferon-TB test in ruling out pleural tuberculosis:a multi-centre study[J]. Int J Immunopathol Pharmacol,2011,24(1):159-165.
[25] DHEDA K,VAN ZYL-SMIT R N,SECHI L A,et al. Utility of quantitative T-cell responses versus unstimulated interferon-gamma for the diagnosis of pleural tuberculosis[J]. Eur Respir J,2009,34(5):1118-1126.
[26] LEE L N,CHOU C H,WANG J Y,et al. Enzymelinked immunospot assay for interferon-gamma in the diagnosis of tuberculous pleurisy [J]. Clin Microbiol Infect,2009,5(2):173-179.
[27] BABA K,SØRNES S,HOOSEN A A,et al. Evaluation of immune responses in HIV infected patients with pleural tuberculosis by the QuantiFERON TB-Gold interferon-gamma assay[J].BMC Infect Dis,2008,8:35.
[28] CHEGOU N N,WALZL G,BOLLIGER C T,et al. Evaluation of adapted whole-blood interferongamma release assays for the diagnosis of pleural tuberculosis[J]. Respiration,2008,76(2):131-138.
[29] ARIGA H,KAWABE Y,NAGAI H,et al.Diagnosis of active tuberculous serositis by antigenspecific interferon-gamma response of cavity fluid cells[J]. Clin Infect Dis,2007,45(12):1559-1567.
[30] WILKINSON K A,WILKINSON R J,PATHAN A,et al. Ex vivo characterization of early secretory antigenic target 6-specific T cells at sites of active disease in pleural tuberculosis[J]. Clin Infect Dis,2005,40(1):184-187.
[31] 高孟秋. γ-干扰素释放试验检测结果的临床意义解读[J]. 中华结合和呼吸杂志,2014,37(10):742-743.
[32] LI Z Z,QIN W Z,LI L,et al. Accuracy of enzymelinked immunospot assay for diagnosis of pleural tuberculosis:a meta-analysis[J]. Genet Mol Res,2015,14(3):11672-11680.
