降钙素原、C-反应蛋白在鉴别血流感染菌属中的应用价值①
2018-03-07于宏伟马伟立张金艳
于宏伟 程 阔 马伟立 何 京 李 燕 张金艳
(河北医科大学第四医院检验科,石家庄 050000 )
血流感染是临床危重患者的主要致死原因之一[1]。流行病学数据表明,菌血症患者死亡率为25%~30%,感染性休克患者死亡率高达40%~50%[2]。血培养是诊断血流感染的金标准,但其局限性在于检测时间长,且可能存在假阳性及假阴性结果[3]。因此及时有效发现血流感染,并对病原菌进行初步鉴别至关重要。降钙素原(Procalcitonin,PCT)、C-反应蛋白(C reactive protein,CRP)作为炎症判断指标,对于感染的早期发现与诊断有较高的应用价值,有利于抗感染治疗策略的合理实施。本研究在此基础上,探讨PCT、CRP水平在鉴别血流感染不同菌属中的应用价值,对本院2015年1月~2017年1月血培养阳性并进行PCT及CRP检测的临资料进行分析,现报道如下。
1 材料与方法
1.1临床资料 对2015年1月~2017年1月血培养阳性及细菌鉴定结果进行统计,并筛选出进行了PCT、CRP检测的216例合格临床资料进行回顾性分析。其纳入标准为:至少一次血培养阳性,阳性血培养与PCT检测同时送检,对于一周中同一患者连续2次及以上送检,只记录、统计第一次检测结果。排除标准为:年龄≤18岁;临床诊断为恶性肿瘤患者,如甲状腺癌、肺癌等[4]。
1.2实验方法 血清PCT检测采用Cobas e 602免疫分析仪(电化学发光法)。CRP检测采用贝克曼库尔特IMMAGE800特定蛋白分析仪(散射比浊法)。血培养及细菌鉴定采用法国生物梅里埃公司BACT/ACERT3D全自动血培养仪、VITEK-2 Compact全自动药敏分析仪。
1.3统计学处理 采用WHONET 5.6软件统计医院血培养阳性的科室分布及细菌构成。采用SPSS 21.0 软件分析PCT、CRP的检测结果,数据为非正态分布,采用中位数(四分位数间距)进行统计描述。两组间比较采用Mann-WhitneyU非参数秩和检验,P<0.05为差异具有统计学意义。建立ROC曲线,以确定血流感染不同菌属的最佳临界值,即约登指数(敏感度+特异度-1)达最大时对应的值,并观察临界值的敏感度、特异度。
2 结果
2.1不同细菌分组中PCT、CRP水平比较 所收集的216例数据中,革兰阳性菌93株,PCT中位数、四分位数间距分别为1.09、5.56 ng/ml,CRP中位数、四分位数间距分别为94.50、99.55 mg/L;革兰阴性菌123株,PCT中位数、四分位数间距分别为3.62、11.20 ng/ml,CRP中位数、四分位数间距分别为118.00、119.10 mg/L,见表1。PCT水平在革兰阳性菌与革兰阴性菌,凝固酶阳性葡萄球菌与凝固酶阴性葡萄球菌、肠杆菌科与非发酵菌间差异具有统计学意义,U值分别为4420.00、79.00、681.50,P<0.01,在葡萄球菌属与肠球菌属间差异无统计学意义。CRP水平在以上各分组中差异均无统计学意义。见表2。
表1不同菌属PCT、CRP检测结果
Tab.1ResultsofPCTandCRPofdifferentstrains

SpeciesNumber(strains)PCT(ng/ml)CRP(mg/L)Gram⁃positivebacteria931 09(5 56)94 50(99 55)Coagulasepositivestaphylococci185 49(52 11)149 00(183 1)Coagulasenegativestaphylococci300 46(1 28)74 45(69)Enterococcus261 09(4 65)77 90(90 00)Othergram⁃positivebacteria195 54(14 94)116 00(209 00)Gram⁃negativebacteria1233 62(11 20)118 00(119 10)Nonfermentativebacteria221 10(3 00)85 50(98 00)Enterobacteriaceae1014 46(13 00)123 00(122 00)
表2不同菌属PCT、CRP水平比较
Tab.2ComparisonlevelofPCTandCRPindifferentstrains

GroupsPCTUvaluesPvaluesCRPUvaluesPvaluesGram⁃positivevsgram⁃negativebacteria4420 000 0043470 000 067Coagulasepositivevscoagulasenegativestaphylococci79 00<0 001118 000 190Enterobacteriaceaevsnonfermentativebacteria681 500 005612 500 070Staphylococcusvsenterococcus559 000 549445 000 926
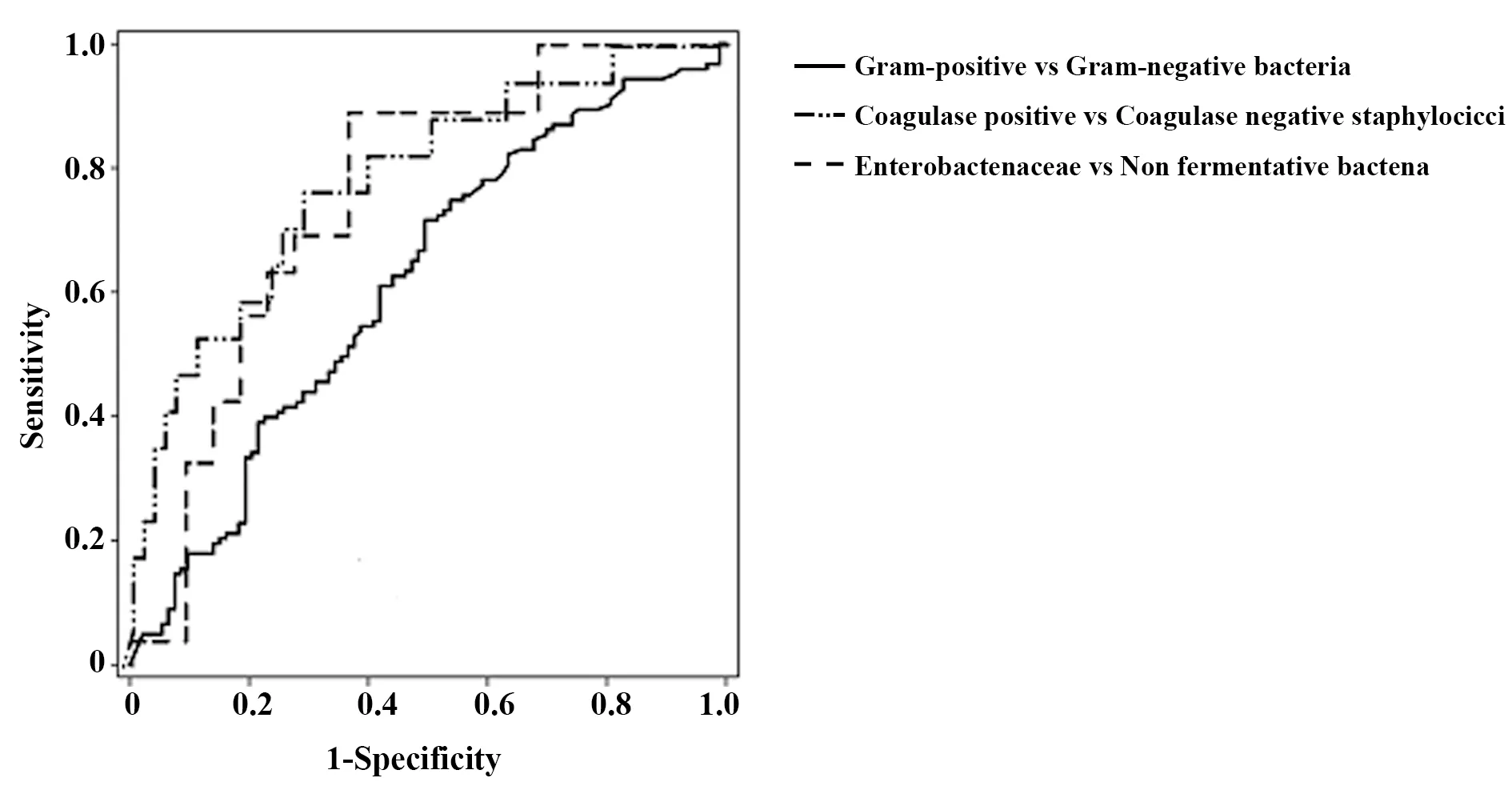
图1 ROC曲线分析PCT在血流感染中的最佳临界值Fig.1 ROC curve analysis of optimal cut-off value of PCT in bloodstream infection
2.2PCT在血流感染不同菌属鉴别中最佳临界值 PCT在区别革兰阳性菌和革兰阴性菌的ROC曲线下面积为0.61,95%可信区间为0.536~0.683;最佳临界值为1.105 ng/ml时,敏感度和特异度分别为71.5%、50.0%;PCT区别凝固酶阳性葡萄球菌与凝固酶阴性葡萄球的ROC曲线下面积为0.845,95%可信区间为0.724~0.966,最佳临界值为0.870 ng/ml,敏感度和特异度分别为70.6%、86.7%;PCT区别肠杆菌科与非发酵菌的ROC曲线下面积为0.693,95%可信区间为0.566~0.821,最佳临界值为3.31 ng/ml,敏感度和特异度分别为59.4%、77.3%,见图1。
3 讨论
本研究中,血培养阳性标本多集中在肾脏内科、ICU。肾脏内科中以肾病患者为主,采用血液透析、安插血管内装置、尿路插管及服用免疫抑制剂等治疗手段,易引发血流感染;ICU以高龄危重症患者为主,患者基础疾病严重、免疫力低,长期住院导致血流感染的风险较高。在本院所有血流感染中,以大肠埃希菌、肺炎克雷伯菌最为常见,与钟敏等[5]研究结果一致。
目前,PCT及CRP是较为常用的感染监测指标。PCT是一种无活性降钙素前肽物质,在健康人群中表达水平较低。细菌感染时血清PCT可在4 h之内升高,6 h达到高峰。郑玉芬等[6]研究表明,PCT在血流感染预测中有较高的临床应用价值。CRP同样广泛应用于菌血症的诊断,有研究表明其在感染诊断中与PCT相比缺乏特异性,但因其检测费用较低,检测方法较多,仍有一定临床应用价值[2,4]。本研究在现有基础上,进一步探讨PCT及CRP水平在鉴别血流感染不同菌属中的临床应用价值,旨在早期快速对血流感染菌属进行预测,弥补血培养检测周期较长的局限性,为早期合理用药提供一定依据,提高临床治疗效率,减少患者的死亡风险。
本研究表明革兰阳性菌与革兰阴性菌中PCT水平差异具有统计学意义(P<0.05),与Yan等[7]报道一致,其原因可能为PCT水平与细菌细胞壁及炎症因子相关[2,8]。革兰阳性菌与革兰阴性菌细胞壁的主要成分为肽聚糖和脂多糖,二者作为病原相关分子模式可与Toll样(TLR)、C型凝集素等受体结合,从而启动信号通路及诱导前炎症因子的释放。肽聚糖、脂多糖分别是TLR2、TLR4识别的配体。脂多糖与TLR4结合激活MyD88信号通路,诱导TNF-α、IL-6细胞因子的产生。Oberhoffer等[9]发现在人外周血单核细胞中,脂多糖和菌血症相关细胞因子可以增加PCT的表达。
因此PCT的表达水平在一定程度上可反映血流感染菌属。根据ROC曲线分析,区别革兰阳性菌和革兰阴性菌的最佳临界值为1.105 ng/ml,其敏感度和特异度分别为71.5%、50.0%,与Leli等[10]在2015年的研究结果有差异。其原因可能与各医院患者的构成、菌属分布等因素相关。在革兰阳性菌中凝固酶阳性葡萄球菌与凝固酶阴性葡萄球菌间PCT水平差异具有统计学意义,P<0.05。凝固酶阴性葡萄球菌与因操作不当消毒不完全导致的污染高度相关。PCT水平用于区别凝固酶阴、阳性葡萄球菌的最佳临界值为0.870 ng/ml,可用于临床中对葡萄球菌的鉴别。统计分析发现葡萄球菌属与肠球菌属PCT水平无差异。革兰阴性菌中肠杆菌科与非发酵菌间差别具有统计学意义(P<0.05),其原因可能为非发酵菌刺激机体产生能诱导PCT生成的细胞因子较少。有研究表明,浓度为104细胞/L的大肠埃希菌和肺炎克雷伯菌诱导人母系静脉内皮细胞产生的IL-6的作用高于浓度为106细胞/L的铜绿假单胞菌[11,12]。铜绿假单胞菌产生较低水平的细胞因子,从而诱导产生的PCT水平较低。此外,IL-6在细菌感染中也存在显著升高[13],但由于其半衰期较短与PCT相比稍有不足[14],IL-6在鉴别血流感染细菌种类中的临床应用价值仍有待深入研究。ROC曲线中用于区别肠杆菌与非发酵菌的最佳临界值为3.31 ng/ml,与Christian等的研究结果一致。根据该临界值有助于在临床治疗中合理使用抗菌药物,避免因药物选择错误所致的治疗失败。研究发现不同菌属血流感染,CRP水平差异无统计学意义。CRP仅可作为一种提示感染存在的炎症指标。
本研究的局限性在于:①因患者的临床症状及个体差异,PCT表达水平变化也可存在差异;②据相关报道[15],在严重创伤、肝肾疾病、持久的循环休克和多器官紊乱及寄生虫感染时,都可刺激PCT的产生,导致其非特异性升高。③临床中部分患者可能存在血培养阳性,但PCT不升高,其原因可能与头孢他啶的应用及采血时间相关[16]。④本研究所收集数据仅为本院两年的临床资料,能否广泛用于临床,应进一步扩大数据。
综上所述,PCT在辅助诊断感染的基础上,不仅可区别革兰阳性菌和革兰阴性菌,而且可以在一定程度上鉴别血流感染菌属,为早期临床用药提供参考依据,有利于抗菌药物的合理应用,但药物的选择仍应以血培养鉴定结果为主。及时行PCT及血培养联合检测,可提高临床治疗效率,避免抗感染治疗失败,降低患者死亡风险。
[1] Jeong S,Park Y,Cho Y,etal.Diagnostic utilities of procalcitonin and C-reactive protein for the prediction of bacteremia deter mined by blood culture[J].Clin Chim Acta,2012,413(21-22):1731-1736.
[2] Li S,Rong H,Guo Q,etal.Serum procalcitonin levels distinguish Gram-negative bacterial sepsis from Gram-positive bacterial and fungal sepsis[J].J Res Med Sci,2016,21(1):39.
[3] Maubon D,Hamidfar-Roy R,Courby S,etal.Therapeutic impact and diagnostic performance of multiplex PCR in patients with malignancies and suspected sepsis[J].J Infect,2010,613:335-342.
[4] Debiane L,Hachem RY,Wohoush Al,etal.The utility of proadrenomedullin and procalcitonin in comparison to c-reactive protein as predictors of sepsis and bloodstream infections in critically ill patients with cancer[J].Crit Care Med,2014,42(12):2500-2507.
[5] 钟 敏,张 凯,黄湘宁,等.社区获得性血流感染产ESBLs大肠埃希菌与肺炎克雷伯菌流行情况及危险因素初步分析[J].中华微生物学和免疫学杂志,2016,36(2):117-123.
Zhong M,Zhang K,Huang XN,etal.Epidemiology and risk factors for community-acquired blood stream infection caused by extended spectrum β-lactamases-producing Escherichia coli and Klebsiella pneumonia strains[J].Chin J Microbiol Immunol,2016,36(2):117-123.
[6] 郑玉芬,崔伟娇,颜海希,等.降钙素原预测血培养阳性的临床诊断价值研究[J].中华医院感染学杂志,2016,26(16):3622-3624.
Zheng YF,Cui WJ,Yan HX,etal.Clinical significance of serum procalcitonin in predicting blood culture positive[J].Chin J Nosocomiol,2016,26(16):3622-3624.
[7] Yan ST,Sun LC,Jia HB,etal.Procalcitonin levels in bloodstream infections caused by different sources and species of bacteria[J].Am J Emer Med,2017,35(4):579-583.
[8] Kumar S,Ingle H,Prasad DV,etal.Recognition of bacterial infection by innate immune sensors[J].Crit Rev Microbiol,2013,39(3):229.
[9] Oberhoffer M,Stonans I,Russwurm S,etal.Procalcitonin expression in human peripheral blood mononuclear cells and its modulation by lipopolysaccharides and sepsis-related cytokines in vitro.[J].J Lab Clin Med,1999,134(1):49-55.
[10] Leli C,Ferranti M,Moretti A,etal.Procalcitonin levels in Gram-positive,Gram-negative,and fungal bloodstream infection[J].Dis Markers,2015,2015:701480.
[11] Elson G,Dunn-Siegrist I,Daubeuf B,etal.Contribution of toll-like receptors to the innate immune response to Gram-negative and Gram-positive bacteria[J].Blood,2007,109:1574-1583.
[12] Müller B,White JC,Nylén ES,etal.Ubiquitous expression of the calcitonin-Ⅰgene in muliple tissues in response to sepsis[J].J Clin Endocrinol Metab,2001,86:396-404.
[13] 吴 丹,周树生,胡仕静,等.金黄色葡萄球菌经静脉和腹腔诱导小鼠血流感染的炎症反应和病理变化[J].中国免疫学杂志,2016,32(4):556-562.
Wu D,Zhou SS,Hu SJ,etal.Mechanism of inflammatory responses and histopathological changes in Staphylococcus aureus induced bloodstream infections in mice[J].Chin J Immunol,2016,32(4):556-562.
[14] 王 优,庞国象,苏赞彩,等.新生儿严重细菌感染血浆降钙素原与CRP和IL-6临床价值对比研究[J].中国免疫学杂志,2005,21(10):790-792.
Wang Y,Pang GX,Su ZC,etal.The clinical value of comparative study between procalcitonin,C-reactive protein and IL-6 in neonatal sepsis[J].Chin J Immunol,2005,21(10):790-792.
[15] Ghorbani G.Procalcitonin role in differental diagnosis of infection stages and non-infection inflammation[J].Pak J Biol Sci,2009,12(4):393-396.
[16] 张智洁,刘 勇,孙继梅,等.头孢他啶影响大鼠降钙素原产生机制初步研究[J].中华医院感染学杂志,2007,17(2):129-133.
Zhang ZJ,Liu Y,Sun JM,etal.Ceftazidime influencing procalcitonin production in rats: a preliminary study of its mechanism[J].Chin J Nosocomiol,2007,17(2):129-133.
