IL-38通过调控PI3K/Akt/GSK3β/NFATc1信号通路抑制骨质疏松的机制研究
2018-03-07刘珍星张山锋杨钟华
刘珍星 张山锋 杨钟华
(华中科技大学同济医学院附属武汉普爱医院骨科,武汉 430034)
骨质疏松是一种常见的骨科疾病,以骨密度降低、骨微结构破坏、伴随骨脆性增加、易发生骨折为主要特征的全身性代谢性骨病[1]。在成年脊椎动物的骨重建过程中,成骨细胞调控的骨形成和破骨细胞调控的骨吸收两个过程持续不断地交替发生,使得骨骼不断更新,从而维持骨代谢稳态,骨质疏松患者的这种稳态被破坏是导致发病的主要原因[2]。研究表明,骨质疏松患者的骨髓基质细胞增殖能力及分化成骨细胞的能力显著降低[1,3]。PI3K/Akt信号通路作为调控成骨细胞和破骨细胞功能的信号通路网络的中心,在正常生理刺激和病理状态下对维持骨组织动态平衡具有重要作用[4]。PI3K/Akt信号通路对于破骨细胞的存活是至关重要的,而PI3K/Akt/GSK3β/NFATc1信号通路在RANKL引起的破骨细胞形成和分化过程中扮演着非常重要的角色[4,5]。IL-38作为新近发现的细胞因子,其生物学功能尚未十分明确[6]。IL-38是IL-36的部分受体拮抗剂,它可作为IL-36的特异性受体[6]。IL-38可抑制Th17细胞产生IL-17和IL-22等炎症介质,也可抑制IL-36γ诱导产生IL-8,发挥抑制炎症反应的作用[6,7]。本次研究探讨骨质疏松患者血清中IL-38的表达水平,同时通过骨质疏松小鼠模型,探讨IL-38抑制骨质疏松的分子机制。
1 材料与方法
1.1材料
1.1.1病例资料 共纳入2014年6月~2016年12月我院收治的138例骨质疏松患者作为研究对象;所有患者中男性33例,女性105例;患者年龄55~72岁,平均(60.8±11.3)岁。另选取120例同期在我院骨科进行骨折手术的无骨质疏松患者作为对照;对照组患者中男性27例,女性93例;患者年龄55~78岁,平均(58.7±18.3)岁。纳入研究组的所有患者均符合骨质疏松的诊断标准,即出现周身疼痛、身高降低、驼背、脆性骨折及呼吸系统受损等临床表现;骨密度检查显示骨量降低骨峰值的2倍标准差(-2.0SD),或下降25%。排除长期营养不良及低钙饮食患者;排除长期卧床患者;排除伴有全身其他器官器质性疾病患者;排除恶性肿瘤患者;排除近期及长期服用影响骨代谢药物患者;排除并发其他代谢性疾病患者。纳入研究的所有患者均签署知情同意书,研究获得医院伦理委员会批准。
1.1.2试剂与仪器 主要试剂包括人IL-38 ELISA试剂盒(美国R&D Systems),ALP检测试剂盒(美国贝克曼公司),p-PI3K、PI3K、p-NFATc1、NFATc1抗体(美国Abcam公司),p-Akt、Akt、p-GSK3β、GSK3β抗体(美国Santa Cruz公司),β-actin抗体(武汉三鹰生物技术有限公司),Annexin V细胞凋亡检测试剂盒(美国BD公司),Lipofectamine®2000转染试剂(Thermo Fisher),CCK-8检测试剂盒、SDS-PAGE试剂(上海碧云天生物技术有限公司)。DMEM培养基、胎牛血清(FBS)(美国Gibco公司),青霉素、链霉素(美国Sigma公司)。野生型与IL-38转基因小鼠购自武汉大学实验动物中心,MC3T3-E1细胞购自美国ATCC公司。主要设备包括CO2培养箱、超净工作台、Tecan酶标仪、流式细胞仪、Bio-Rad垂直电泳仪,Bio-Rad Western blot化学发光成像系统。
1.2方法
1.2.1小鼠模型 野生型与IL-38转基因雌性小鼠各30只,使用前用鼠尾鉴定确认小鼠的基因类型。将各组小鼠随机分为VOX组与Sham组,每组15只。术后8周分离各组小鼠的血清,测定血清钙、磷及ALP水平;取各组小鼠的双侧股骨与脊柱,病理切片分析股骨组织形态结构,骨密度仪检测脊柱骨密度变化。
1.2.2BMSCs的体外培养与检测 采用全骨髓法培养BMSCs[8]。分离细胞,置于37℃,0.5%CO2培养箱中培养,间隔3 d换液一次。当原代细胞集落处细胞密度达到密集状态时,用0.25%的胰酶进行消化传代。取各组第3代BMSCs,计数后调整浓度至4×104个/ml,培养基调整为1%FBS,铺96孔板,每孔200 μl。每组细胞均设复孔,接种后第0~6天用CCK-8法检测各组细胞450 nm波长处的吸光值,每次检测3个复孔。另取各组第3代BMSCs,提取总蛋白,用Western blot检测PI3K、Akt、GSK3β与NFATc1的磷酸化水平变化。
1.2.3质粒构建及细胞转染 构建pCMV-IL-38及pCMV-GFP质粒。采用脂质体Lipofectamine®2000将构建好的IL-38质粒及GFP质粒转染至MC3T3-E1细胞,转染48 h后用流式细胞术检测MC3T3-E1细胞的凋亡,Western blot检测PI3K、Akt、GSK3β与NFATc1的磷酸化水平变化。

2 结果
2.1患者的基本信息及血清IL-38水平 患者的基本信息与血清IL-38水平如表1所示。骨质疏松患者(研究组)与对照组相比,性别、年龄等基本信息差异均无统计学意义(P>0.05)。ELISA结果显示,骨质疏松患者血清IL-38浓度显著低于对照组(P<0.001)。
表1患者基本信息及血清IL-38水平对比
Tab.1ComparisonofbasicdataandserumIL-38levelbetweendifferentgroups
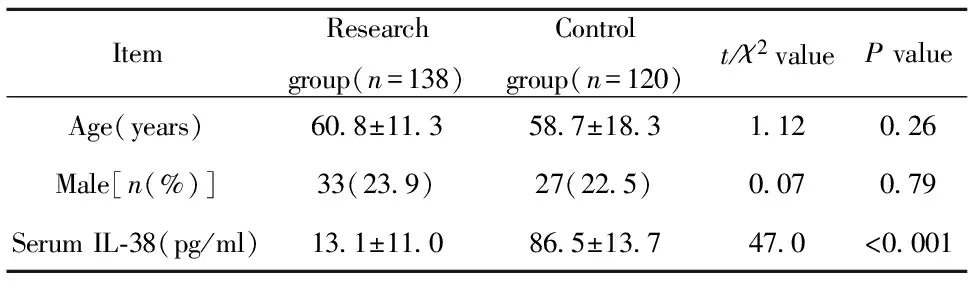
ItemResearchgroup(n=138)Controlgroup(n=120)t/χ2valuePvalueAge(years)60 8±11 358 7±18 31 120 26Male[n(%)]33(23 9)27(22 5)0 070 79SerumIL⁃38(pg/ml)13 1±11 086 5±13 747 0<0 001
2.2骨质疏松小鼠模型的建立 术后8周野生型与IL-38转基因OVX小鼠的血钙和血磷水平均显著高于Sham组(P<0.05),ALP水平显著低于Sham组(P<0.05)。另外,IL-38转基因OVX小鼠的血钙和血磷水平均显著低于野生型OVX小鼠(P<0.05),ALP则显著高于野生型OVX小鼠(P<0.05),见表2。小鼠的股骨病理切片及脊柱骨密度结果如图1所示,野生型与IL-38转基因小鼠OVX组均出现组织形态结构的破坏和骨密度下降,并且IL-38转基因OVX小鼠的骨组织形态结构破坏和骨密度下降情况均较野生型OVX小鼠显著减轻(P<0.05)。
2.3BMSCs的增殖及PI3K、Akt、GSK3β与NFATc1的磷酸化水平检测 细胞增殖检测显示IL-38转基因小鼠OVX 组BMSCs的体外增殖能力显著高于Sham组和野生型小鼠OVX组(P<0.05)。Western blot结果显示,IL-38转基因小鼠OVX组BMSCs细胞的PI3K、Akt与NFATc1磷酸化水平均显著低于野生型OVX组(P<0.05),GSK3β磷酸化水平显著高于野生型OVX组(P<0.05),见图2。
2.4IL-38对MC3T3-E1的影响 如图3所示,转染IL-38后MC3T3-E1细胞的增殖能力显著提高(P<0.05);细胞凋亡显著减少(P<0.05);PI3K、Akt与NFATc1磷酸化水平均显著降低(P<0.05);GSK3β磷酸化水平显著升高(P<0.05)。
表2小鼠模型血清学指标(n=15)
Tab.2Serologicaldetectionofmicemodel(n=15)

GroupBloodcalcium(mol/L)Bloodphosphorus(mol/L)ALP(U/L)WildtypeShamgroup2 09±0 052 81±0 1771 33±10 24WildtypeOVXgroup2 44±0 031)3 47±0 181)36 81±9 131)IL⁃38transgeneShamgroup2 07±0 032 88±0 1677 48±13 92IL⁃38transgeneOVXgroup2 26±0 021)2)3 01±0 171)2)47 11±7 271)2)
Note:1)Compared with Sham group,P<0.05;2)Compared with OVX group,P<0.05.
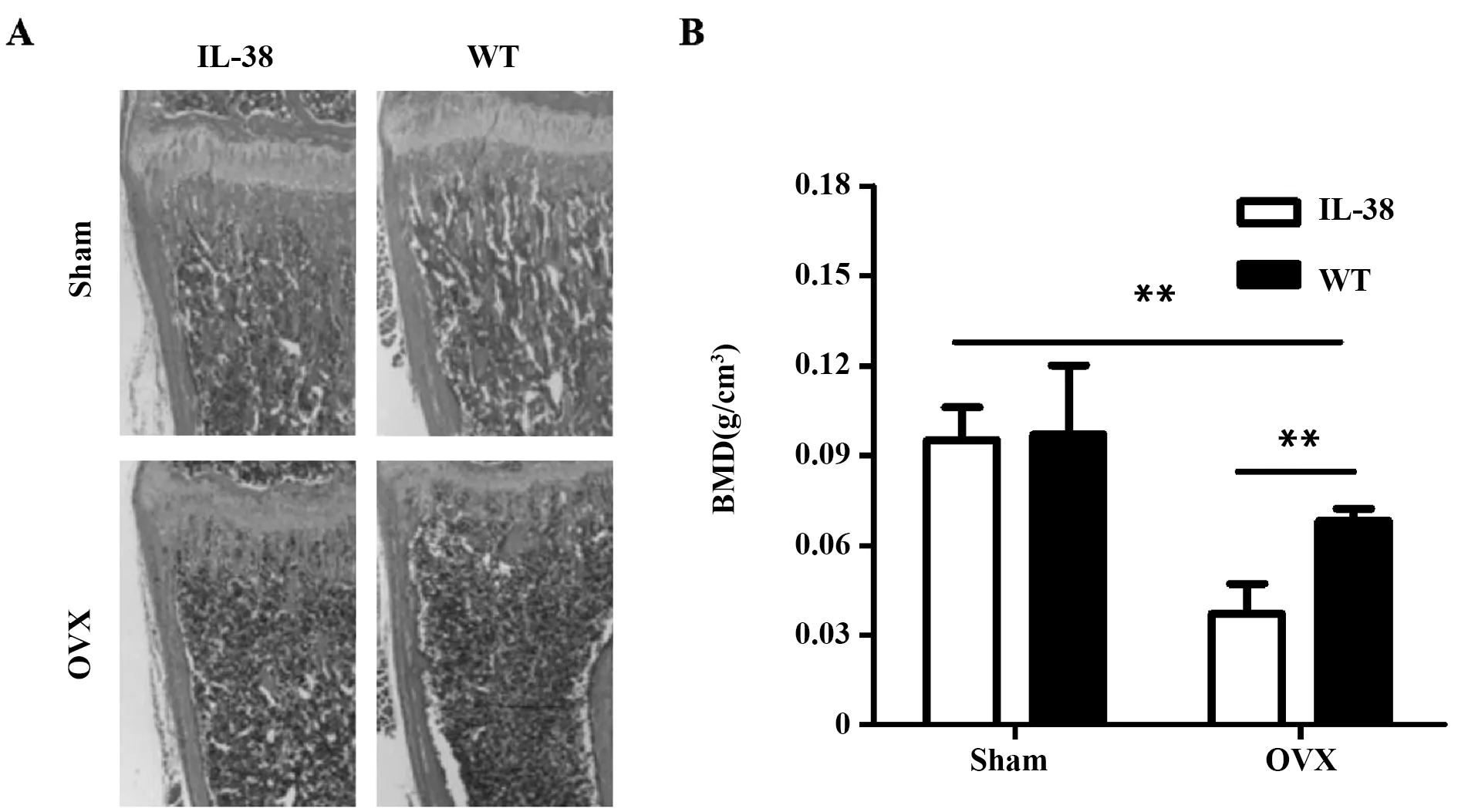
图1 小鼠股骨病理切片及脊柱骨密度比较Fig.1 Comparison of pathological sections of femur and spine bone densityNote: **.P<0.01.

图2 BMSCs的增殖及PI3K、Akt、GSK3β与NFATc1的磷酸化水平比较Fig.2 Comparison of proliferation,phosphorylation level of PI3K,Akt,GSK3β and NFATc1 of BMSCsNote: **.P<0.01.

图3 IL-38对小鼠成骨细胞MC3T3-E1的影响Fig.3 Influence of IL-38 on MC3T3-E1Note: **.P<0.01.
3 讨论
骨质疏松的主要特征为骨量低下、骨微结构破坏、骨脆性增加、易发生骨折等[1]。在成年脊椎动物的骨代谢过程中,骨形成和骨吸收是影响重建的一对最重要耦联动态因素,两个过程持续不断地交替发生,使得骨骼不断更新,从而维持骨代谢稳态,因此这两种细胞功能异常在骨质疏松发病机理中扮演着重要角色[2]。一旦平衡被打破,骨吸收量超过形成量,则会发生骨质疏松,即发生病理性重塑,骨组织微形态结构将发生改变[9]。本次研究结果显示,骨质疏松组患者的血清IL-38水平显著低于对照组,提示IL-38的缺失可能在骨质疏松的发生发展中扮演一定的角色。IL-38转基因OVX小鼠的骨组织形态结构破坏和骨密度下降情况均较野生型OVX小鼠显著减轻;体外培养的IL-38转基因OVX小鼠BMSCs的增殖能力显著高于野生型OVX组;转染IL-38后MC3T3-E1细胞凋亡显著减少。这些结果都说明IL-38可能在骨质疏松小鼠模型的发病过程中发挥重要作用。
IL-38是IL-1家族的第10个成员,又被称为IL-1F10,人的IL-38基因位于2号染色体2q13-14.1[6,7]。IL-38的一般特性与IL-1所有成员接近,广泛表达于免疫组织(如脾、胸腺、扁桃体等)中,在皮肤和扁桃体B细胞中的表达尤为明显,在心脏、胎盘等无免疫功能的组织中则表达不高[7,10]。IL-1家族细胞因子广泛存在于炎性细胞内,对调节所有真核生物的健康与疾病起着不可或缺的作用[11]。Ven de Veerdonk等[6]证明IL-38能与IL-36R特异性结合,高浓度IL-38比相同浓度的IL-36Ra与IL-36R的结合能力更强。IL-38与IL-36受体结合对免疫细胞产生的生物学作用与IL-36Ra和IL-36R受体结合对免疫细胞产生的生物学作用相似,推测IL-38也可能通过抑制IL-36(α、β、γ)与IL-36R的结合而发挥抗炎作用[6]。
PI3K/Akt信号通路是细胞增殖、转移、黏附和死亡过程的重要调节者[4]。在正常生理条件下,PI3K/Akt信号通路可选择性的影响成骨细胞和破骨细胞的生理功能,对维持骨组织动态平衡具有重要作用[4,5]。此外,PI3K/Akt信号通路对破骨细胞的存活也是至关重要的[12]。以PI3K/Akt为靶点有可能成为研究开发治疗骨质疏松症的新途径。破骨细胞的形成过程需要两个关键性因子:RANKL和巨噬细胞集落刺激因子(M-CSF)[13]。RANKL属肿瘤坏死因子(TNF)超家族成员,能诱导破骨形成的关键转录因子(如NF-κB、c-Fos等)的转录,是破骨细胞形成的主要调节者[14]。PI3K/Akt/GSK3β/NFATc1信号通路在RANKL引起的破骨细胞形成和分化过程中扮演着非常重要的角色。本次研究结果显示,IL-38转基因OVX小鼠BMSCs的PI3K、Akt与NFATc1磷酸化水平均显著低于野生型OVX组,GSK3β磷酸化水平显著高于野生型OVX组。MC3T3-E1细胞转染IL-38后PI3K、Akt与NFATc1的磷酸化水平均显著降低,GSK3β的磷酸化水平显著升高。因此,对PI3K/Akt/GSK3β/NFATc1信号通路的调控可能是IL-38抑制骨质疏松的一种潜在机制。
综上所述,骨质疏松患者的血清IL-38水平显著降低,IL-38可能通过调控PI3K/Akt/GSK3β/NFATc1信号通路促进BMSCs的增殖、抑制成骨细胞的凋亡,从而发挥抑制骨质疏松的作用。
[1] Diab DL,Watts NB.Postmenopausal osteoporosis [J].Curr Opin Endocrinol Diabetes Obes,2013,20(6):501-509.
[2] 王子江,向 川.骨质疏松症与骨关节炎的相关性研究新进展[J].中国骨质疏松杂志,2014,20(3):310-314.
Wang ZJ,Xiang C.New progress in the study of the correlation between osteoporosis and osteoarthritis[J].Chin J Osteoporosis,2014,20 (3): 310-314.
[3] Hannafon F,Cadogan MP.Recognition and treatment of postmenopausal osteoporosis [J].J Gerontol Nurs,2014,40(3):10-14.
[4] Xi JC,Zang HY,Guo LX,etal.The PI3K/AKT cell signaling pathway is involved in regulation of osteoporosis [J].J Recept Signal Transduct Res,2015,35(6):640-645.
[5] Zhao C,Sun W,Zhang P,etal.miR-214 promotes osteoclastogenesis by targeting Pten/PI3k/Akt pathway [J].RNA Biol,2015,12(3):343-353.
[6] van de Veerdonk FL,Stoeckman AK,Wu G,etal.IL-38 binds to the IL-36 receptor and has biological effects on immune cells similar to IL-36 receptor antagonist [J].Proc Natl Acad Sci U S A,2012,109(8):3001-3005.
[7] Boutet MA,Bart G,Penhoat M,etal.Distinct expression of interleukin (IL)-36α,β and γ,their antagonist IL-36Ra and IL-38 in psoriasis,rheumatoid arthritis and Crohn′s disease [J].Clin Exp Immunol,2016,184(2):159-173.
[8] 张 哲,徐秀娟,刘 欣,等.老鹳草素对小鼠骨髓基质干细胞增殖及成骨分化的影响[J].中国临床药理学杂志,2016,32(7):633-636.
Zhang Z,Xu XJ,Liu X,etal.Geraniin on mouse bone marrow stromal stem cell proliferation and osteogenic differentiation in vitro China[J].J Clin Pharmacol,2016,32 (7): 633-636.
[9] Curtis EM,Moon RJ,Dennison EM,etal.Recent advances in the pathogenesis and treatment of osteoporosis[J].Clin Med (Lond),2015,15(Suppl 6):s92-96.
[10] Ummarino D.Experimental arthritis:IL-38 promotes anti-inflammatory effects [J].Nat Rev Rheumatol,2017,13(5):260.
[11] Akdis M,Aab A,Altunbulakli C,etal.Interleukins (from IL-1 to IL-38),interferons,transforming growth factor β,and TNF-α:Receptors,functions,and roles in diseases [J].J Allergy Clin Immunol,2016,138(4):984-1010.
[12] Ding G,Zhao J,Jiang D.Allicin inhibits oxidative stress-induced mitochondrial dysfunction and apoptosis by promotingPI3K/AKT and CREB/ERK signaling in osteoblast cells [J].Exp Ther Med,2016,11(6):2553-2560.
[13] Qu X,Zhai Z,Liu X,etal.Dioscin inhibits osteoclast differentiation and bone resorption though down-regulating the Akt signaling cascades [J].Biochem Biophys Res Commun,2014,443(2):658-665.
[14] Capozzi A,Lello S,Pontecorvi A.The inhibition of RANK-ligand in the management of postmenopausal osteoporosis and related fractures:the role of denosumab [J].Gynecol Endocrinol,2014,30(6):403-408.
