IL-35在慢性鼻-鼻窦炎伴鼻息肉组织的表达与意义①
2018-03-07陈力学黄江菊
李 军 陈力学 沈 晹 刘 欢 黄江菊
(重庆医科大学附属第一医院耳鼻咽喉头颈外科,重庆 400016)
慢性鼻-鼻窦炎(Chronic rhinosinusitis,CRS)是一种较为高发的局部慢性炎症性疾病,据报道全球的患病率约5%~12%[1],而我国略低约为2%~8%[2],其治疗方案主要是常规药物加鼻内镜手术的综合治疗方式。当前CRS基于鼻息肉的存在或不存在,临床分为两种亚型,各自具有典型的组织重塑特点及炎症模式[1]。其中慢性鼻-鼻窦炎伴鼻息肉(Chronic rhinosinusitis with nasal polyps,CRSwNP)临床症状评分高且有更多的鼻部症状,复发率居高不下,成为耳鼻咽喉头颈外科难治性疾病。但是对CRSwNP的发病机制并不完全清楚,仍有待更深一步的研究。
IL-35拥有IL-12家族较为典型的结构特点,是最新识别的家族成员,在T细胞活化、增殖及释放细胞因子等方面起着重要的调节作用[3,4]。IL-35作为一种新型抑制性细胞因子,在多种疾病表达中均有显著性改变,并参与了这些疾病的发生发展,如类风湿性关节炎、病毒性乙型肝炎、哮喘和变应性鼻炎等[5-10]。此外IL-35表达水平降低已被证实与呼吸道炎症的发展有关[11,12]。而CRSwNP是鼻腔和鼻窦黏膜慢性炎症性疾病,所以考虑IL-35与CRSwNP发生发展有关,其免疫调节作用仍有待研究。因此,本研究中我们拟对CRSwNP患者的临床手术标本应用酶联免疫吸附试验(ELISA)及实时荧光PCR(RT-PCR)等检测技术,初步观察IL-35在鼻息肉组织中的表达情况,为分析其在鼻息肉组织产生过程中发挥的作用提供可靠的理论基础。
1 材料与方法
1.1研究对象和标本 随机选取2016年5月~2017 年4月在我科住院CRSwNP患者(诊断符合EPOS2012标准)共51 例(CRSwNP组),手术前均需电子鼻咽喉镜及鼻窦 CT 检查。统计国际上广泛认可的患者症状VAS 评分、电子鼻咽喉镜检查的Lanza-Kennedy评分及鼻窦CT检查Lund-Mackay评分,并在术中留取部分鼻息肉组织。另选取10例同期因单纯鼻中隔偏曲行手术治疗患者的正常下鼻甲黏膜组织作为对照组。以上选取的患者均排除肝炎、结核等感染性疾病,且术前4周之内均未使用免疫抑制剂、糖皮质激素以及各类鼻局部喷剂。两组对象临床基本特点见表1。
1.2方法
1.2.1鼻息肉组织中总 RNA 的提取 采用Trizol法提取鼻息肉组织总RNA,具体步骤如下:(1)取100 mg鼻息肉组织于1 ml Trizol 中组织匀浆,立即静置于冰上5 min后离心10 min(12 000 r/min,4℃)。(2)吸取上清液,加入氯仿200 μl,混匀,室温静置5 min后离心10 min(12 000 r/min,4℃)。(3)吸取上清液,加入等体积的异丙醇,混匀,室温静置15 min后离心15 min(12 000 r/min,4℃)。(4)弃上清液,加入75%的乙醇1 ml,漂洗沉淀后离心5 min(7 500 r/min,4℃)。(5)弃上清液,室温干燥10 min,加DEPC水溶解RNA,置-80℃保存备用。
1.2.2IL-35 mRNA扩增检测 (1)逆转录合成cDNA:将模板RNA、逆转录试剂盒内的试剂解冻(TaKaRa公司产品),并在使用前混匀;在200 μl EP管中加入:Oligo dT Primer终浓度为2.5 μmol/L,模板RNA 500 ng,5×PrimeScript Buffer含dNTP Mixture和 Mg2+,用无RNase的ddH2O补至最终体积为20 μl;轻轻混匀 37℃孵育15 min;65℃加热10 min,逆转录完成,将cDNA保存于-20℃备用。(2)引物合成:由于IL-35的基因组成为EBI3及IL-12A,因此在Genbank查找人类EBI3 mRNA、IL-12A mRNA序列,引物的设计和检测采用Primer 5.0软件,以β-actin作为内参。引物由南京金斯瑞生物科技有限公司合成并标记荧光,引物名称、序列及扩增片段大小见表2。(3)反应体系及反应条件:对逆转录产物进行扩增,反应体系:逆转录cDNA模板1 μl,上游引物终浓度为0.5 μmol/L,下游引物终浓度为0.5 μmol/L,SYBR Green Mix 10 μl,用无RNase的ddH2O补至最终体积为20 μl; PCR反应条件如下:95℃预变性3 min;95℃变性5 s,56℃退火10 s,72℃延伸25 s,共39个循环。
1.2.3ELISA 检测鼻息肉组织中IL-35、IL-10和 IL-17蛋白的表达 取100 mg鼻息肉组织加入1 ml PBS缓冲液,并剪碎。置于冰浴中,用玻璃匀浆器碾碎后,将离心机设定为4℃,3 000 r/min,将其离心15 min,吸取上清液。采用ELISA法分别测定IL-35、IL-10和 IL-17水平(试剂盒为中国ColorfulGene公司产品),具体操作依据试剂盒说明书进行。

表1对照组和CRSwNP组患者的临床特点
Tab.1ClinicalcharacteristicsbetweencontrolgroupandCRSwNPgroup
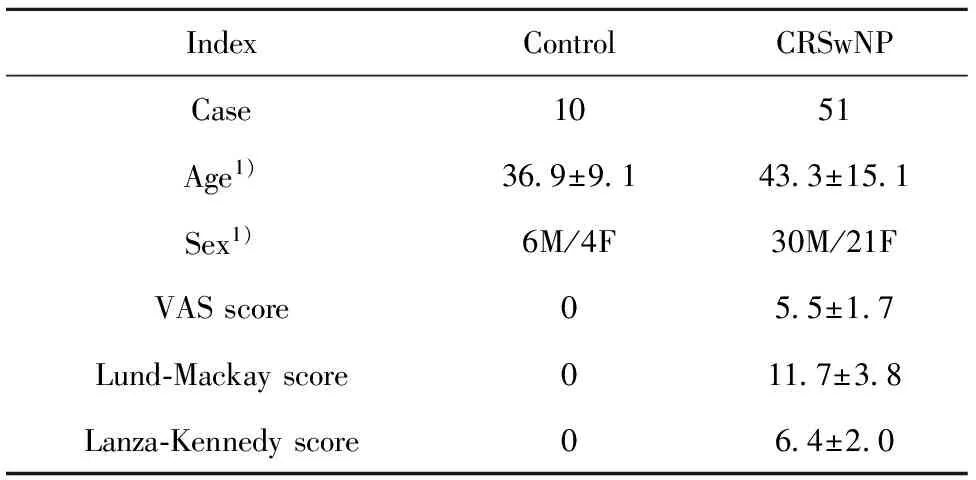
IndexControlCRSwNPCase1051Age1)36 9±9 143 3±15 1Sex1)6M/4F30M/21FVASscore05 5±1 7Lund⁃Mackayscore011 7±3 8Lanza⁃Kennedyscore06 4±2 0
Note:Vs control group,1)P>0.05.
表2IL-35mRNA扩增所需的引物序列
Tab.2IL-35mRNAamplificationrequiredforprimersequences

PrimersSequencesbpEBI3forward5⁃ACATCATCAAGCCCGACC⁃3144EBI3reverse5⁃CCTGACGCTTGTAACGGA⁃3IL⁃12Aforward5⁃TTGTGGCTACCCTGGTCCTC⁃3105IL⁃12Areverse5⁃GGTTTTGGGAGTGGTGAAGG⁃3β⁃Actinforward5⁃ACACTGTGCCCATCTACG⁃3153β⁃Actinreverse5⁃TGTCACGCACGATTTCC⁃3
2 结果
2.1鼻息肉组织中IL-35 mRNA的检测 采用Real-time PCR技术,检测EBI3 mRNA和IL-12A mRNA表达水平。结果显示,较正常下鼻甲黏膜组织中表达相比,鼻息肉组织中EBI3 mRNA呈低表达水平(图1A)P<0.05;而鼻息肉组织中IL-12A mRNA也呈低表达水平(图1B),P<0.05。
2.2CRSwNP患者鼻息肉组织中IL-35、IL-10和IL-17水平的ELISA检测 采用 ELISA 方法检测鼻息肉组织中IL-35、IL-17 和IL-10表达,结果见图2。与正常下鼻甲黏膜组织中的表达相比,鼻息肉组织中IL-35表达略有降低(图2A),P<0.05;而IL-17 和IL-10表达显著增高(图2B、C),P<0.05。

图1 IL-35在正常鼻黏膜组织和鼻息肉组织中的mRNA表达Fig.1 mRNA expression of IL-35 in normal nasal mucosa and chronic rhinosinusitis with nasal polypsNote: Vs control group,*.P<0.05.
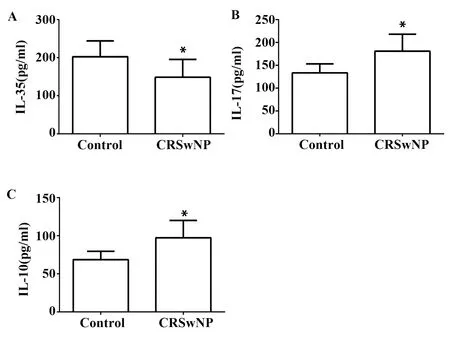
图2 IL-35,IL-17和IL-10在正常鼻黏膜组织和鼻息肉组织中的蛋白浓度Fig.2 Concentrate of IL-35,IL-17 and IL-10 in normal nasal mucosa and chronic rhinosinusitis with nasal polyps were detected by ELISANote: Vs control group,*.P<0.05.
3 讨论
鼻息肉组织是鼻腔和鼻窦黏膜过度水肿继而突出的炎性组织,常见于中鼻道和鼻窦黏膜。CRSwNP属于慢性炎症性疾病,严重影响患者日常的生活质量[13]。患者的症状VAS 评分、电子鼻咽喉镜检查的Lanza-Kennedy评分及鼻窦CT检查Lund-Mackay评分是诊断CRSwNP的三个重要依据,可综合客观的评估疾病严重程度、病变的性质和累及范围,最终决定治疗方案。鼻内镜手术可显著改善大多数的CRSwNP患者鼻部症状VAS 评分,但有一部分患者术后息肉复发,且随着术后时间的延长,复发患者也逐渐增多。一般而言,大约有15%~20%的患者需要接受再手术治疗[14]。所以,研究CRSwNP的发病机制仍是提高防治效果的关键。目前对CRSwNP的研究主要集中在鼻腔解剖结构异常、炎症的持续性刺激以及鼻腔黏膜的应激反应等方面。目前普遍认可的是炎症对鼻黏膜的持续性刺激及细胞因子在鼻息肉的形成中发挥的作用。近年随着免疫学的快速发展,细胞因子成为学者研究的主要方向,现有大量的文献报道鼻息肉组织中的多种细胞因子如IL-33、IL-9及IL-13等呈高表达。这说明,各种细胞和细胞因子之间的相互调节和平衡在CRSwNP的发生发展中起关键作用。如何利用免疫学前沿研究成果和临床结合,寻找关键细胞因子作为特异性免疫治疗的靶点,将是研究的主要方向。但是目前仍存在较多需要继续研究的问题。
IL-35是近期发现的一种重要的抑制性细胞因子,由P35亚基(IL-12)和EBI3亚基(IL-27)组成,通过Treg细胞发挥的免疫抑制和调节作用[15]。IL-35主要由Treg细胞诱导产生,也可由活化的B细胞和部分活化的内皮细胞、单核细胞和平滑肌细胞分泌产生,通过激活Jak-STAT信号通路进行信号传导参与免疫调节的功能[16]。在慢性炎症反应阶段,IL-35通过扩增Treg细胞抑制Thl细胞增殖分化,降低自身组织炎症损伤的程度[17];还可以抑制Th17细胞的分化及其细胞因子IL-17的产生,抑制炎症的进一步发展[18],也可通过诱导产生细胞因子IL-10发挥积极的抗炎作用。这些机制说明IL-35在慢性炎症性疾病的发展过程中发挥重要的抑制作用。T细胞是人体免疫系统中较为重要的组成部分,在CRSwNP的发生发展中发挥着重要作用。Th1和Th2与人体的免疫状态紧密相关,而Th17和Treg对人体免疫功能也具有不可代替的调节功能,正常情况下在数量和功能方面保持相对平衡。我们早期在研究CRSwNP的患者时发现,Th17/Treg表达的失衡释放各种炎症介质,促进局部炎症反应及黏膜的损伤和重塑,在鼻息肉组织的形成中起着较为关键的作用[19]。IL-17是一种有较强促炎作用的细胞因子,由Th17细胞诱导产生。在CRSwNP患者外周血中Th17细胞的比例增加,鼻息肉组织中IL-17和嗜酸性粒细胞均较正常下鼻甲黏膜组织呈高表达[19]。这说明IL-17不仅促进了嗜酸性粒细胞在息肉组织中的浸润和活化,Th17细胞还通过释放更多数量的炎症相关细胞因子,加速了鼻窦黏膜局部炎症反应,导致局部组织损伤和黏膜重塑。而IL-35可明显抑制Th17细胞的分化及其细胞因子IL-17的产生,抑制炎症的进一步发展[20]。另外,CRSwNP患者外周血中Treg的比例明显低于对照组[19]。IL-35可促进小鼠CD4+T细胞的增殖,经体外培养后Treg可被最大程度的活化,其结果表明IL-35可明显扩增Treg的数量[17]。在小鼠或人体内用IL-35刺激传统T细胞时,可诱导分化成一种新型Treg细胞(iTr35),并通过特异性分泌产生IL-35发挥其抑制作用;而传统Treg细胞也可以通过分泌IL-35来诱导传统T细胞转变为iTR35细胞,使IL-35与iTr35细胞形成正反馈调节机制,发挥更强的抑制功能[21]。我们在鼻息肉组织中检测IL-35的蛋白和IL-35 mRNA(EBI3 mRNA和IL-12A mRNA)均呈低表达水平,与正常下鼻甲黏膜组织中的表达相比,差异有统计学意义。这提示我们,CRSwNP患者外周血中减少的 Treg 细胞导致其数量和功能的不足,使细胞因子IL-35的水平随之降低,较低水平的IL-35又影响了Treg细胞的表达和作用,最终导致调节功能降低,无法抑制和调节亢进的Th17细胞的促炎作用,致使其细胞比率的失衡,从而促进了鼻息肉组织的形成。检测鼻息肉组织IL-35和IL-17的表达结果也印证我们的推测。这些是对Th1/Th2细胞失衡理论的重要补充,也是CRSwNP发生与形成的重要机制。
IL-35主要通过促进Treg细胞增殖和抑制Th17细胞的分化发挥调控作用,而rhIL-35的出现是否是潜在的治疗靶点,是否可以减缓局部鼻黏膜炎症反应程度,降低CRSwNP患者VAS 评分、Lanza-Kennedy评分及Lund-Mackay评分,在鼻息肉组织的发生发展中起到特异性免疫治疗的作用。Wang等[8]研究支气管哮喘患者时发现外周静脉血中IL-35的蛋白水平和mRNA水平均呈低表达。在体外加入的rhIL-35以剂量依赖的方式抑制了CD4+CD25-T细胞的增殖。同时,Kochetkova等[20,22]对类风湿性关节炎小鼠模型的研究发现,在小鼠的关节rhIL-35后可以不同程度的降低炎症反应,关节肿胀也不同程度得到部分减缓。这些研究也为CRSwNP的治疗及预防提供新思路。在CRSwNP发生发展的过程中,各种细胞及细胞因子之间的相互调节和平衡非常重要。在理想的情况下,通过抑制或阻断其中一个通路就可调节和平衡其发生发展。然而,鼻息肉的形成是一个非常复杂的调节和平衡的过程,rhIL-35的特异性免疫调节功能也需精准化治疗来实现,这些都仍需进一步的研究。尽管CRSsNP已被证明主要是Th1极化的炎症,CRSwNP的特点是Th2倾向嗜酸性粒细胞性炎症特征。但是,CRSwNP在不同种族、地域及环境等因素下的表现各异。研究显示西方人群中Th2倾向嗜酸性炎症占优势,而亚洲人群中鼻息肉表现Th1或Th17倾向中性粒细胞炎症特征[23,24]。因此,不同的表型的CRSwNP可能IL-35的表达也有差异,还需扩大样本量、丰富检测方法以进一步证实。
总之,我们的研究显示IL-35在鼻息肉组织中呈低表达水平,提示IL-35可能在CRSwNP的病理机制中起着关键的作用。IL-35在鼻息肉中的功能及作用仍需进一步研究和探索。
[1] Bachert C,Zhang L,Gevaert P.Current and future treatment options for adult chronic rhinosinusitis:Focus on nasal polyposis[J].J Allergy Clin Immunol,2015,136(6):1431-1440.
[2] Shi JB,Fu QL,Zhang H,etal.Epidemiology of chronic rhinosinusitis:results from a cross-sectional survey in seven Chinese cities[J].Allergy,2015,70(5):533-539.
[3] Choi J,Leung PSC,Bowlus C,etal.IL-35 and autoimmunity:a comprehensive perspective[J].Clin Rev Allergy Immunol,2015,49(3):327-332.
[4] Collison LW,Chaturvedi V,Henderson AL,etal.IL-35-mediated induction of a potent regulatory T cell population[J].Nat Immunol,2010,11(12):1093-1101.
[5] Nakano S,Morimoto S,Suzuki S,etal.Immunoregulatory role of IL-35 in T cells of patients with rheumatoid arthritis[J].Rheumatology,2015,54(8):1498-1506.
[6] 姜申易,鲁 静.IL-35在类风湿关节炎中的研究进展[J].中国免疫学杂志,2015,31(12):1714-1717.
Jin SY,Lu J.Research progress of IL-35 in rheumatoid arthritis[J].Chin J Immunol,2015,31(12): 1714-1717.
[7] Li X,Tian L,Dong Y,etal.IL-35 inhibits HBV antigen-specific IFN-γ-producing CTLsin vitro[J].Clin Sci,2015,129(5):395-404.
[8] Wang W,Li P,Chen YF,etal.A potential immunopathogenic role for reduced IL-35 expression in allergic asthma[J].J Asthma,2015,52(8):763-771.
[9] 扶红根,雷后兴.白介素-35与支气管哮喘的相关性研究进展[J].中国免疫学杂志,2016,32(1):123-126.
Fu HG,Lei HX.Relationship between interleukin-35 and bronchial asthma[J].Chin J Immunol,2016,32(1): 123-126.
[10] 万 俊,罗 英,杨春平,等.变应性鼻炎患者外周血IL-35及EBI3 mRNA和IL-12A mRNA表达的研究[J].临床耳鼻咽喉头颈外科杂志,2014,28(13):952-954.
Wan J,Luo Y,Yang CP,etal.Expression of IL-35,epstein-barr virus-induced gene 3 mRNA and IL-12A mRNA in peripheral blood of patients with allergic rhinitis[J].J Clin Otorhinolaryngol Head Neck Surgery,2014 ,28(13): 952-954.
[11] Bai J,Qiu S,Zhong X,etal.Erythromycin enhancesCD4+Foxp3+regulatory T-cell responses in a rat model of smoke-induced lung inflammation[J].Mediators Inflammation,2012,2012:1-9.
[12] Ouyang Y,Nakao A,Fan E,etal.Decreased expression of EBI3 and Foxp3 in CD4+CD25+regulatory T cells in murine experimental allergic rhinitis[J].ORL,2011,73(6):313-320.
[13] 左可军,许 庚,史剑波,等.慢性鼻-鼻窦炎鼻息肉患者的生存质量调查[J].中华耳鼻咽喉头颈外科杂志,2006,41(10):748-752.
Zuo KJ,Xu G,Shi JB,etal.Quality of life survey on patients with chronic rhinosinusitis and nasal polyps [J].Chin J Otorhinolaryngol Head Neck Surgery,2006,41(10): 748-752.
[14] Georgalas C,Cornet M,Adriaensen G,etal.Evidence-based surgery for chronic rhinosinusitis with and without nasal polyps[J].Curr Allergy Asthma Rep,2014,14(4):427.
[15] Collison LW,Chaturvedi V,Henderson AL,etal.IL-35-mediated induction of a potent regulatory T cell population[J].Nat Immunol,2010,11(12):1093-1101.
[16] Vignali DAA,Kuchroo VK.IL-12 family cytokines:immunological playmakers[J].Nat Immunol,2012,13(8):722-728.
[17] Niedbala W,Wei X,Cai B,etal.IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J].Eur J Immunol,2007,37(11):3021-3029.
[18] Yang J,Yang M,Htut TM,etal.Epstein-Barr virus-induced gene 3 negatively regulates IL-17,IL-22 and RORγt[J].Eur J Immunol,2008,38(5):1204-1214.
[19] Shen Y,Tang XY,Yang YC,etal.Impaired Balance of Th17/Treg in patients with nasal polyposis[J].Scan J Immunol,2011,74(2):176-185.
[20] Kochetkova I,Golden S,Holderness K,etal.IL-35 stimulation of CD39+regulatory T cells confers protection against collagen II-induced arthritis via the production of IL-10[J].J Immunol,2010,184(12):7144-7153.
[21] Collison LW,Chaturvedi V,Henderson AL,etal.IL-35-mediated induction of a potent regulatory T cell population[J].Nat Immunol,2010,11(12):1093-1101.
[22] Niedbala W,Wei XQ,Cai B,etal.IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J].Eur J Immunol,2007,37(11):3021-3029.
[23] Cao P,Li H,Wang B,etal.Distinct immunopathologic characteristics of various types of chronic rhinosinusitis in adult Chinese[J].J Allergy Clin Immunol,2009,124(3):478-484.
[24] 巴 罗,杜进涛,蔡舜玉,等.不同免疫表型鼻息肉中黏膜炎症模式与组织重塑特征[J].临床耳鼻咽喉头颈外科杂志,2016,30(16):1302-1307.
Ba L,Du JT,Cai SY,etal.The inflammatory pattern and the characteristics of mucous remodeling in different immune type of nasal polyps[J].J Clin Otorhinolaryngol Head Neck Surg,2016,30(16): 1302-1307.
