多西他赛联合泼尼松治疗激素抵抗性PCa临床疗效及对细胞因子的影响
2018-03-06张国颖雷永虹王启林
张国颖,白 宇,雷永虹,王启林
(云南省肿瘤医院泌尿外科,昆明 650000)
前列腺癌(prostatic cancer,PCa)为男性常见多发性恶性肿瘤之一,我国前列腺癌的发病率呈逐年上升趋势,位列男性恶性肿瘤发病率的第6位[1]。晚期患者临床推荐一线治疗方案为抗雄性激素内分泌治疗。几乎所有患者都逐渐由雄激素依赖性PCa(androgen dependent PCa,ADPC)发展成为转移性去势抵抗性PCa(metastatic castration-resistant PCa,mCRPC),又称激素抵抗性PCa[2]。激素抵抗阶段的患者其中位生存时间将大大缩短[3]。多西他赛为20世纪90年代用于临床的紫杉类化合物抗肿瘤药物,能够加强微管蛋白聚合作用和抑制微管解聚,对非小细胞肺癌、卵巢癌、乳腺癌及PCa均有一定治疗作用[4]。本研究选取本院晚期激素非依赖性PCa患者,采用多西他赛联合泼尼松治疗,取得较好临床疗效,现报道如下。
1 资料与方法
1.1一般资料 选择本院2010年2月至2013年2月门诊及住院收治的激素抵抗性PCa患者88例,采用随机数字列表法分为观察组与对照组,每组各44例,在治疗过程中,观察组患者2例病重死亡,2例患者不良反应严重退出试验;对照组患者3例病重死亡,2例患者不良反应严重退出试验。观察组和对照组病理分期为T2c-分别有13例和14例,T3a+分别有27例和25例;在Gleason评分小于或等于7分的均为26例,>7分的分别为14例和13例。观察组和对照组患者平均年龄分别为(70.18±14.57)、(72.34±16.92)岁,前列腺特异性抗原(PSA)分别为(68.47±7.45)、(71.34±6.46)ng/mL。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。诊断标准参考欧洲泌尿外科协会(european association of urology,EAU) 2015年版mCRPC 诊断指南[5],两组患者均经穿刺活检证实为PCa。纳入标准:符合诊断标准,并自愿签署知情同意书,能够配合试验完成的患者;PSA经抗雄激素治疗明显下降,又呈逐渐上升趋势的患者;血浆睾酮水平低于50 ng/mL的患者;近期(6个月内)未接受过放疗或化疗的患者;体力状况(KPS)评分大于60分,预计生存周期大于6个月的患者。排除标准:有接受细胞毒性药物化疗患者;合并其他严重系统性疾病患者;出现脑脊膜转移患者。
1.2方法
1.2.1治疗方法 两组患者均采用常规的化疗及辅助治疗:在化疗前可辅助静脉滴注地塞米松及5-羟色胺受体拮抗剂进行抗过敏治疗。对照组采用米托蒽醌联合泼尼松治疗,化疗开始第1日予米托蒽醌(浙江瑞新药业股份有限公司,5 mg,国药准字H20057796) 12 mg/m2加入250 mL的0.9%氯化钠注射液静脉滴注,口服泼尼松(维敏制药有限责任公司,5 mg,国药准字H14020024),每次5 mg,每天2次;观察组采用多西他赛联合泼尼松治疗,化疗开始第1日予多西他赛(北京双鹭药业股份有限公司,0.5 mL∶20 mg,国药准字H20163415)75 mg/m2加入250 mL的0.9%氯化钠注射液静脉滴注,口服泼尼松,每次5 mg,每天2次,21 d为1个疗程。化疗过程中,予常规的护肝、护胃、止吐等对症治疗。出现严重骨髓抑制患者,予粒细胞集落刺激因子(G-CSF)或白细胞介素(IL)-11 支持治疗。
1.2.2临床疗效 参照文献[6]的标准,在化疗结束后,以血清PSA 检查为主要疗效评价指标,完全缓解:血清PSA<4 ng/mL;部分缓解:血清PSA水平与治疗前比较下降50%以上;稳定:血清PSA水平与治疗前比较下降,但未超过基线的50%;无效:血清PSA表达水平升高。以完全缓解+部分缓解例数计算总有效率。
1.2.3观察指标 采用酶联免疫吸附试验(ELISA)检测治疗前后两组患者外周血中IL-6水平;药物毒性分级采用WHO抗癌药物毒性反应分级评估标准评价两组患者治疗后不良反应发生情况。

2 结 果
2.1两组患者临床疗效比较 治疗后观察组、对照组患者总有效率分别为77.50%、64.10%,两组比较差异无统计学意义(χ2=1.72,P>0.05),见表1。
2.2两组患者治疗前后血清IL-6表达水平比较 治疗前,两组患者血清IL-6表达水平比较,差异无统计学意义(t=0.64,P>0.05);治疗后两组患者血清IL-6表达水平均降低(t=10.21,P<0.05),其中观察组患者血清IL-6表达水平明显低于对照组(t=5.04,P<0.05),见表2。
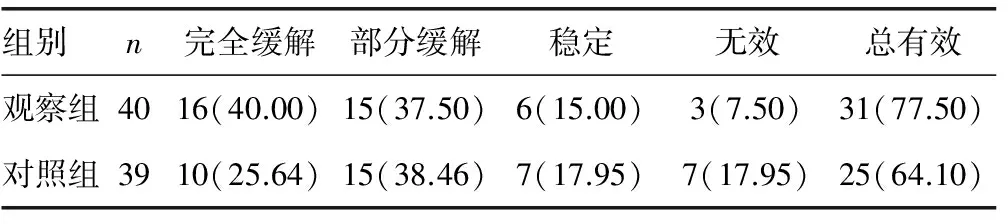
表1 两组患者临床疗效比较[n(%)]
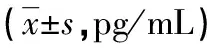
表2 两组患者治疗前后血清IL-6表达水平比较
a:P<0.05,与治疗前比较;b:P<0.05,与对照组比较
2.3两组患者不良反应情况比较 观察两组患者治疗后中重度(Ⅲ~Ⅳ度)不良反应发生情况,观察组患者中重度骨髓抑制、恶心呕吐、疲劳乏力、水液潴留发生率分别为22.50%、22.50%、7.50%、2.50%;对照组患者中重度骨髓抑制、恶心呕吐、疲劳乏力、水液潴留发生率分别为23.08%、20.51%、5.13%、0,两组比较均差异无统计学意义(P>0.05),见表3。
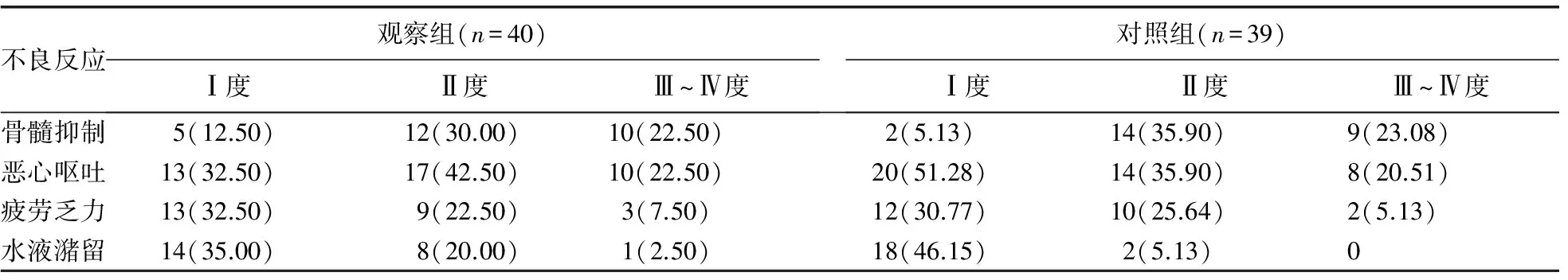
表3 两组患者不良反应情况比较[n(%)]
2.4两组患者中位生存期比较 治疗结束3年后,观察组患者死亡10例,中位生存期为(834.45±25.57)d;对照组患者死亡14例,中位生存期为(526.63±35.37)d,两组比较差异有统计学意义(t=44.41,P<0.05)。
3 讨 论
随着我国人口老龄化进程加速,PCa的发病率呈逐年上升趋势。临床采用的PCa一线治疗方案患者均不可避免的出现激素抵抗现象,92%的初始对内分泌治疗敏感的PCa患者最终都将产生激素抵抗问题,导致不可逆的临床进展恶化[7]。激素抵抗表现为原发灶增大或出现转移灶或血清PSA持续升高[8]。关于激素抵抗原因假设学说包括:克隆选择性学说[9]、适应性学说[10]、抗凋亡基因学说[11]、雄激素受体(AR)突变学说[12]、生长因子学说[13]。
目前,化疗仍是雄激素抵抗性PCa的主要治疗方法[14]。米托葸醌为第一个被证实对激素抵抗性PCa有效的化疗药物[15]。临床研究发现米托蒽醌联合泼尼松可缓解激素抵抗性PCa患者临床症状,包括骨性痛等,对患者的生活质量有明显的改善,但针对患者生存期并无延长作用[16]。与传统的纺锤体毒性药物不同,多西他赛与微管的结合不改变原丝的数目,通过干扰细胞有丝分裂和分裂间期细胞功能所必需的微管网络,使有丝分裂过程停滞,细胞被阻滞在G2期,丧失了正常功能的微管束的产生,随后凋亡[17]。动物实验证实,多西他赛能够促进Bcl-2 磷酸化,减聚Bcl-2/Bax 异二聚体,增聚Bax/Bax 二聚体,从而诱导肿瘤细胞凋亡[18]。Ⅲ期临床试验发现,多西他赛在控制PCa患者临床症状同时,能够延长雄激素抵抗性PCa患者的生存期[19]。以前研究发现多西他赛联合泼尼松疗效优于米托蒽醌联合泼尼松方案,PCa患者中位生存期更长,在大样本临床研究中证实了多西他赛对激素抵抗性PCa的治疗作用[20]。但有专家指出,多西他赛在不同人种中的耐受性不同,针对亚洲人应探求更为有效的药物使用剂量及联合用药方式[21]。
本研究发现,两组患者治疗前后外周血IL-6表达情况,发现经化疗后,两组患者IL-6表达均有所降低,但观察组患者改善情况优于对照组,提示多西他赛联合泼尼松能够改善患者免疫抑制状态。研究已证实,IL-6的表达水平与PCa患者临床分期相关,随肿瘤的恶化IL-6表达不断升高,且激素抵抗PCa患者明显高于非激素抵抗PCa患者,IL-6对PCa的进展起重要作用,与病情程度呈正相关[22]。在治疗结束3年后对患者的中位生存期进行随访发现,观察组患者中位生存期为(834.45±25.57)d,明显高于对照组的(526.63±35.37)d。朱永锋[23]研究发现多西他赛联合泼尼松组的中位生存期高于米托蒽醌联合泼尼松治疗组,与本研究结果相似。
综上所述,多西他赛联合泼尼松方案治疗激素抵抗性PCa近期疗效确切,远期疗效较佳,能够改善PCa患者免疫抑制状态,且毒性可耐受,值得临床推广使用。
[1]李鸣,张思维,马建辉,等.中国部分市县前列腺癌发病趋势比较研究[J].中华泌尿外科杂志,2009,30(6):368-370.
[2]SCHER H I,HALABI S,TANNOCK I,et al.Design and end points of clinical trials for patients with progressive prostate cancer and castrate levels of testosterone:recommendations of the prostate cancer clinical trials working group[J].J Clin Oncol,2008,26(7):1148-1159.
[3]刘永霞,朱小丽,陈玉华,等.雄激素非依赖前列腺癌细胞系代谢组学的初步研究[J].分析化学,2011,39(3):305-311.
[4]李宏志,刘民,朱庆环,等.手术去势间断联合多西他赛治疗晚期前列腺癌的疗效观察[J].实用癌症杂志,2016,31(6):1024-1026.
[5]杨恺惟,虞巍,宋毅,等.影响多西他赛联合泼尼松治疗转移性去势抵抗性前列腺癌疗效的因素分析[J].北京大学学报(医学版),2015,47(4):592-596.
[6]沈益君,卞晓洁,谢湖阳,等.多西他赛联合泼尼松或米托蒽醌联合泼尼松一线治疗转移性激素抵抗性前列腺癌的远期疗效及安全性分析[J].中华外科杂志,2012,50(6):539-542.
[7]叶定伟,孙燕.激素抵抗性前列腺癌的治疗进展[J].中国癌症杂志,2007,17(3):220-224.
[8]王盈,李绪渊,林英城.激素抵抗性前列腺癌的治疗进展[J].国际肿瘤学杂志,2014,41(1):56-59.
[9]王晴,杜君,杨庆,等.去势抵抗性前列腺癌的治疗进展[J].中国肿瘤临床,2016,43(17):766-769.
[10]何景良,何乐业.激素抵抗性前列腺癌的治疗进展[J].现代泌尿生殖肿瘤杂志,2012,4(6):358-361.
[11]杨国胜,陈昭典.激素抵抗性前列腺癌细胞增殖凋亡及Caspase-3活性的观察[J].中国男科学杂志,2009,23(9):30-34.
[12]王平,陈昭典.雄激素受体旁路途径在激素抵抗性前列腺癌发生中的作用及意义[J].中华泌尿外科杂志,2007,28(10):717-719.
[13]孙雪飞,赵晖,李扬,等.无雄激素条件下表皮生长因子诱导前列腺癌细胞系增殖及雄激素受体磷酸化[J].基础医学与临床,2014,34(3):305-309.
[14]叶定伟,朱一平.激素抵抗性前列腺癌的治疗选择[J].现代泌尿外科杂志,2011,16(1):6-9.
[15]鲍业忠,祁德安,张力,等.多西紫杉醇和米托蒽醌治疗激素抵抗性前列腺癌的效果观察[J].临床医学研究与实践,2016,1(17):91-92.
[16]TANNOCK I F,OSOBA D,STOCKLER M R,et al.Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer:a Canadian randomized trial with palliative end points[J].J Clin Oncol,1996,14(6):1756-1764.
[17]蔡晶,韩娜,张芳,等.舒尼替尼联合多西他赛对A549细胞增殖、凋亡、细胞周期及c-met、mek、erk mRNA表达的影响[J].郑州大学学报:医学版,2013,48(3):330-335.
[18]余景星,刘心,徐波,等.多西他赛诱导HL-60/ADR细胞凋亡及对P-gp,BCL-2,BAX蛋白表达的影响[J].中国实验血液学杂志,2010,18(2):311-316.
[19]PETRYLAK D P.Chemotherapy for androgen-independent prostate cancer[J].World J Urol,2005,23(1):10-13.
[20]TANNOCK I F,De W R,BERRY W R,et al.Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer[J].J Clin Oncol Official J,2004,26(2):242-248.
[21]Kreis W.Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced prostate cancer[J].J Urol,2004,351(15):1513-1520.
[22]穆占增,马宁.河北汉族人群IL-6基因多态性与前列腺癌风险的关联性研究[J].河北医科大学学报,2014,35(8):964-967.
[23]朱永锋.多西他赛/米托蒽醌联合泼尼松治疗激素抵抗性前列腺癌的临床研究[J].中国临床药理学杂志,2015,31(9):728-730.
