同型半胱氨酸经PERK磷酸化激活CHOP-ERO1α通路介导心肌细胞凋亡的研究
2018-03-06杜海林杨绍兵丛广志贾绍斌
杜海林,杨绍兵,丛广志,王 凯,贾绍斌△
(1.宁夏医科大学临床医学院,银川 750004;2.宁夏医科大学总医院心脏中心,银川 750004)
同型半胱氨酸(homocysteine,Hcy)是体内一种含硫氨基酸,近年相关研究表明,Hcy通过多种机制导致疾病的发生,并将其列为心血管疾病重要的独立危险因素[1]。在Hcy致心血管疾病的众多机制中,内质网应激(endoplasmic reticulum stress,ERS)作为近年来研究损伤与凋亡的热点而备受关注[2]。内质网是细胞内调节蛋白质合成和折叠的细胞器,体内外诸多因素导致错误折叠蛋白和未折叠蛋白集聚在内质网称ERS。在未发生应激时,内质网分子伴侣葡萄糖调节蛋白(glucose-regulated-protein,GRP78)与胰腺内质网激酶(pancreatic-ER-kinase,PERK)、肌醇必须酶-1(inositol requiring RNAse-1,IRE1)及转录激活因子-6(activating-transcription factor-6,ATF-6)紧密结合在一起,抑制后三者激活[3]。在应激状态下,PERK、IRE1、ATF-6和GRP78解离,进而结合未折叠蛋白,启动未折叠蛋白反应(unfolded protein response,UPR),阻止未折叠蛋白堆积而发挥细胞保护作用。但长时间ERS,PERK磷酸化为磷酸化PERK(p-PERK),后者激活下游的CCAAT增强子结合蛋白同源蛋白(CCAAT-enhancer-binding protein homologous protein,CHOP)及CHOP下游靶点内质网氧化还原酶1α(endoplasmic reticulum oxidoreductin-1α,ERO1α),启动凋亡程序[4]。有研究发现,慢性心力衰竭(CHF)患者血清Hcy水平较无心力衰竭患者增高,提示除缺血因素外,Hcy是导致CHF的又一独立危险因素,但其机制仍不清楚[5]。目前Hcy通过ERS促进动脉斑块形成的报道较多,而Hcy对心肌的影响鲜见报道。本研究旨在探讨Hcy是否通过ERS导致心肌细胞损伤,其损伤是否和 CHOP-ERO1α通路激活所介导的凋亡有关,以为临床干预提供理论依据。
1 材料与方法
1.1材料 H9C2心肌细胞由中乔新舟提供;Dulbecco′s 改良培养基(DMEM)及胎牛血清(FBS)购自Gibco公司,4-苯基丁酸( 4-phenylbutyric acid,4-PBA)及Hcy购自Sigma公司;十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)制备试剂盒购自康为世纪公司;抗GAPDH单抗及抗β-actin单抗购自中杉金桥公司;ER-Stress抗体试剂盒购自Cell Signaling Technology;Anti-ERO1α抗体购自Abcam公司;FITC标记山羊抗兔荧光二抗购自中杉金桥公司;全蛋白提取试剂盒及BCA蛋白浓度检测试剂盒均购自凯基生物公司;CCK-8细胞毒力检测试剂盒购自上海合元生物公司;罗氏TUNEL凋亡检测试剂盒购自Roche公司;酶标仪由Thermo公司提供。
1.2方法
1.2.1CCK-8检测Hcy及4-PBA对细胞损伤 将H9C2细胞于含10%FBS的DMEM(普通培养基)中培养,待细胞生长至对数期时用于实验:(1)将细胞重悬后接种于96孔板用于CCK-8检测,密度为1×103个/孔,并将其分为对照组(H0)及H组,培养24 h使其贴壁,对照组给予普通培养基培养,H组分别在上述普通培养基中加入终浓度为50、100、400、1 000 μmol/L的Hcy(分别为H50、H100、H400、H1000),每组10个复孔。培养72 h后更换无血清DMEM,并向每孔中加入CCK-8检测试剂10 μL。同时设置空白对照组:仅加入无血清培养基及CCK-8检测试剂。继续培养2 h后酶标仪检测OD值。(2)取上述对数生长期细胞检测4-PBA对细胞存活率的影响:将细胞分为对照组(P0)和P组,对照组给予普通培养基培养,P组分别在上述普通养基中加入终浓度为1、2、3、4、5 mmol/L的4-PBA(分别为P1、P2、P3、P4、P5),其余实验步骤同上,检测出2 mmol/L的4-PBA对细胞无损伤作用,并将此浓度用于后续实验。(3) 取对数生长的H9C2细胞,分为H组和HP2组,H组按上述(1)步骤加入不同浓度Hcy(分别为H50、H100、H400、H1000)。HP2组除按(1)步骤加入Hcy外,每组另加终浓度为2 mmol/L的4-PBA(分别为H50P2、H100P2、H400P2、H1000P2),其余操作同前。经过72 h干预,使用酶标仪检测96孔板OD值,通过OD值计算每孔细胞存活率。细胞存活率=(A干预-A空白)/(A对照-A空白) ×100%。A干预指含有细胞、CCK-8溶液和干预试剂孔的OD值;A空白指含有培养基和CCK-8溶液而没有细胞孔的OD值;A对照指含有细胞、CCK溶液而无药物溶液孔的OD值。
1.2.2TUNEL凋亡染色 经过CCK-8检测,根据细胞半数抑制率及存活率选择400 μmol/L的Hcy及2 mmol/L的4-PBA作为最适浓度,用于后续实验。预先在24孔板中放入细胞爬片,向孔内接种对数生长期H9C2细胞,密度为1×104个/孔,并将其分为对照组、H400组、H400P2组,贴壁24 h后,对照组给予普通培养基培养,H400组给予含Hcy终浓度为400 μmol/L上述普通培养基培养,H400P2组在H400组基础上加入终浓度为2 mmol/L的4-PBA。培养72 h后取出爬片,按罗氏TUNEL凋亡染色试剂盒说明进行操作,荧光显微镜下观察并计数视野下细胞总数及凋亡细胞数,每组计数10个视野用于统计学分析。
1.2.3免疫荧光检测ERO1α表达 预先在24孔板中放入细胞爬片,向孔内接种对数生长期H9C2细胞,密度为 5×103个/孔,并将其分为对照组、H400组、H400P2组,贴壁24 h后,对照组给予普通培养基培养,H400组给予含Hcy终浓度为400 μmol/L上述普通培养基培养,H400P2组在H400组基础上加入终浓度为2 mmol/L的4-PBA。培养72 h后取出爬片,4%多聚甲醛固定,3%过氧化氢作内源性过氧化物酶处理,1%Triton-X100通透,山羊血清封闭,加入抗ERO1α单抗(1∶200)于4 ℃过夜,次日PBS清洗后加入FITC标记山羊抗兔荧光二抗(1∶100),DAPI显色,荧光显微镜下观察细胞质红染的阳性细胞,并计数每个视野下阳性细胞数占该视野下细胞总数百分数,每组计数10个视野用于统计学分析。
1.2.4Western blot检测PERK/p-PERK/CHOP/ERO1α表达 取对数生长期H9C2细胞,重悬后将其接种于6孔板,密度为5×104个/孔,并将其分为对照组、P2组、H400组、H400P2组。贴壁24 h后,对照组给予普通培养基培养;P2组给予含4-PBA终浓度为2 mmol/L的上述普通培养基培养;H400组给予含Hcy终浓度为400 μmol/L的上述普通培养基培养;H400P2组在H400组基础上加入终浓度为2 mmol/L的4-PBA。培养72 h后使用全蛋白提取试剂盒提取各组细胞全蛋白,使用BCA蛋白检测试剂盒检测蛋白浓度,以10%SDS-PAGE电泳转移至聚偏二氟乙烯膜(PVDF),室温下脱脂牛奶封闭 90 min,加入相应一抗:PERK(1∶1 000)、p-PERK(1∶1 000)、 CHOP(1∶1 000)、ERO1α(1∶1 000)、GAPDH(1∶2 000)、β-actin(1∶2 000)于4 ℃孵育过夜,次日洗膜后加入相应的辣根过氧化物酶标记的二抗,室温孵育1 h。ClinxChemiScope6300化学发光成像系统自动曝光,并使用系统配套软件分析条带灰度值。以GAPDH或β-actin作为内参,重复实验3次,将3次实验结果所测得的灰度值作统计学分析。

2 结 果
2.1Hcy及4-PBA对细胞损伤 经不同浓度Hcy干预72 h后,细胞存活率明显降低,且随Hcy浓度增加存活率呈下降趋势,与对照组比较差异有统计学意义(F=2 039.580,P<0.01),见图1A。当Hcy浓度为400 μmol/L时,细胞存活率接近半数抑制率,故选用Hcy浓度为400 μmol/L完成后续实验。4-PBA为3 mmol/L时,可见明显损伤作用。而4-PBA为2 mmol/L时,对H9C2心肌细胞无明显损伤作用,与对照组比较差异无统计学意义(t=0.245,P=0.823),见图1B,故选用2 mmol/L的4-PBA作为后续实验浓度。Hcy浓度为50 μmol/L时,是否加入4-PBA,细胞存活率差异无统计学意义(t=0.320,P=0.755),见图1C。随着Hcy浓度增大,HP2组细胞存活率较同浓度H组明显增加,差异均有统计学意义(t=13.161、29.255、52.474,P<0.01)。
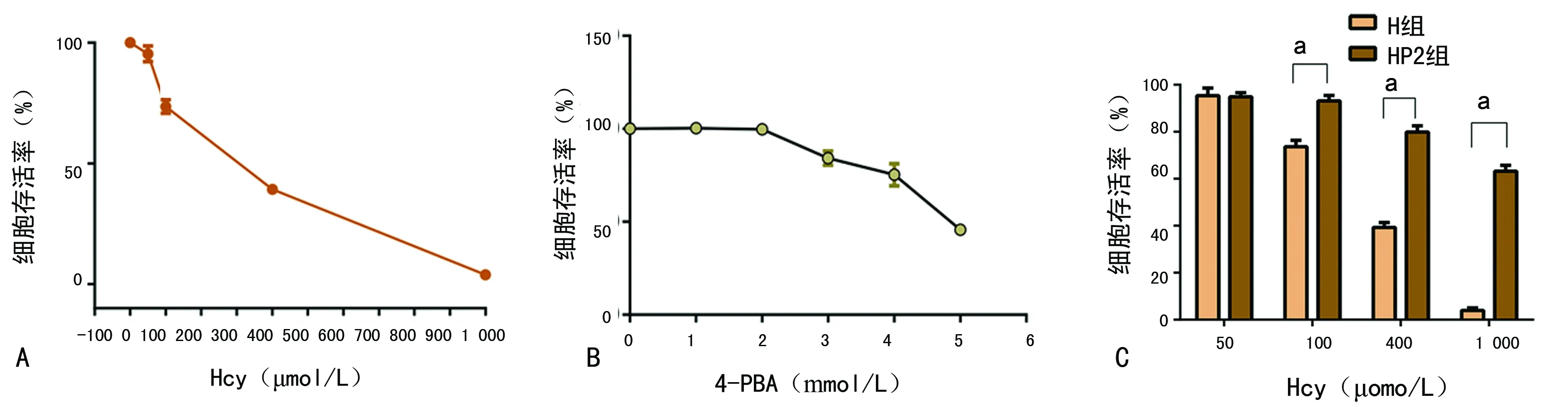
A:Hcy干预后细胞存活率;B:4-PBA干预后细胞存活率;C:相同Hcy浓度下H组与HP2组细胞存活率比较;a:P<0.01,与H组比较
图1不同浓度Hcy及4-PBA干预后的细胞存活率
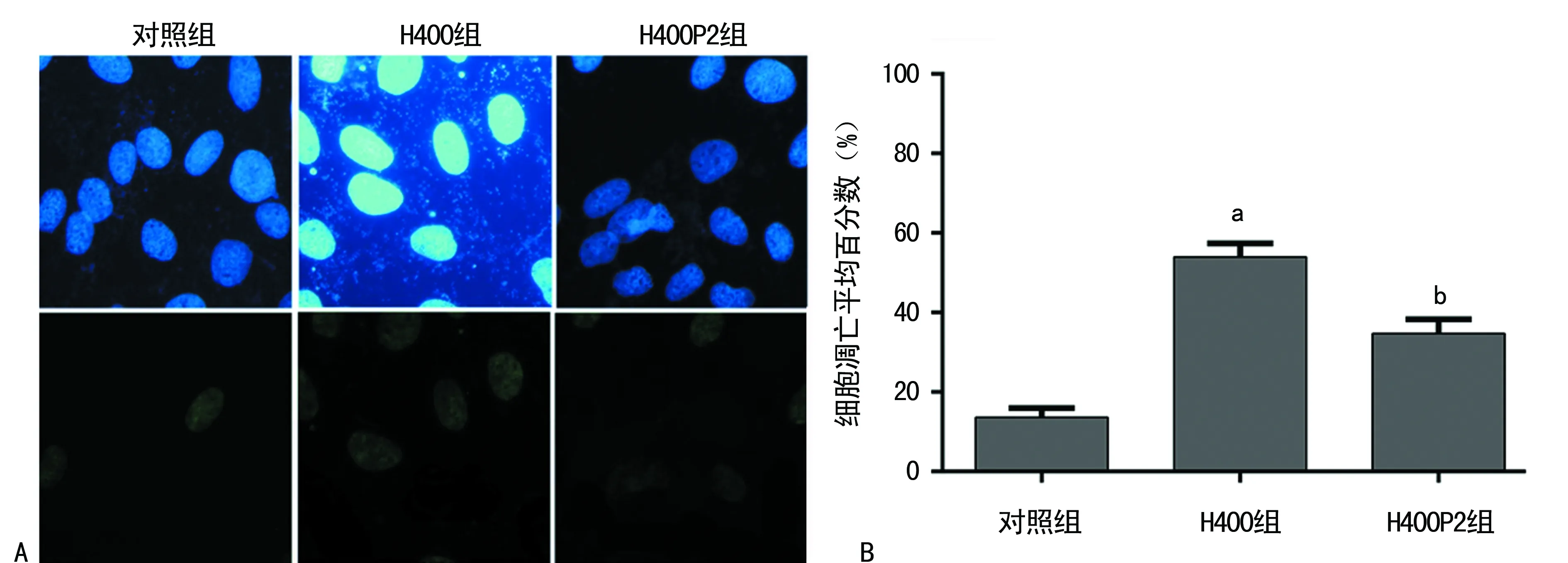
A:上图为视野下所有细胞,下图为凋亡细胞(×400);B:不同组凋亡平均百分数比较;a:P<0.01,与对照组比较;b:P<0.01,与H400组比较
图2 TUNEL细胞凋亡染色检测
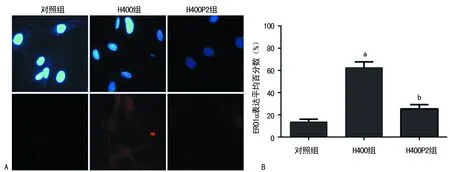
A:上图为视野下细胞总数,下图为阳性细胞(×400);B:各组ERO1α表达阳性细胞平均百分数;a:P<0.01,与对照组比较;b:P<0.01,与H400组比较
图3免疫荧光染色检测ERO1α表达
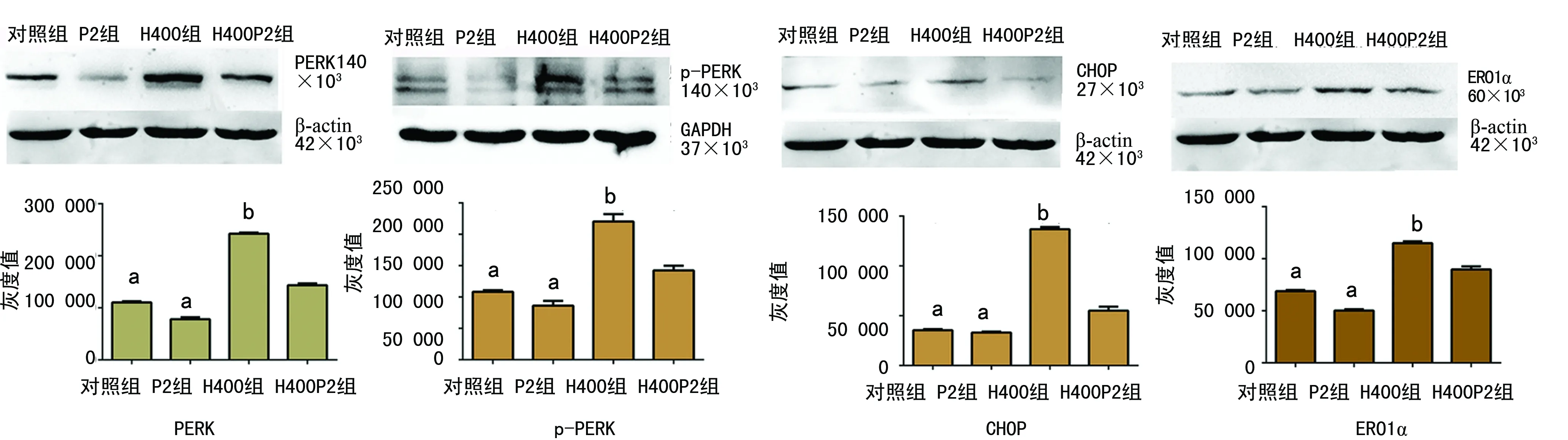
a:P<0.01,与示H400组比较;bP<0.01,与H400P2组比较
图4各组PERK、p-PERK、CHOP、ERO1α表达在各组中的条带灰度值
2.2TUNEL凋亡染色 H400组经400 μmol/L的Hcy干预后,与对照组比较,凋亡细胞分数明显增加(t=21.593,P<0.01);H400P2组由于培养基中含有2 mmol/L的4-PBA,与H400组比较,细胞凋亡分数明显减少(t=8.742,P<0.01),见图2A、B。
2.3免疫荧光检测ERO1α表达 与对照组比较,H400组细胞质ERO1α表达明显增加,差异有统计学意义(t=19.205,P<0.01);而同时经Hcy及4-PBA干预的H400P2组,ERO1α表达与H400组比较明显减低,差异有统计学意义(t=9.908,P<0.01),见图3A、B。
2.4Western blot检测PERK、p-PERK、CHOP、ERO1α表达 H9C2心肌细胞经400 μmol/L的Hcy干预后,ERS相关蛋白PERK、p-PERK、CHOP、ERO1α表达均有所增加,与对照组比较,各因子表达均差异有统计学意义(t=70.326、15.973、69.353、39.019,P<0.01)。与H400组比较,H400P2组PERK、p-PERK、CHOP、ERO1α表达均有所下降(t=40.766、9.540、30.390、12.587,P<0.01),见图4。
3 讨 论
Hcy作为体内蛋氨酸脱甲基代谢的一种中间产物,具有细胞毒性。当前的一些研究证实其毒性作用可致全身多种疾病,包括2型糖尿病、肿瘤、肾脏疾病及动脉粥样硬化等[6-7]。本研究第一次观察到Hcy对心肌细胞的直接损伤作用,并通过细胞模型探讨了损伤的机制,对临床高同型半胱氨酸血症(HHcy)的干预提供了理论依据。
HHcy(≥10 μml/L)是WHO近年公布的致心血管疾病新的危险因素[8]。关于Hcy致心血管疾病的机制,较为明确的有:(1)Hcy诱发氧化应激反应[9];(2)诱导平滑肌细胞增殖等导致动脉粥样硬化[10];(3)诱导生长抑制因子和DNA损伤诱导因子(GADD34)及T细胞死亡基因51(TDAG51)表达,触发ERS反应[11]。本课题组首先通过CCK-8试剂盒检测到了Hcy对心肌细胞损伤,同时通过TUNEL染色,证实了Hcy致心肌损伤的机制是通过促进细胞凋亡所致,最后采用免疫荧光及Western blot等手段,观察到了经Hcy干预后,ERS通路中,凋亡调节蛋白的表达增加,清楚地阐明了Hcy通过ERS致心肌凋亡的一条通路。首次发现了Hcy通过ERS机制,直接导致心肌损伤。
Hcy是人体蛋氨酸代谢的产物,体内叶酸和维生素B12缺乏都将导致血清Hcy积聚[12]。故目前对HHcy的预防主要是补充维生素B12和叶酸[13]。但近来一些临床相关的Meta分析显示,人为的补充VB12和叶酸并不能降低临床发生心血管事件的风险[14]。因此需要探索新的手段对临床高Hcy进行干预,本实验结果显示,在含有Hcy的培养基中加入4-PBA,细胞损伤明显减轻,TUNEL染色也提示相应凋亡细胞比例减少,Western blot也显示,4-PBA干预后的心肌细胞内质网通路相关蛋白PERK、p-PERK、CHOP、ERO1α表达均有所下降,而CHOP及ERO1α被认为是细胞凋亡的起始因子,此二者表达增加提示Hcy可以经凋亡通路介导心肌损伤[15-16]。其机制可能为4-PBA作为一个分子伴侣,通过阻断炎症信号,稳定蛋白构象而抑制ERS[17]。同时通过辅助内质网进行正确的蛋白折叠,减轻ERS负担,从而抑制 CHOP及其下游分子ERO1-α转录和翻译,减轻心肌细胞凋亡,发挥心肌保护作用。本实验创新之处在于引入4-PBA,一方面利用其对ERS的阻断作用,证实ERS在Hcy致心肌细胞凋亡过程中的重要性,另一方面也为血清高Hcy的干预寻找可能的靶点。
总之,本研究证实了Hcy对心肌细胞的直接损伤,其对心肌细胞的损伤是通过促细胞凋亡实现的,至少有一条通路是通过激活ERS,促进PERK磷酸化,介导CHOP及ERO1α表达,导致细胞凋亡。同时本研究还有许多不足之处,比如,未探讨Hcy对ERS其他通路的影响,未进行体内实验等,这些不足课题组将在后续研究中加以补充。
[1]KOSOKABE T,OKUMURA K,SONE T,et al.Relation of a common methylenetetrahydrofolate reductase mutation and plasma homocysteine with intimal hyperplasia after coronary stenting[J].Circulation,2001,103(16):2048-2054.
[2]ZHANG C,KAWAUCHI J,ADACHI M T,et al.Activation of JNK and transcriptional repressor ATF3/LRF1 through the IRE1/TRAF2 pathway is implicated in human vascular endothelial cell death by homocysteine[J].Biochem Biophys Res Commun,2001,289(3):718-724.
[3]WALTER P,RON D.The unfolded protein response:from stress pathway to homeostatic regulation[J].Science,2011,334(6059):1081-1086.
[4]SZEGEZDI E,MACDONALD D C,GUPTA S,et al.Bcl-2 family on guard at the ER[J].Am J Physiol Cell Physiol,2009,296(5):C941-953.
[5]AGOSTON-COLDEA L,MOCAN T,GATFOSSE M,et al.Plasma homocysteine and the severity of heart failure in patients with previous myocardial infarction[J].Cardiol J,2011,18(1):55-62.
[6]ZHU L,JIA F,WEI J,et al.Salidroside protects against homocysteine-induced injury in human umbilical vein endothelial cells via the regulation of endoplasmic reticulum stress[J].Cardiovasc Ther,2017,35(1):33-39.
[7]CHENG J,KAPLOWITZ N.Hyperhomocysteinemia,endoplasmic reticulum stress,and alcoholic liver injury[J].World J Gastroenterol,2004,10(12):1699-1708.
[8]ANTONIADES C,ANTONOPOULOS A S,TOUSOULIS D,et al.Homocysteine and coronary atherosclerosis:from folate fortification to the recent clinical trials[J].Eur Heart J,2009,30(1):6-15.
[9]DAYAL S,ARNING E,BOTTIGLIERI T,et al.Cerebral vascular dysfunction mediated by superoxide in hyperhomocysteinemic mice[J].Stroke,2004,35(8):1957-1962.
[10]YOUNG P B,KENNEDY S,SCOTT J M,et al.Lipid peroxidation induced in vivo by hyperhomocysteinaemia in pigs[J].Atherosclerosis,1997,129(1):67-71.
[11]POONE G K,HASSELDAM H,MUNKHOLM N,et al.The hypothermic influence on CHOP and Ero1-alpha in an endoplasmic reticulum stress model of cerebral ischemia[J].Brain Sci,2015,5(2):178-187.
[12]COOK J,YIN Q,MALINOW R.Hyperhomocyst(e)inemia induces accelerated transplant vascular sclerosis in syngeneic and allogeneic rat cardiac transplants[J].Am J Transplant,2002,2(3):244-251.
[13]OZKAN Y,OZKAN E,SIMSEK B.Plasma total homocysteine and cysteine levels as cardiovascular risk factors in coronary heart disease[J].Int J Cardiol,2002,82(3):269-277.
[14]HUANG T,CHEN Y,YANG B,et al.Metaanalysis of B vitamin supplementation on plasma homocysteine,cardiovascular and all-cause mortality[J].Clin Nutri,2012,31(4):448-454.
[15]LI G,MONGILLO M,CHIN K T,et al.Role of ERO1-alpha-mediated stimulation of inositol 1,4,5-triphosphate receptor activity in endoplasmic reticulum stress-induced apoptosis[J].J Cell Biol,2009,186(6):783-792.
[16]MCCULLOUGH K D,MARTINDALE J L,KLOTZ L O,et al.Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl2 and perturbing the cellular redox state[J].Mol Cell Biol,2001,21(4):1249-1259.
[17]RANGA RAO S,SUBBARAYAN R,AJITKUMAR S,et al.4PBA strongly attenuates endoplasmic reticulum stress,fibrosis,and mitochondrial apoptosis markers in cyclosporine treated human gingival fibroblasts[J].J Cell Physiol,2017,9999(1):1-7.
